吴晓东,邹艳丽,刘雨田,李金明,张永强,刘 珊,王志亮*
(1.扬州大学兽医学院,扬州 225009;2.中国动物卫生与流行病学中心 国家外来动物疫病研究中心 国家BSE参考实验室,青岛 266032)
N2a细胞增殖的痒病小鼠适应毒株RML的致病特性分析
吴晓东1,2,邹艳丽2,刘雨田2,李金明2,张永强2,刘 珊2,王志亮2*
(1.扬州大学兽医学院,扬州 225009;2.中国动物卫生与流行病学中心 国家外来动物疫病研究中心 国家BSE参考实验室,青岛 266032)
为鉴定细胞体外增殖的痒病小鼠适应毒株RML的致病特性,包括致病性和株系特征等,用RML感染的N2a(Sc-N2a)细胞裂解物接种C57BL/6J小鼠进行研究。结果显示:经(200±28) d的潜伏期后,C57BL/6J小鼠全部发病死亡,临床症状均表现为共济失调,而接种N2a细胞裂解物的C57BL/6J小鼠与接种Sc-N2a细胞裂解物的PrP基因敲除小鼠均正常存活。Sc-N2a细胞增殖的PrPSc与发病小鼠脑组织中PrPSc具有同样的糖基化模式,三种糖基化PrPSc具相同的迁移率,而且均是以单糖基化形式为主。发病小鼠的病理学研究结果显示:脑部的海绵状空泡主要分布于脑干、大脑、小脑、丘脑;脑部的PrPSc主要分布于大脑皮质、海马、丘脑,在小脑、四迭体、嗅球有少量的分布。小鼠回归试验表明:Sc-N2a细胞增殖的PrPSc对小鼠具致病性,并保留RML的株系特征,是TSEs研究的理想细胞模型。
N2a细胞;痒病小鼠适应毒株RML;PrPSc;致病性;株系特征
传染性海绵状脑病(transmissible spongiform encephalopathies,TSEs)是动物和人的一类中枢神经系统的慢性、退化性、致死性疾病,包括牛海绵状脑病(bovine spongiform encephalopathy,BSE)、羊痒病(scrapie)、人的克雅病(Creutzfeldt-Jakob disease,CJD)等。TSEs的病原为宿主基因编码的蛋白质(PrPC)的异构体(PrPSc),称为朊病毒(Prion)[1-2],变构过程在蛋白质翻译后发生。
TSEs特征性的病理变化是神经纤维网空泡化、神经元损伤、朊病毒大量积聚等,而且具有明显的宿主种属特异性及朊病毒的株系特异性[3-4],不同株系PrPSc的蛋白酶消化位点及其糖基化模式有所区别。小鼠是TSEs研究中最常用动物模型,具易操作、饲养成本低、遗传背景清晰、发病潜伏期短等优点。目前,用于区分株系的方法仍主要基于小鼠试验,即各毒株经特定基因型小鼠连续传代后的临床症状、潜伏期及其神经病理学等方面特征。体外培养的细胞也可感染并持续增殖PrPSc,也已广泛用作TSEs亚细胞水平研究的模型,具传代周期超短、持续感染等优点。以细胞模型为研究工具,对PrPSc转变的分子机制、亚细胞水平定位、种间障碍决定因子、具诊断学意义的TSEs标志物、治疗药物做了大量探索[5-9]。
本研究以痒病小鼠适应毒株RML成功感染N2a细胞,连续传代后仍能稳定增殖PrPSc,随后用感染细胞的裂解物进行小鼠脑内接种试验,证实感染细胞增殖的PrPSc对小鼠具有致病性,并保留了RML的株系特征。
1 材料与方法
1.1 毒株和细胞
痒病小鼠适应毒株RML系由R.L.Chandler将绵羊痒病病料接种小鼠后获得[10],之后落基山实验室(Rocky Mountain Laboratory)利用该毒株开展了大量研究工作,因此将毒株命名为RML。本实验室将RML脑内接种C57BL/6J小鼠,连续传3代后收获发病死亡小鼠脑组织,供细胞感染用。小鼠成神经细胞瘤细胞(N2a)购自中国科学院细胞资源中心。
1.2 实验动物
6周龄清洁级雌性C57BL/6J小鼠购自北京维通利华实验动物技术有限公司,PrP基因敲除小鼠(PrP0/0mice,ZurichⅠ型)引自瑞士苏黎世大学。动物试验在ABSL-3实验室进行。
1.3 抗体和主要试剂
抗PrP单抗1H2由本实验室研制[11],辣根过氧化物酶(HRP)标记兔抗鼠IgG抗体购自Sigma公司。高糖型DMEM、胎牛血清购自Gibco公司。细胞裂解液(M-PER Mammalian Protein Extraction Reagent)购自Pierce公司,蛋白酶K(Proteinase K,PK)、苯甲基磺酰氟(PMSF)购自Amreco公司,免疫组化显色试剂盒(ChemMateTMAEC/H2O2substrate solution)购自Dako公司,化学发光底物(LumiGLO®Chemiluminescent Substrate)购自KPL公司,底片(X-Omat BT film)购自Kodak公司,PVDF膜购自Millipore公司。
1.4 细胞感染
痒病小鼠适应毒株RML感染小鼠成神经细胞瘤细胞(N2a)按N.Nishida等的方法进行[12]。N2a细胞在37 ℃、5%CO2条件下培养,培养基为添加10%灭能胎牛血清的高糖型DMEM。待接种的N2a细胞(25 cm2细胞瓶)单层融合长至50%,倾去培养基,DMEM洗涤2次,加入2.5 mL 2%痒病小鼠适应毒株RML的脑匀浆(DMEM稀释),37 ℃、5%CO2条件下孵育4 h,再加入2.5 mL的10%DMEM孵育20 h后,置换成10%DMEM继续培养48 h,按1∶3的比例分瓶,连续传20代。免疫印迹试验检测RML感染的N2a(Sc-N2a)细胞PrPSc的增殖情况。
1.5 动物接种
N2a、Sc-N2a细胞采用75 cm2细胞瓶培养,当细胞单层长至90%,将细胞刮下,悬浮于1 mL·瓶-1PBS中,冻融4次,台式高速离心机(SORVALL Pico,Kendro公司)2 000 r·min-1离心5 min后取上清,置-80 ℃备用,用于动物接种。动物分成3组接种:No.1组10只6周龄C57BL/6J小鼠,脑内注射Sc-N2a细胞裂解产物;No.2组10只6周龄C57BL/6J小鼠,脑内注射N2a细胞裂解产物,作为正常细胞对照组;No.3组10只6周龄PrP基因敲除小鼠,脑内注射Sc-N2a细胞裂解产物,作为感染细胞对照组。接种量均约为25 μL·只-1。接种后的小鼠持续观察至其发病死亡,发病时间以出现共济失调、弓背等明显临床症状的时间为准。
1.6 病理学检查
发病小鼠频临死亡的时候脱椎致死,随即采集脑组织,用10%的福尔马林(3.7%~4%甲醛)固定后,按常规程序制备5~10 μm厚的石蜡切片,采用苏木素伊红(HE)染色及免疫组织化学染色;用于免疫印迹试验的新鲜脑组织样品用PBS制成相对体积质量10%脑匀浆,置-80 ℃保存。对照组小鼠在接种后210 d进行采样,处理程序同上。脑组织石蜡切片按常规方法进行HE染色,显微镜观察空泡变化及其分布特征。免疫组化染色程序如下:脱腊至水→PK消化→水化高压→内源酶的灭活→封闭→抗PrP单抗1H2孵育→显色→苏木素复染→封片,显微镜观察特征性的染色颗粒及其分布特征。
1.7 免疫印迹试验
细胞(75 cm2细胞瓶×1)单层融合长至90%,将细胞刮下,加入200 μL细胞裂解液,冰浴条件轻摇10 min裂解细胞,13 000 r·min-1离心(SORVALL Pico,Kendro公司)20 min,沉淀用40 μL PBS悬浮,取20 μL与5 μL 5×PK buffer(50 mmol·L-1Tris-Cl (pH 7.5),25 mmol·L-1EDTA,1.25% SDS)混合后,25 μg·mL-1PK在37 ℃水浴条件下消化30 min,终浓度1 mmol·L-1PMSF终止消化反应,加入等体积的2×上样缓冲液(100 mmol·L-1Tris-HCl,pH 6.8,含10%glycerol,4%SDS,200 mmol·L-1DTT),煮沸5 min,样品经12% SDS-PAGE电泳分离后,转印至PVDF膜(Millipore公司),TBST(10 mmol·L-1Tris,150 mmol·L-1sodium chloride,0.1%Tween-20,pH7.4)配制的2%BSA封闭过夜,工作浓度的抗PrP单抗1H2室温孵育1 h,TBST洗涤5遍,工作浓度的辣根过氧化物酶(HRP)标记兔抗鼠IgG抗体室温孵育1 h,TBST洗涤5遍,化学发光底物作用1 min后,与底片曝光2 min,洗片。质量浓度10%脑匀浆样品的PK消化、免疫印迹试验程序同上。
2 结 果
2.1 Sc-N2a细胞增殖PrPSc的免疫印迹鉴定
免疫印迹试验结果显示:痒病小鼠适应毒株RML成功感染N2a,连续传代后仍能稳定增殖PrPSc,获得持续感染RML的Sc-N2a细胞。N2a细胞的PrP可被PK完全消化,而Sc-N2a细胞裂解物中检测到可抗PK消化的PrP27-30(图1),呈现3条带,自上往下依次是双糖基化、单糖基化、无糖基化3种类型,三种糖基化形式所占比例不同,单糖基化形式的含量最高。
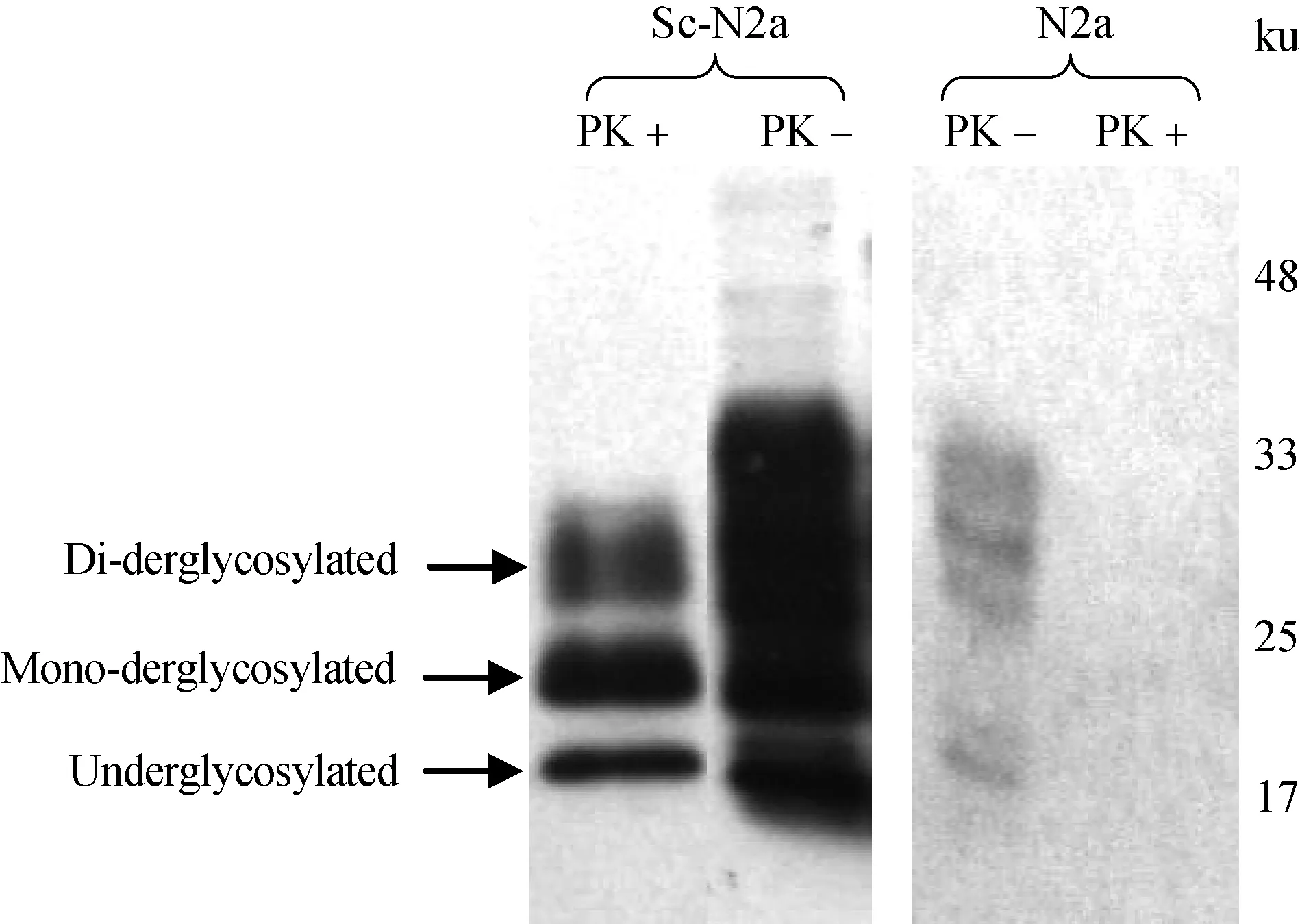
图1 痒病小鼠适应毒株RML感染的N2a细胞中PrPSc的免疫印迹鉴定Fig.1 Immunodetection of PK-resistant PrP in N2a lysates infected with Scrapie strain RML
Sc-N2a细胞与N2a细胞在形态上存在差异,N2a细胞形态均一,而Sc-N2a细胞具多形性且多数具有突触(图2)。
2.2 小鼠发病情况
No.1组脑内接种Sc-N2a细胞裂解产物的C57BL/6J小鼠全部发病死亡,接种小鼠的潜伏期为(200±28)d;最初症状表现为运动减少、精神萎靡,随之呈现特征性的“共济失调”,最后后肢麻痹,直至死亡(图3);整个病程中,体重持续下降,有的伴有单侧性失明、大小便失禁等症状。No.2组脑内注射正常细胞裂解产物,所有注射C57BL/6J小鼠无任何异常。No.3组脑内接种Sc-N2a细胞裂解产物,所有接种PrP基因敲除小鼠无任何异常。
小鼠脑内接种试验证实:Sc-N2a细胞增殖PrPSc对野生型小鼠具致病性,可致接种野生型小鼠100%发病死亡;PrP基因敲除小鼠可完全抵抗PrPSc的感染[13]。
2.3 小鼠脑组织PrPSc的免疫印迹鉴定
No.2组小鼠的脑匀浆经PK消化后没有任何条带,而No.1组小鼠的脑匀浆中检出具PK抗性的PrPSc(图4)。
发病小鼠脑匀浆中PrPSc的免疫印迹图谱展示了与细胞型PrPSc相同的糖基化模式(图1),三种糖基化形式PrPSc具相同的迁移率,而且都是以单糖基化形式为主。
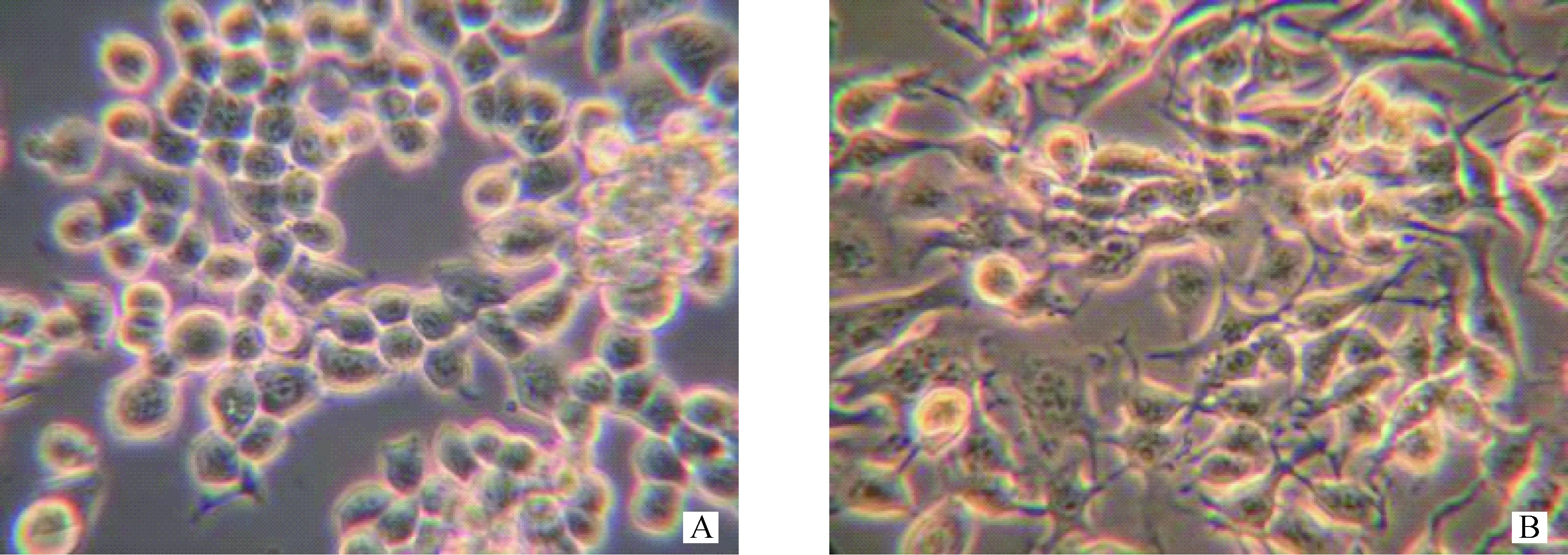
A.N2a细胞;B.Sc-N2a细胞A.N2a cell lines;B.Sc-N2a cell lines图2 N2a及Sc-N2a细胞形态(200×)Fig.2 The morphology of N2a cell lines and Sc-N2a cell lines (200×)
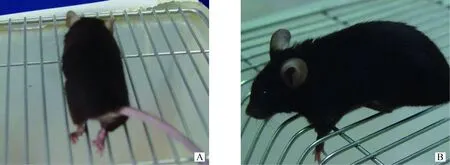
A.发病小鼠后肢无法支撑;B.发病小鼠前肢无法支撑A.Mouse does not support itself with rear legs;B.Front limb extends below grid图3 发病小鼠的临床症状Fig.3 Clinically positive scrapie-injected mice on grid
1.No.2组小鼠脑匀浆(PK消化前);2.No.2组小鼠脑匀浆(PK消化后);3.No.1组发病小鼠脑匀浆(PK消化前);4.No.1组发病小鼠脑匀浆(PK消化后)1.Brain homogenates from No.2 non-infected C57BL/6J mice without PK digested;2.Brain homogenates from No.2 non-infected C57BL/6J mice with PK digested;3.Brain homogenates from No.1 infected C57BL/6J mice without PK digested;4.Brain homogenates from No.1 infected C57BL/6J mice with PK digested图4 小鼠脑匀浆中PrPSc的免疫印迹鉴定Fig.4 Immunodetection of PK-resistant PrP in brain homogenates infected with prion strain RML from N2a
上述结果说明:Sc-N2a细胞增殖PrPSc保留痒病小鼠适应毒株RML的糖基化模式。
2.4 小鼠脑组织的病理学变化
脑组织的海绵状空泡变化、神经元减少、神经胶质增生是Prion疾病的普遍特征,脑部病理学变化的分布及其严重程度具有明显的株系特异性。No.1组发病小鼠的脑组织中出现典型的空泡病变,No.2、3组小鼠的脑组织没有空泡变化。空泡的分布特点如下:脑干、大脑、小脑、丘脑的空泡较多(图5),海马、基底前脑、四迭体的空泡较少,空泡的大小不一。脑干、大脑、丘脑的空泡呈现弥散性分布,小脑的空泡集中分布在白质,在颗粒层有零星的分布。
2.5 小鼠脑组织的免疫组化染色
No.1组发病小鼠脑组织中PrPSc主要分布于大脑皮质、海马、丘脑,四迭体、小脑有少量分布,大脑的白质、海马的颗粒细胞层、小脑的髓质未见有PrPSc。大脑皮质、海马、丘脑中的PrPSc呈弥散性分布,丘脑中可观察到较多的斑块状染色(图6)。
A.脑干;B.大脑皮质;C.小脑;D.丘脑;标尺=200 μmA.Brain stem;B.Cortex;C.Cerebellum;D.Thalamus;Scale bar=200 μm图5 发病小鼠脑组织中空泡样病理变化(HE)Fig.5 Histological features of brain tissues infected with RML (HE)
A.大脑皮质;B.海马;C.丘脑;D.小脑;标尺=200 μmA.Cortex;B.Hippocampus;C.Thalamus;D.Cerebellum;Scale bar=200 μm图6 发病小鼠脑组织中PrPSc的分布(IHC)Fig.6 PrPSc immunohistochemistry features of brain tissues infected with RML (IHC)
3 讨 论
来自动物及人类的TSEs病料初次接种小鼠,往往采用10%的脑匀浆作为接种体,腹膜内和脑内联合接种的方法。成功感染小鼠的毒株,在同一基因型的小鼠连续传代后,所表现出来的特征可定义为该小鼠适应毒株的株系特征。R.L.Chandler将痒病病料接种CD-1小鼠连续传代,获得痒病小鼠适应毒株RML。通过本研究,作者成功获得持续感染痒病小鼠适应毒株RML的N2a细胞(Sc-N2a),经连续传代后,仍然能稳定的增殖PrPSc,Sc-N2a细胞的形态明显有别于N2a细胞,具明显的多形性。Sc-N2a细胞裂解产物脑内接种C57BL/6J小鼠,经200 d左右的潜伏期后,小鼠全部发病死亡,证实了Sc-N2a细胞增殖的PrPSc对野生型小鼠具有致病性,构建成功痒病细胞模型。在细胞水平进行抗Prion药物以及检测标志物筛选,不仅具有周期超短、操作简单以及结果确实等优点,而且可以进行大规模筛选。此外,在细胞水平进行改造,远比在小鼠等实验动物层面进行操作简单、经济,例如改变PrPC表达水平、敲除相关基因、插入外源基因等,为PrPC生理功能、PrPSc转变机制等探索性研究提供了高效细胞平台。
痒病感染小鼠的脑部病理学特征非常明显,不同的痒病毒株的脑部神经病理学分布有其独特的模式,称为“lesion profiles”[14-15],是痒病“株系特征”最为重要的表型,通常认为病理特征与首次接种的剂量无相关性。痒病小鼠适应毒株RML虽已广泛用于朊病毒研究[16-20],但对该毒株神经病理学特征的研究仍不全面。本研究对细胞增殖RML的神经病理学变化进行了详尽的研究,获得了RML最为详尽的“lesion profiles”,包括脑部空泡分布特点以及PrPSc的沉积特点,可为其基于该毒株的相关研究提供参考依据。有学者称神经纤维网中的空泡分布与PrPSc的分布应是一致的[21],与作者的试验结果相左,其中原因有待进一步考证。株系特征还体现在糖基化程度、潜伏期、临床症状等方面。不同株系的PrPSc糖基化差异与TSEs的表型密切相关[22-23],而且由于其PK消化位点的差异,所以不同株系PrPSc酶切后片段的电泳图谱也相应地具其株系特征[24]。BSE株系的PrPSc具高水平的双糖基化,低水平的单糖基化,多数痒病株系则以单糖基化为主。作者对细胞及脑组织来源的PrPSc的糖基化模式也做了鉴定,结果显示两种来源的PrPSc的电泳图谱完全一致,PK消化位点没有发生改变,且都是以单糖基化为主,说明痒病小鼠毒株RML的株系特征在传代细胞系上得以保留。痒病小鼠适应毒株的潜伏期决定于下面几个相互影响的因素:接种剂量、接种途径、小鼠PRNP基因。本研究中攻毒的小鼠全部发病,并均表现出痒病特征性的“共济失调”症状。尽管采用了脑内接种途径,但由于Sc-N2a细胞裂解产物中PrPSc的含量偏低,且为初次传代,所以导致潜伏期有所延长,这并非是RML毒株的株系特征发生变化。
TSEs株系的分子基础至今仍在探索中,单一的PrP序列可转变成多种类型的PrPSc,每种都可导致不同的病理表型[3-4],但目前多数学者倾向于认同“株系特征”信息隐含于PrPSc特殊结构中,究竟TSEs毒株以何种方式携带并复制“株系特征”信息仍不清楚。本研究获得的痒病毒株感染细胞,可继续用于下一步TSEs株系的相关研究。
4 结 论
成功用痒病小鼠适应毒株RML持续感染N2a细胞,小鼠回归试验表明Sc-N2a增殖的PrPSc具致病性,并保留了该毒株的株系特征,是TSEs研究的理想细胞模型。
[1] PRUSINER S B.Novel proteinaceous infectious particles cause scrapie [J].Science,1982,216(4542):136-144.[2] LEGNAME G,BASKAKOV I V,NGUYEN H O,et al.Synthetic mammalian prions [J].Science,2004,305(5684):673-676.
[3] TELLING G C,PARCHI P,DEARMOND S J,et al.Evidence for the conformation of the pathologic isoform of the prion protein enciphering and propagating prion diversity [J].Science,1996,274(5295):2079-2082.[4] SAFAR J,COHEN F E,PRUSINER S B.Quantitative traits of prion strains are enciphered in the conformation of the prion protein [J].ArchVirolSuppl,2000(16):227-235.
[5] CAUGHEY B,RACE R E,ERNST D,et al.Prion protein biosynthesis in scrapie-infected and uninfected neuroblastoma cells [J].JVirol,1989,63(1):175-181.[6] TARABOULOS A,SCOTT M,SEMENOV A,et al.Biosynthesis of the prion proteins in scrapie-infected cells in culture [J].BrazJMedBiolRes,1994,27(2):303-307.
[7] SENATOR A,RACHIDI W,LEHMANN S,et al.Prion protein protects against DNA damage induced by paraquat in cultured cells [J].FreeRadicBiolMed,2004,37(8):1224-1230.
[8] BARON G S,MAGALHES A C,PRADO M A,et al.Mouse-adapted scrapie infection of SN56 cells:greater efficiency with microsome-associated versus purified PrP-res [J].JVirol,2006,80(5):2106-2117.
[9] KOCISKO D A,ENGEL A L,HARBUCK K,et al.Comparison of protease-resistant prion protein inhibitors in cell cultures infected with two strains of mouse and sheep scrapie [J].NeurosciLett,2005,388(2):106-111.
[10] CHANDLER R L.Encephalopathy in mice produced by inoculation with scrapie brain material [J].Lancet,1961,1(7191):1378-1379.
[11] 吴晓东,张永强,刘雨田,等.抗朊蛋白单克隆抗体的免疫学特性研究 [J].扬州大学学报(农业与生命科学版),2009,30(4):6-10. WU X D,ZHANG Y Q,LIU Y T,et al.Immunological characteristics of Anti-PrP McAbs [J] .JournalofYangzhouUniversity(AgriculturalandLifeScienceEdition),2009,30(4):6-10.(in Chinese)
[12] NISHIDA N,HARRIS D A,VILETTE D,et al.Successful transmission of three mouse-adapted scrapie strains to murine neuroblastoma cell lines overexpressing wild-type mouse prion protein [J].JVirol,2000,74(1):320-325.
[13] BÜELER H,AGUZZA,SAILER A,et al.Mice devoid of PrP are resistant to scrapie [J].Cell,1993,73(7):1339-1347.
[14] BRUCE M E,FRASER H.Effect of route of infection on the frequency and distribution of cerebral amyloid plaques in scrapie mice [J].NeuropatholApplNeurobiol,1981,7(4):289-298.
[15] KIM Y S,CARP R I,CALLAHAN S M,et al.Vacuolization,incubation period and survival time analyses in three mouse genotypes injected stereotactically in three brain regions with the 22L scrapie strain [J].JNeuropatholExpNeurol,1990,49(2):106-113.
[16] MAHAL S P,JABLONSKI J,SUPONITSKY-KROYTER I,et al.Propagation of RML prions in mice expressing PrP devoid of GPI anchor leads to formation of a novel,stable prion strain [J].PLoSPathog,2012,8(6):e1002746.
[17] SMITH J D,NICHOLSON E M,FOSTER G H,et al.Exposure of RML scrapie agent to a sodium percarbonate-based product and sodium dodecyl sulfate renders PrPSc protease sensitive but does not eliminate infectivity [J/OL].BMCVetRes,2013,9:8.[2014-12-17].http://www.biomedcentral.com/content/pdf/1746-6148-9-8.pdf.
[18] USHIKI-KAKU Y,SHIMIZU Y,TABETA N,et al.Heterogeneity of abnormal prion protein (PrP(Sc)) in murine scrapie prions determined by PrP(Sc)-specific monoclonal antibodies [J].JVetMedSci,2014,76(2):285-288.
[19] CHOI Y P,PRIOLA S A.A specific population of abnormal prion protein aggregates is preferentially taken up by cells and disaggregated in a strain-dependent manner [J].JVirol,2013,87(21):11552-11561.
[20] OELSCHLEGEL A M,WEISSMANN C.Acquisition of drug resistance and dependence by prions [J].PLoSPathog,2013,9(2):e1003158.
[21] KIMBERLIN R H,WALKER C A.Pathogenesis of scrapie:agent multiplication in brain at the first and second passage of hamster scrapie in mice [J].JGenVirol,1979,42(1):107-117.
[22] DEARMOND S J,SANCHEZ H,YEHIELY F,et al.Selective neuronal targeting in prion disease [J].Neuron,1997,19(6):1337-1348.
[23] HILL A F,SIDLE K C,JOINER S,et al.Molecular screening of sheep for bovine spongiform encephalopathy [J].NeurosciLett,1998,255(3):159-162.
[24] WADSWORTH J D,HILL A F,BECK J A,et al.Molecular and clinical classification of human prion disease [J].BrMedBull,2003,66:241-254.
(编辑 白永平)
Pathogenic Characteristics of Mouse-adapted Scrapie Strain RML Propagated in N2a Cell Line
WU Xiao-dong1,2,ZOU Yan-li2,LIU Yu-tian2,LI Jin-ming2,ZHANG Yong-qiang2, LIU Shan2,WANG Zhi-liang2*
(1.SchoolofVeterinaryMedicine,YangzhouUniversity,Yangzhou225009,China; 2.NationalBSEReferenceLab,NationalResearchCenterforExoticAnimalDiseases,ChinaAnimalHealthandEpidemiologyCenter,Qingdao266032,China)
To identify the pathogenic characteristics of mouse-adapted Scrapie Strain RML propagated in N2a cell line,we intracerebrally inoculated mice with the lysate of Sc-N2a cell culture.After 200±28 days’ incubation period,all inoculated C57BL/6J mice appeared typical ataxia symptoms of TSEs.The PrPScfrom both brain tissues and Sc-N2a cells shared the same biochemical aspects.Western blotting result confirmed that they had the same glycosylation patterns,the same size distribution of PK digestion fragments,with higher levels of monoglycosylated.The pathological changes of brain sections from inoculated mice at the terminal stage were analyzed by HE stain and IHC assay.Vacuoles were mainly found in brain stem,cortex,cerebellum and thalamus,while PrPScdeposits mainly in cortex,hippocampus,thalamus,cerebellum.The results of mouse regression test showed that the PrPScpropagated in N2a cell line had pathogenicity,and kept the the stain characteristics of mouse-adapted scrapie strain RML.The Sc-N2a cell line is an ideal model for the study of TSEs.
N2a cell line;mouse-adapted scrapie strain RML;PrPSc;pathogenicity;strain characteristics
10.11843/j.issn.0366-6964.2015.02.012
2014-10-28
转基因生物新品种培育科技重大专项(2014ZX08008-001B)
吴晓东(1975-),男,江苏宿迁人,副研究员,主要从事重大外来动物疫病的综合防控技术研究,E-mail:wuxiaodong@cahec.cn
*通信作者:王志亮,研究员,Tel:0532-85639166,E-mail:wangzhiliang@cahec.cn
S852.659.7
A
0366-6964(2015)02-0257-07



