冯晓辉,汤 承,朱 鑫,岳 华
(西南民族大学生命科学与技术学院,成都 610041)
核不均一核糖核蛋白与病毒复制
冯晓辉,汤 承,朱 鑫,岳 华*
(西南民族大学生命科学与技术学院,成都 610041)
核不均一核糖核蛋白(hnRNPs)是一类高度保守的RNA结合蛋白,广泛存在于动物的各种组织和细胞中,其主要生理功能是参与细胞中mRNA前体的剪接、mRNA的转运、mRNA的稳定性以及转录的调控。近年来的研究发现,hnRNPs可以通过与病毒核酸、病毒蛋白质结合,调控宿主细胞凋亡等机制影响病毒的复制过程。作者对hnRNPs与病毒复制关系的研究进展做一综述,以期为病毒与机体互作的研究提供参考。
核不均一核糖核蛋白;病毒;复制;机制
病毒复制是一个相当复杂的过程,需要在宿主细胞内完成,病毒必须借助宿主因子来完成病毒的生命周期[1],因此鉴定参与病毒复制的宿主因子及其作用机制,对于深入了解病毒与机体互作的分子机制,研究新的抗病毒策略具有重要意义。近年来,基于基因组学和蛋白质组学技术已经鉴定了数百种影响病毒复制的宿主因子,这些因子中有10%~20%是RNA结合蛋白(RNA-binding protein)[2]。RNA结合蛋白在基因转录后调控中发挥重要的作用,它通过与RNA相互作用来调节细胞的多种功能。RNA结合蛋白在RNA剪接、多聚腺苷化作用、序列编辑、RNA转运、维持RNA的稳定和降解、细胞内定位和翻译控制等RNA代谢的各个方面发挥重要作用。已有研究表明多种RNA结合蛋白参与了对RNA病毒的影响,这些RNA结合蛋白包括eEF1A、hnRNPs和Lsm 1-7 复合体等[2]。核不均一核糖核蛋白(heterogeneous nuclear ribonucleoprotein,hnRNPs)是一类RNA结合蛋白,近年来,国内外关于hnRNPs家族对多种病毒复制影响的报道日益增多,hnRNPs与病毒互作的关系受到越来越多的关注。作者对hnRNPs的结构、功能以及其在病毒复制过程中发挥的作用进行综述,为进一步研究病毒与机体互作的机制提供参考。
1 hnRNPs的结构和生理功能
hnRNPs家族成员约有30个,其中一些成员可以通过剪接产生多个亚型。在hnRNPs家族成员中,除hnRNP U之外,所有的hnRNPs家族成员都含有RBD(RNA-binding domain)结构域,除了RBD结构域,hnRNPs还有其他辅助的结构域,例如富甘氨酸结构域、富酸性或脯氨酸结构域[3]。RBD结构域包括一个以上的RNA结合结构域,通常由RNA识别基元(RNA-recognition motif,RRM)和KH结构域及羧基端的辅助基元(如RGG)构成[4]。RRM结构域是该蛋白质家族中最普遍的功能域。RRM结构域以包含β1-α1-β2-β3-α2-β4结构及RNP1和RNP2结构为特征,通过RNP1和RNP2的共有序列与RNA结合。这种结构特点使得RRM能够以非链特异性的方式结合不同长度的单链核酸,包括ssDNA。少数hnRNPs不具有典型的RRM结构域,例如hnRNPs E/K通过KH结构域与RNA结合,KH结构域通过与RNA或者ssDNA结合也可以参与许多生物学过程;hnRNP U通过富甘氨酸结构域(glycine-rich domain)与RNA结合发挥作用[3]。
hnRNPs主要存在于细胞核,按照功能可以分为两类,一类是能够核质穿梭的蛋白质复合体,参与成熟mRNA的转运和定位,另一类是核定位蛋白质复合体,与前体RNA的3′端下游区域具有高度亲和性,防止前体RNA输出到核外。核定位蛋白质复合体可识别核滞留信号(nuclear retention signal),而穿梭蛋白复合体可以识别出核信号(nuclear export sequence),二者在核内均与mRNA结合,可分别封闭核定位和出核信号[4]。
hnRNPs在各种细胞和组织中广泛表达,其最显着的功能是通过与RNA结合影响RNA的代谢。RNA代谢分为细胞核部分和细胞质部分,在细胞核内发生转录,剪接,5′端加帽子及3′端多聚腺苷酸化过程,在细胞质内发生转运、翻译和降解等过程。由于hnRNPs核质穿梭的功能使得这两个过程衔接更加紧密[3]。Pre-mRNA在细胞核经过hnRNPs等参与的剪接及编辑完成转录和转录后修饰成为成熟的mRNA,成熟的mRNA经核孔复合体进入细胞质,此过程也需要hnRNPs的协助,mRNA出核时,核定位蛋白复合体先解体;mRNA进入细胞质后,穿梭蛋白复合体解体后重新入核,从而调控mRNA的出核过程[4]。hnRNPs在细胞质内参与转录后调控,mRNA的稳定性等过程。真核生物在转录后需要在3′端链接多聚腺苷酸尾巴,hnRNPs在此过程中发挥了重要的作用。hnRNP H促进了前体mRNA的多聚腺苷酸化,hnRNP F则抑制了前体mRNA的多聚腺苷酸化。hnRNP D、E1、E2可以靶向目标mRNA 3′-UTR,影响mRNA的半衰期,从而影响mRNA的稳定性[4]。hnRNPs参与RNA代谢的所有过程,并且参与其他方面的核酸代谢,比如:端粒的维护,染色质的结构重组和DNA修复[3]。
hnRNPs在细胞质内还参与了对环境刺激的应答等过程。 hnRNP A2/B1、hnRNP Q在细胞质内参与mRNA颗粒形成,hnRNP P以应激颗粒的形式参与细胞应激反应[3]。近年来研究表明,hnRNPs不仅在生理条件下发挥重要的作用,还参与多种病毒性疾病、癌症及自身免疫性疾病的发生过程[5]。下文将阐述hnRNPs在病毒复制过程中发挥的作用及其机制。
2 hnRNPs在病毒复制过程中的作用和机制
近年来研究发现hnRNPs影响了多种病毒的复制。这些病毒包括丙型肝炎病毒(hepatitis C virus,HCV)、甲型流感病毒(influenza A virus)、人类免疫缺陷病毒(human immunodeficiency virus,HIV)、乙型肝炎病毒(hepatitis B virus,HBV)、丁型肝炎病毒(hepatitis D virus,HDV)、鼠肝炎病毒(mouse hepatitis virus,MHV)、水疱性口炎病毒(vesicular stomatitis virus,VSV)、人乳头瘤病毒16型(human papillomavirus type 16,HPV16)、辛德毕斯病毒(Sindbis virus,SV)、肠病毒71型(enterovirus 71,EV71)、尼帕病毒(Nipah virus,NiV)和单纯性疱疹病毒(herpes simplex virus,HSV)等。病毒类型遍布DNA病毒、正链RNA病毒、负链RNA病毒、逆转录病毒及微小病毒(表1)。
2.1 hnRNPs通过与病毒核酸结合影响病毒复制
hnRNPs家族中普遍存在RRM结构域,缺失分析表明RRM结构域是RNA结合活性所必须的。目前的研究表明RRM-型RNA结合蛋白参与前体mRNA 5′-端的加帽、加Poly(A) 尾和剪切等RNA 的加工过程[31]。在hnRNPs与病毒相互作用的研究中发现,病毒分子充分利用了hnRNPs家族的这一特性来完成自身复制。这些病毒中既有RNA病毒也有DNA病毒和逆转录病毒。
表1 hnRNPs影响多种病毒复制
Table 1 hnRNPs affect multiple virus replication
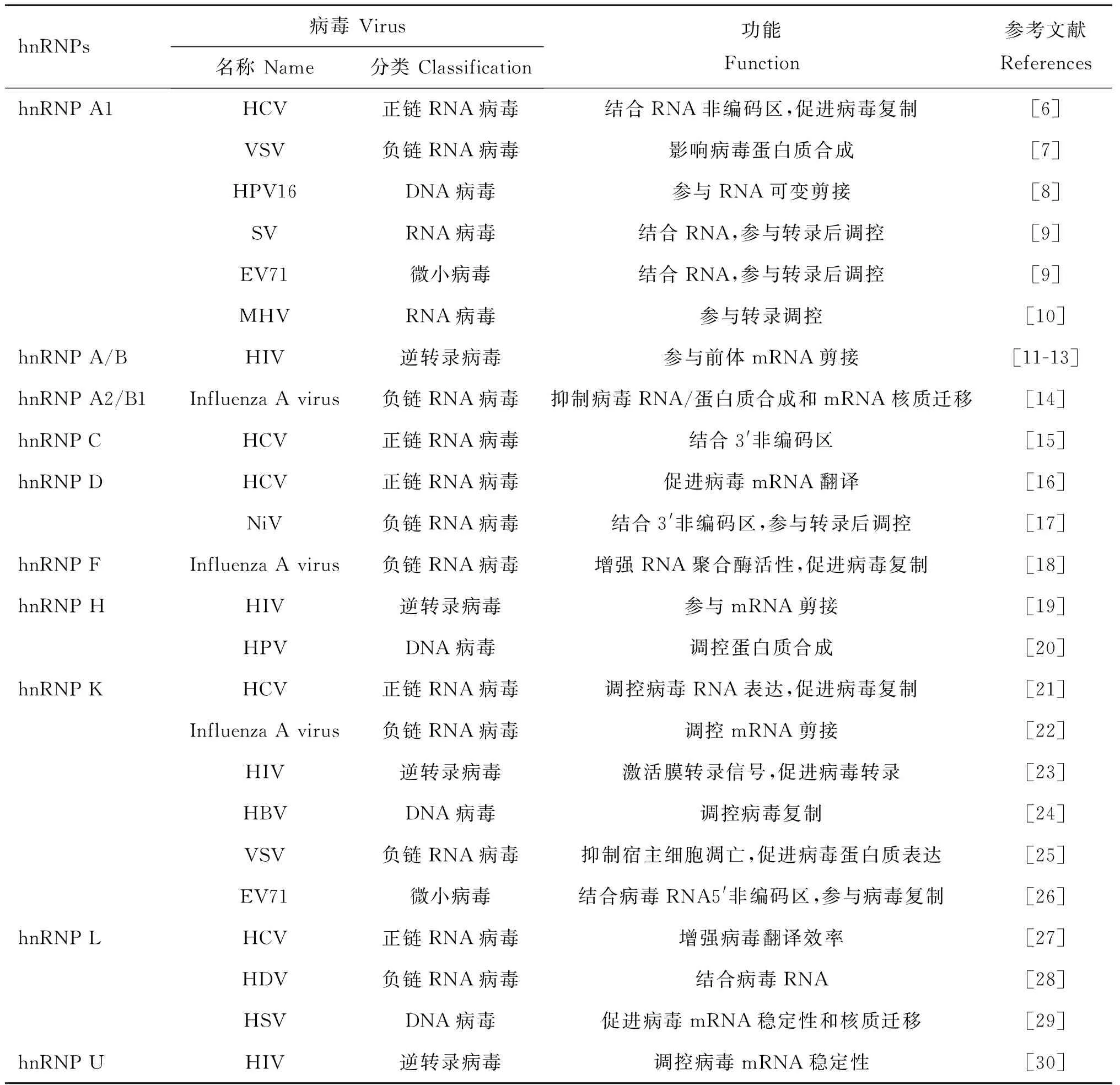
hnRNPs病毒Virus名称Name分类Classification功能Function参考文献ReferenceshnRNPA1hnRNPA/BhnRNPA2/B1hnRNPChnRNPDhnRNPFhnRNPHhnRNPKhnRNPLhnRNPUHCVVSVHPV16SVEV71MHVHIVInfluenzaAvirusHCVHCVNiVInfluenzaAvirusHIVHPVHCVInfluenzaAvirusHIVHBVVSVEV71HCVHDVHSVHIV正链RNA病毒负链RNA病毒DNA病毒RNA病毒微小病毒RNA病毒逆转录病毒负链RNA病毒正链RNA病毒正链RNA病毒负链RNA病毒负链RNA病毒逆转录病毒DNA病毒正链RNA病毒负链RNA病毒逆转录病毒DNA病毒负链RNA病毒微小病毒正链RNA病毒负链RNA病毒DNA病毒逆转录病毒结合RNA非编码区,促进病毒复制影响病毒蛋白质合成参与RNA可变剪接结合RNA,参与转录后调控结合RNA,参与转录后调控参与转录调控参与前体mRNA剪接抑制病毒RNA/蛋白质合成和mRNA核质迁移结合3'非编码区促进病毒mRNA翻译结合3'非编码区,参与转录后调控增强RNA聚合酶活性,促进病毒复制参与mRNA剪接调控蛋白质合成调控病毒RNA表达,促进病毒复制调控mRNA剪接激活膜转录信号,促进病毒转录调控病毒复制抑制宿主细胞凋亡,促进病毒蛋白质表达结合病毒RNA5'非编码区,参与病毒复制增强病毒翻译效率结合病毒RNA促进病毒mRNA稳定性和核质迁移调控病毒mRNA稳定性[6][7][8][9][9][10][11-13][14][15][16][17][18][19][20][21][22][23][24][25][26][27][28][29][30]
2.1.1 hnRNPs与病毒RNA结合影响病毒复制 研究发现hnRNPs家族的成员能与多种病毒,包括HCV、HIV、HSV、HPV16、SV的mRNA的3′和/或5′NTR(nontranslated region)结合,影响病毒mRNA的稳定性及翻译效率。3′NTR常作为负链RNA病毒的复制起始模板,5′NTR对于病毒RNA的有效扩增是必需的,且3′NTR和5′NTR区包含一些顺式作用元件(包括启动子、增强子、沉默子和调控序列等),它们的作用是参与基因表达的调控。R.R.Gontarek等研究表明hnRNP C可以与HCV的3′NTR的富嘧啶区结合,推测hnRNP C参与了HCV RNA复制的起始及调节[15]。C.S.Kim等研究表明hnRNP A1通过结合HCV的3′和5′NTR(nontranslated region)的顺式作用元件影响病毒的复制,siRNA干涉hnRNP A1表达后显着抑制HCV病毒粒子的形成,表明HCV的复制需要hnRNP A1的存在[6]。HIV-1编码病毒蛋白质时,其前体mRNA剪接必须是低效的,外显子剪接沉默子(exonic splicing silencers,ESSs)对于抑制HIV-1 mRNA剪接是必不可少的,研究表明,hnRNP A/B能够与exon 2 ESSs结合抑制它的活性,干涉hnRNP A/B后exon 2 ESSs的活性恢复,即hnRNP A/B的存在对于HIV-1蛋白的合成是有利的[11-13],hnRNP H与hnRNP A/B具有相似的功能[19]。hnRNP L通过与单纯性疱疹病毒(HSV)的mRNA前处理增强子(PPE,pre-mRNA processing enhancer)结合促进了该病毒前体mRNA的稳定性,mRNA的多聚腺苷酸化及mRNA的核质转运[29];人乳头瘤病毒16型(HPV16)感染上皮细胞时,hnRNP A1表达上调并与该病毒的晚期调控元件(late regulatory element,LRE)结合促进mRNA的可变剪接和晚期蛋白的合成与调控[8]。B.Fan等鉴定出hnRNP K可以与识别HCV 5′末端序列的茎环结构(stem-loop I),调节HCV RNA的表达和代谢[21]。此外,对其他病毒的研究中也有类似的机制。肠病毒71型(EV71)感染宿主细胞后在细胞质中完成复制,hnRNP A1和hnRNP K的从细胞核转移到细胞质中,在细胞质中hnRNP A1及hnRNP K与EV71的5′-UTR区域互相结合促进了病毒RNA的合成[9,26],hnRNP A1对辛德毕斯病毒(SV)也具有上述相同的作用[9];hnRNP D与尼帕病毒(NiV)的3′UTR结合后,使得尼帕病毒N基因的mRNA合成受到抑制,从而抑制尼帕病毒的复制[17]。
内部核糖体进入位点(internal ribosomal entry site,IRES),是一段核酸序列,它的存在能够使蛋白质翻译起始不依赖于5′帽结构,从而使直接从mRNA中间起始翻译成为可能。一般来讲,内部核糖体进入位点通常位于RNA病毒基因组的5′非翻译区(UTR),这样病毒蛋白的翻译就可以不依赖于5′帽子结构。K.Y.Paek等研究了hnRNP D与HCV的互作,发现hnRNP D可以与HCV 5′NTR的内部核糖体进入位点(IRES)结合促进HCV mRNA的翻译,过表达hnRNP D促进了HCV依赖IRES的翻译作用,干涉hnRNP D后作用与过表达的作用相反[16]。另外,还有研究表明hnRNP L结合HCV 3′NTR的IRES,影响相关mRNA的翻译效率,进而影响HCV的复制[27]。
在对一些病毒的研究中,hnRNPs与病毒RNA的互作虽然没有涉及到上文中明显的结合位点,但hnRNPs也发挥了相似的功能。P.L.Tsai等发现hnRNP K与甲型流感病毒M1 mRNA直接结合调节M1 mRNA剪接,进而影响M2/M1 mRNA和蛋白质比例,影响病毒的复制,敲低hnRNP K抑制了病毒的复制,表明hnRNP K对于病毒复制是需要的[22]。hnRNP A1与MHV RNA的转录调节区域结合来调节病毒RNA依赖的RNA转录[10];而且在MHV与宿主互作过程中,多种type A/B hnRNPs能够代替hnRNP A1行使RNA调节的功能[32]。hnRNP U能够特异性的结合HIV-1 mRNA的3′LTR(long terminal repeat)区域,从而抑制病毒mRNA在细胞质内的积累,即抑制mRNA的出核转运,最终抑制HIV-1基因表达[30]。
2.1.2 hnRNPs与病毒DNA结合影响病毒复制 L.F.Ng等发现hnRNP K与HBV DNA Enh II regulatory region结合调节HBV的复制效率,hnRNP K过表达促进了HBV DNA的扩增,siRNA干涉hnRNP K显着抑制了HBV DNA的扩增,认为hnRNP K可以作为治疗乙型肝炎的分子靶点[24]。
hnRNPs通过与病毒核酸结合对病毒复制的影响遍布病毒复制的整个过程,从复制起始调节,病毒mRNA的转运,到病毒晚期蛋白的调控。这些病毒包括DNA病毒、正链RNA病毒、负链RNA病毒、逆转录病毒和微小病毒,因此hnRNPs对病毒核酸的影响具有普遍的现象。
2.2 hnRNPs通过与病毒蛋白质结合影响病毒复制
hnRNPs作为一类RNA结合蛋白,在参与宿主或病原体RNA调节时常以复合体的形式存在,病毒RNA或ssDNA在进入宿主细胞后并不是以裸露的形式存在,而是常常伴随病毒蛋白质或宿主分子的存在,使得hnRNPs与病毒蛋白质结合成为可能。
Y.Wang等鉴定出hnRNP A2/B1可以与甲型流感病毒的NS1蛋白结合,抑制流感病毒NS1 mRNA,vRNA和蛋白质的表达,并抑制NS1 mRNA的出核转运,最终抑制流感病毒的复制[14]。J.H.Lee等研究表明hnRNP F通过与甲型流感病毒的NS1蛋白直接结合,增强病毒转录酶活性来促进病毒复制[18]。 D.Wolf等研究表明,HIV Nef蛋白与宿主因子hnRNP K结合激活了Lck和Erk1/2,激活的Erk1/2使得转录去抑制,最终导致HIV大量扩增[23];hnRNP A1可以与MHV的核衣壳蛋白物理性结合,影响病毒RNA的代谢[33]。hnRNP H通过与HPV16的L1蛋白相互结合促进病毒晚期蛋白衣壳蛋白的合成,提高病毒组装的效率,从而加快HPV16的复制[20]。
宿主细胞中存在复杂的调节和代谢网络,病毒在宿主细胞内的复制过程也相当复杂。上述hnRNPs与病毒蛋白质结合影响病毒复制的详细分子机制并不清楚,未来需要进一步研究。
2.3 hnRNPs通过影响细胞凋亡影响病毒复制
病毒感染与细胞凋亡存在密切的联系。目前研究表明有20多种病毒可以调节细胞凋亡,既可以表现为诱导细胞凋亡也可以表现为抑制细胞凋亡。病毒感染影响细胞凋亡一方面可以通过病毒蛋白质直接诱导或抑制细胞的凋亡,另一方面通过病毒编码的产物影响凋亡基因的表达间接诱导或抑制细胞的凋亡[34],在此过程中需要宿主蛋白质的参与。研究表明hnRNPs参与了对细胞凋亡的调节,最终影响病毒的复制。在水泡性口炎病毒(VSV)感染情况下,hnRNP A1的出核转运增加,重新定位于细胞质中,VSV诱导hnRNP A1发生重新定位使得宿主细胞凋亡加快,推测hnRNP A1对于细胞凋亡信号是必须的[7],相反,hnRNP K通过抑制宿主细胞的凋亡,抑制抗病毒蛋白质的合成,促进病毒所需蛋白质的合成来促进VSV的复制[25]。
3 小结与展望
目前已鉴定hnRNPs参与HCV、influenza A virus、HIV、HBV、HDV、鼠MHV、VSV、HPV16、SV、EV71、NiV和HSV等12种病毒的复制过程。其分子机制主要是通过与病毒核酸、病毒蛋白质结合,影响细胞凋亡的方式来影响病毒的复制,一些hnRNPs可促进某些病毒的复制,如hnRNP F与甲型流感病毒NS1蛋白直接结合促进病毒复制,而一些hnRNPs则抑制某些病毒的复制,如hnRNP A2/B1与甲型流感病毒的NS1蛋白结合抑制流感病毒的复制。从现有的资料来看,hnRNPs涉及的病毒类型包括了DNA病毒、正链RNA病毒、负链RNA病毒、逆转录病毒及微小病毒等,但目前hnRNPs对病毒影响的研究主要集中在人类相关的病毒。负链RNA病毒中的甲型流感病毒对人畜危害巨大,但目前对hnRNPs在畜禽甲型流感病毒体内复制过程中的作用还不清楚。并且,DNA病毒、正链RNA病毒、逆转录病毒及微小病毒中也有对很多畜禽危害严重的病毒种。因此进一步开展畜禽病毒与hnRNPs互作的研究,对深入理解动物病毒感染与免疫机制十分必要。
[1] 伯晓晨,杨 静,王升启.病毒-宿主相互作用的系统生物学与宿主靶向抗病毒策略[J].中国药理学与毒理学杂志,2013,27(2):127-131. BO X C,YANG J,WANG S Q.Systems biology approach for virus-host interaction and hostdirected antiviral strategy[J].ChineseJournalofPharmacologyandToxicology,2013,27(2):127-131.(in Chinese)
[2] LI Z,NAGY P D.Diverse roles of host RNA binding proteins in RNA virus replication[J].RNABiol,2011,8(2):305-315.
[3] HAN S P,TANG Y H,SMITH R.Functional diversity of the hnRNPs:past,present and perspectives[J].BiochemJ,2010,430(3):379-392.
[4] 刘一沉,任长虹,王航雁,等.不均一性核糖核蛋白(hnRNP)在中枢神经系统中的作用[J].军事医学科学院院刊,2010,34(1):80-83. LIU Y C ,REN C H ,WANG H Y,et al.Research progress in the role of heterogeneous nuclear ribonucleoprotein in the central nervous system[J].BulletinoftheAcademyofMilitaryMedicalSciences,2010,34(1):80-83.(in Chinese)
[5] 陈 尧,王亦男,周宏灏.核不均一核糖核蛋白功能与疾病关系的研究进展[J].生理科学进展,2008,39(2):109-113. CHEN Y,WANG Y N,ZHOU H H.Progress in the study of heterogeneous nuclear ribonucleoprotein and its relation with diseases[J].ProgressinPhysiologicalSciences,2008,39(2):109-113.(in Chinese)
[6] KIM C S,SEOL S K,SONG O K,et al.An RNA-binding protein,hnRNP A1,and a scaffold protein,septin 6,facilitate hepatitis C virus replication [J].JVirol, 2007,81(8):3852-3865.
[7] PETTIT KNELLER E L,CONNOR J H,LYLES D S.hnRNPs relocalize to the cytoplasm following infection with vesicular stomatitis virus[J].JVirol,2009,83(2):770-780.
[8] CHEUNIM T,ZHANG J,MILLIGAN S G,et al.The alternative splicing factor hnRNP A1 is up-regulated during virus-infected epithelial cell differentiation and binds the human papillomavirus type 16 late regulatory element [J].VirusRes, 2008,131(2):189-198.
[9] LIN J Y,SHIH S R,PAN M,et al.hnRNP A1 interacts with the 5'untranslated regions of enterovirus 71 and sindbis virus RNA and is required for viral replication[J].JVirol,2009,83(12):6106-6114.
[10] LI H P,ZHANG X,DUNCAN R,et al.Heterogeneous nuclear ribonucleoprotein A1 binds to the transcription-regulatory region of mouse hepatitis virus RNA [J].ProcNatlAcadSciUSA,1997,94(18):9544-9549.
[11] DOMSIC J K,WANG Y,MAYEDA A,et al.Human immunodeficiency virus type 1 hnRNP A/B-dependent exonic splicing silencer ESSV antagonizes binding of U2AF65 to viral polypyrimidine tracts[J].MolCellBiol,2003,23(23):8762-8772.
[12] CAPUTI M,MAYEDA A,KRAINER A R,et al.hnRNP A/B proteins are required for inhibition of HIV-1 pre-mRNA splicing[J].EMBOJ,1999,18(14):4060-4067.
[13] BILODEAU P S,DOMSIC J K,MAYEDA A,et al.RNA splicing at human immunodeficiency virus type 1 3' splice site A2 is regulated by binding of hnRNP A/B proteins to an exonic splicing silencer element[J].JVirol,2001,75(18):8487-8497.
[14] WANG Y,ZHOU J,DU Y.hnRNP A2/B1 interacts with influenza A viral protein NS1 and inhibits virus replication potentially through suppressing NS1 RNA/protein levels and NS1 mRNA nuclear export [J].Virology,2014,449:53-61.
[15] GONTAREK R R,GUTSHALL L L,HEROLD K M,et al.hnRNP C and polypyrimidine tract-binding protein specifically interact with the pyrimidine-rich region within the 3'NTR of the HCV RNA genome[J].NucleicAcidsRes,1999,27(6):1457-1463.
[16] PAEK K Y,KIM C S,PARK S M,et al.RNA-binding protein hnRNP D modulates internal ribosome entry site-dependent translation of hepatitis C virus RNA[J].JVirol,2008,82(24):12082-12093.
[17] HINO K,SATO H,SUGAI A,et al.Downregulation of Nipah virus N mRNA occurs through interaction between its 3' untranslated region and hnRNP D[J].JVirol,2013,87(12):6582-6588.
[18] LEE J H,KIM S H,PASCUA P N,et al.Direct interaction of cellular hnRNP-F and NS1 of influenza A virus accelerates viral replication by modulation of viral transcriptional activity and host gene expression [J].Virology,2010,397(1):89-99.
[19] JACQUENET S,MÉREAU A,BILODEAU P S,et al.A second exon splicing silencer within human immunodeficiency virus type 1 tat exon 2 represses splicing of Tat mRNA and binds protein hnRNP H [J].JBiolChem,2001,276(44):40464-40475.
[20] ZHENG Z Z,SUN Y Y,ZHAO M,et al.Specific interaction between hnRNP H and HPV16 L1 proteins:implications for late gene auto-regulation enabling rapid viral capsid protein production [J].BiochemBiophysResCommun,2013,430(3):1047-1053.
[21] FAN B,LU K Y,REYMOND SUTANDY F X,et al.A human proteome microarray identifies that the heterogeneous nuclear ribonucleoprotein K (hnRNP K) recognizes the 5′ terminal sequence of the hepatitis C virus RNA[J].MolCellProteomics,2014,13(1):84-92.
[22] TSAI P L,CHIOU N T,KUSS S,et al.Cellular RNA binding proteins NS1-BP and hnRNP K regulate influenza A virus RNA splicing[J].PLoSPathog,2013,9(6):e1003460.
[23] WOLF D,WITTE V,CLARK P,et al.HIV Nef enhances Tat-mediated viral transcription through a hnRNP-K-nucleated signaling complex [J].CellHostMicrobe,2008,4(4):398-408.
[24] NG L F,CHAN M,CHAN S H,et al.Host heterogeneous ribonucleoprotein K (hnRNP K) as a potential target to suppress hepatitis B virus replication[J].PLoSMed,2005,2(7):e163.
[25] DINH P X,DAS A,FRANCO R,et al.Heterogeneous nuclear ribonucleoprotein K supports vesicular stomatitis virus replication by regulating cell survival and cellular gene expression[J].JVirol,2013,87(18):10059-10069.
[26] LIN J Y,LI M L,HUANG P N,et al.Heterogeneous nuclear ribonuclear protein K interacts with the enterovirus 71 5' untranslated region and participates in virus replication [J].JGenVirol,2008,89(Pt10):2540-2549.
[27] HAHM B,KIM Y K,KIM J H,et al.Heterogeneous nuclear ribonucleoprotein L interacts with the 3' border of the internal ribosomal entry site of hepatitis C virus[J].JVirol,1998,72(11):8782-8788.
[28] SIKORA D,GRECO-STEWART V S,MIRON P,et al.The hepatitis delta virus RNA genome interacts with eEF1A1,p54(nrb),hnRNP-L,GAPDH and ASF/SF2 [J].Virology, 2009,390(1):71-78.
[29] GUANG S,FELTHAUSER A M,MERTZ J E.Binding of hnRNP L to the pre-mRNA processing enhancer of the herpes simplex virus thymidine kinase gene enhances both polyadenylation and nucleocytoplasmic export of intronless mRNAs[J].MolCellBiol,2005,25(15):6303-6313.
[30] VALENTE S T,GOFF S P.Inhibition of HIV-1 gene expression by a fragment of hnRNP U[J].MolCell,2006,23(4):597-605.
[31] 陈 璇,李文正,邵 岩,等.动植物中RNA 结合蛋白的研究进展[J].生物技术通报,2007(3):9-15. CHEN X,LI W Z,SHAO Y,et al.Progress in RNA-binding proteins in animals and plants[J].BiotechnologyBulletin,2007(3):9-15.(in Chinese)
[32] SHI S T,YU G Y,LAI M M.Multiple type A/B heterogeneous nuclear ribonucleoproteins (hnRNPs) can replace hnRNP A1 in mouse hepatitis virus RNA synthesis[J].JVirol,2003,77(19):10584-10593.
[33] WANG Y,ZHANG X.The nucleocapsid protein of coronavirus mouse hepatitis virus interacts with the cellular heterogeneous nuclear ribonucleoprotein A1invitroandinvivo[J].Virology,1999,265(1):96-109.
[34] 李卫中.病毒感染与靶细胞凋亡[J].中国社区医师(医学专业),2013,15(3):15-16. LI W Z.Virus infection and target cell apoptosis[J].ChineseCommunityDoctors,2013,15(3):15-16.(in Chinese)
(编辑 白永平)
Heterogeneous Nuclear Ribonucleoprotein and Virus Replication
FENG Xiao-hui,TANG Cheng,ZHU Xin,YUE Hua*
(CollegeofLifeScienceandTechnology,SouthwestUniversityforNationalities,Chengdu610041,China)
Heterogeneous nuclear ribonucleoproteins (hnRNPs) is a family of highly conserved RNA-binding proteins,which widely exist in most kinds of tissues and cells.HnRNPs primarily participate in pre-mRNA slicing,mRNA transport,mRNA stability and post-transcriptional regulation in physiological condition.For the past few years,studies have found that hnRNPs could affect viral replication through multiple mechanisms,including binding with viral nuclei acid or viral protein,and regulating apoptosis of host cells.This paper reviews the progress in the study of the relation between heterogeneous nuclear ribonucleoprotein and virus replication.
heterogeneous nuclear ribonucleoprotein;virus;replication;mechanism
10.11843/j.issn.0366-6964.2015.06.002
2014-09-15
国家自然科学基金项目(31172307)
冯晓辉(1988-),男,河北鹿泉人,硕士生,主要从事病原分子生物学的研究,E-mail:892988373@qq.com
*通信作者:岳 华,E-mail: yhua900@163.com
S852.65
A
0366-6964(2015)06-0882-07



