田卫军,秦嘉玲,岳婵娟,侯冉冉,刘宽辉,胡元亮*
(1. 南京农业大学中兽医学研究室,南京 210095;2. 富阳区畜牧兽医局,杭州 311400)
机体内正常有氧代谢产生的自由基,也称活性氧,如超氧化自由基、过氧化氢自由基等,种类繁多。这些自由基会攻击DNA、蛋白质,损伤其结构,造成细胞损伤或突变,激活癌基因或使抗癌基因失活,从而使细胞失去控制,引发一系列疾病[1]。肝是机体重要的解毒器官,酒精、药物、生物制剂以及化学药物的使用均有可能导致肝细胞氧化损伤[2]。有研究表明[3],桑葚多糖具有保护H2O2损伤后细胞膜的完整性、降低损伤后细胞内ROS的水平、提高细胞内SOD活性和抑制脂质过氧化的作用。中药多糖作为一种抗氧化剂,能够清除机体内过多的自由基,维护机体的健康,对提高动物疫病的防控效果、保障畜牧养殖业的健康发展具有重要意义[4-6]。
本试验根据前期研究结果,选取枸杞多糖(Lycumbarbarumpolysaccharide, LBP)、白术多糖(Atractylodesmacrocephalapolysaccharide, AMP)、当归多糖(ChineseAngelicapolysaccharide, CAP)作为研究对象,以维生素C(vitamin C, VC)为对照,首先测定对鸡胚肝细胞(chicken embryo liver cells, CEL)的安全浓度,然后取安全浓度范围内3种浓度的各多糖,加入到CEL的培养体系中,培养24 h后用H2O2攻击,测定CEL活力、肝细胞内ROS含量、GSH-Px和SOD活性的变化。本试验的目的,旨在验证中药多糖对CEL抗氧化能力的影响,筛选出抗氧化作用最强的多糖,为研制多糖类抗氧化剂提供理论依据。
1 材料与方法
1.1 多糖与主要试剂
LBP、AMP、CAP和VC,由本实验室提供。先用去离子水稀释成4 mg·mL-1,煮沸30 min灭菌,4 ℃保存,临用前用DMEM细胞维持液自4 000 μg·mL-1倍比稀释至3.91 μg·mL-1,共11个浓度。
DMEM培养基(SIGMA),用三蒸水配制,加入2%的双抗(青、链霉素各100 IU·mL-1)、1%的胰岛素和2%的谷氨酰胺,作为细胞维持液,另加10%的胎牛血清作为细胞生长液。MTT,Amresco Co产品,用pH7.4的PBS配成5 mg·mL-1。胰酶(BIOSHARP),取2.5 g溶于1 000 mL PBS配成2.5 mg·mL-1。以上试剂均用0.22 μm微孔滤膜过滤除菌。DMEM维持液和MTT 4 ℃保存,MTT且避光保存,胰酶-20 ℃保存。
H2O2液的配制:取30% H2O2(浓度为10 mol·L-1) 1 mL加入到49 mL PBS中,配成浓度为200 mmol·L-1的初始液,然后用细胞维持液倍比稀释成11个浓度。预试验测定1.562 5~25 mmol·L-1与空白对照无显着差异,选择25 mmol·L-1作为作用细胞浓度。
鸡胚肝细胞ROS、SOD、GSH-Px测定试剂盒,南京建成生物工程研究所产品。
1.2 鸡胚肝细胞的制备
取12胚龄鸡胚,用4 ℃预冷的PBS漂洗3次,剖腹取出肝,用冷PBS洗液漂洗3次,剪碎研磨成约1 mm3大小的小块,再用冷PBS洗液中漂洗3~4次。加入0.25%的胰酶液消化3~5 min;弃去胰酶液,用胎牛血清灭活胰酶,胰酶消化反应终止后,加入细胞维持液,用大口吸管吹散细胞,1 000 r·min-1离心10 min。弃去上清液,取沉淀,加入适量细胞生长液,用吸管吹匀,用细胞筛过滤。活细胞计数大于90%后,备用。
1.3 药物对鸡胚肝细胞安全浓度的测定
用MTT法测定鸡胚肝细胞安全浓度。将肝细胞密度调整为5×105个·mL-1,接种到96孔细胞培养板,每孔100 μL,置于37.5 ℃、5% CO2条件下培养24 h,去除红细胞和细胞碎片。然后分别加入11个浓度的多糖和VC,每孔100 μL,每浓度重复4孔,另设细胞对照组(CC,仅加细胞生长液),继续培养24 h取出,每孔加入MTT 20 μL,继续培养4 h 后离心弃上清,每孔加裂解液DMSO 100 μL,将细胞板置于微量振荡器上振荡5 min使沉淀完全溶解,在酶联免疫检测仪上检测570 nm处的吸光度(A570 nm)值。选择A570 nm值不显着小于细胞对照组的多糖最大安全浓度作为该多糖的最大安全浓度。
1.4 鸡胚肝细胞活力的测定
将肝细胞密度调整为5×105个·mL-1,接种到96孔细胞培养板,每孔100 μL,置于37.5 ℃、5% CO2条件下培养24 h,弃去上清液,根据安全浓度的测定结果分别加入1 000、500、250 μg·mL-13个 浓度的多糖和VC,每孔100 μL,每个浓度重复4孔,另设细胞对照组(CC)和H2O2对照组(均加细胞生长液100 μL),继续培养24 h后,除CC组外每孔加H2O250 μL,继续培养1 h后,每孔加入MTT 20 μL,继续培养4 h后,每孔加裂解液DMSO 100 μL,将细胞板置于微量振荡器上振荡5 min使沉淀完全溶解,在酶联免疫检测仪上检测570 nm处的吸光度(A570 nm)值,作为鸡胚肝细胞活力的指标。
1.5 鸡胚肝细胞内ROS含量的测定
肝细胞密度、接种、培养、加药同肝细胞活力测定,继续培养24 h后,除CC组外每孔加H2O250 μL,继续培养1 h后,取出细胞板,弃去培养液,用PBS洗液洗3次,然后加入20 μmol·L-1DCFH-DA 5 μL,避光反应30 min,用PBS洗涤两次,最后加入50 μL PBS,取细胞板用荧光酶标仪测定ROS的含量。
1.6 鸡胚肝细胞内GSH-Px活性的测定
将悬浮的肝细胞密度调整为1×106个·mL-1,接种到6孔细胞培养板中,每孔2 mL,置于37.5 ℃、5% CO2条件下培养,24 h后弃去上清液,每孔加入1 mL细胞生长液,然后分别加入1 000、500、250 μg·mL-13个浓度的多糖和VC,每孔1 mL,每个浓度重复4孔,另设细胞对照组(CC)和H2O2对照组(加细胞生长液1 mL),继续培养24 h后,除CC组外每孔加H2O2500 μL,继续培养1 h后,取出细胞板,吸取细胞上清液用试剂盒测定鸡胚GSH-Px的活性。
1.7 鸡胚肝细胞内SOD活性的测定
肝细胞密度、接种、培养、加药同GSH-Px活性测定,继续培养24 h后,除CC组外每孔加H2O2500 μL,继续培养1 h后,弃去培养液,用PBS洗液洗2次,吸去上清,用细胞刮将贴壁细胞刮下,收集到2 mL EP管中,加入500 mL PBS,冰水浴,功率300 W进行超声破碎,每5 s超声1次,间隔4次,每次间隔时间为25 s,取细胞匀浆用试剂盒测定SOD活性。
1.8 数据处理

2 结 果
2.1 药物对鸡胚肝细胞的安全浓度
结果见表1。LBP、AMP和VC在1 000 μg·mL-1组、CAP在2 000 μg·mL-1组的细胞A570 nm值不显着小于细胞对照组,可将这些浓度定为它们的最大安全浓度。为便于同水平比较,将它们的最大安全浓度统一设为1 000 μg·mL-1。
2.2 各组鸡胚肝细胞活力的变化
各组的A570 nm值见表2。H2O2组的细胞A570 nm值最小,显着小于细胞对照组(P<0.05);4个药物组的细胞A570 nm值均高于H2O2组,LBP在1 000 和500 μg·mL-1、AMP在1 000 μg·mL-1、CAP和VC在3个浓度组的A570 nm值均显着大于H2O2组(P<0.05),表明它们在这些浓度能显着抵抗H2O2引起的细胞活力降低。
2.3 各组鸡胚肝细胞内ROS含量的变化
各组鸡胚肝细胞内ROS的含量见表3。H2O2组的ROS含量最高,显着高于细胞对照组(P<0.05)。4个药物组的ROS含量多低于H2O2组,LBP和VC的3个浓度组、AMP和CAP在1 000和500 μg·mL-1组的ROS含量显着低于H2O2组(P<0.05),表明它们在这些浓度能显着抑制H2O2引起的ROS升高。
2.4 各组鸡胚肝细胞内GSH-Px活性的变化
各组鸡胚肝细胞内GSH-Px的活性见表4。H2O2组的GSH-Px活性最低,显着低于细胞对照组(P<0.05)。4个药物组的GSH-Px活性均高于H2O2组,LBP和VC的3个浓度组、AMP和CAP在1 000和500 μg·mL-1组的GSH-Px活性显着高于H2O2组(P<0.05);LBP和VC在1 000和500 μg·mL-1、AMP和CAP在1 000 μg·mL-1组的GSH-Px活性显着高于CC组(P<0.05),表明它们在这些浓度不但能显着抑制H2O2引起的GSH-Px活性降低,而且能显着提升GSH-Px活性超过正常水平。

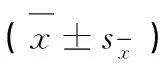

质量浓度/(μg·mL-1) ConcentrationLBPAMPCAPVC4 0000.235±0.012f0.516±0.010i0.614±0.017i3.106±0.013a2 0000.229±0.014f0.706±0.014h0.739±0.006e2.665±0.036b1 0000.851±0.005c0.846±0.010c0.855±0.003c1.379±0.060c5000.877±0.041b0.958±0.010a0.991±0.018a0.927±0.020d2500.914±0.022a0.875±0.011b0.915±0.015b0.937±0.009d1250.850±0.013c0.858±0.011c0.860±0.009c0.863±0.011e62.50.804±0.012d0.811±0.011d0.851±0.004c0.855±0.023e31.250.831±0.014c0.805±0.011de0.756±0.005d0.794±0.019f15.630.807±0.011d0.793±0.014e0.715±0.015fg0.725±0.017g7.820.798±0.007d0.776±0.002f0.701±0.005h0.722±0.013g3.910.743±0.009e0.757±0.008g0.700±0.007h0.711±0.013g0(细胞对照,cell control)0.739±0.001e0.768±0.006fg0.718±0.007f0.698±0.006g
LBP.枸杞多糖;AMP.白术多糖;CAP.当归多糖;VC.维生素C。同列数据标不同字母者差异显着(P<0.05),以下表同
LBP.Lycumbarbarumpolysaccharide; AMP.Atractylodesmacrocephalapolysaccharide; CAP.ChineseAngelicapolysaccharide; VC. Vitamin C.Column data without the same superscripts differ significantly (P<0.05). The same as following tables



组别 Group药物质量浓度/(μg·mL-1) ConcentrationLBPAMPCAPVC药物组1 0000.705±0.004b0.616±0.014cd0.639±0.011c0.850±0.019aDrug group5000.633±0.004c0.511±0.007f0.600±0.013d0.635±0.006c2500.509±0.010f0.506±0.006f0.559±0.017e0.562±0.022eH2O2对照组 H2O2 control group0.487±0.026f细胞对照组(CC) Cell control group0.853±0.007a
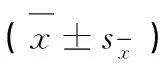
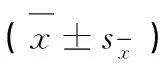
U·mL-1
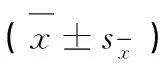
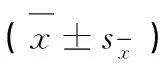

组别 Group药物质量浓度/(μg·mL-1) ConcentrationLBPAMPCAPVC药物组1 00037.04±0.37a31.11±0.64b29.63±0.74b36.84±0.68aDrug group50029.63±0.98b26.30±1.34c25.93±0.37c35.93±0.98a25025.56±1.28c21.11±0.64d18.52±0.98d26.37±0.18cH2O2对照组 H2O2 control group17.78±0.64d细胞对照组(CC) Cell control group24.81±0.98c
2.5 各组鸡胚肝细胞内SOD活性的变化
各组鸡胚肝细胞内SOD的活性见表5。H2O2组的SOD活性最低,显着低于细胞对照组(P<0.05)。4个药物组的SOD活性均高于H2O2组,LBP、CAP和VC的3个浓度组、AMP在1 000和500 μg·mL-1组的SOD活性均显着高于H2O2组(P<0.05);LBP和VC的3个浓度组、AMP在1 000 μg·mL-1和CAP在1 000和500 μg·mL-1组的SOD活性显着高于CC组(P<0.05),表明它们在这些浓度不但能显着抑制H2O2引起的SOD活性降低,而能显着提高SOD活性(P<0.05)至超过正常水平。
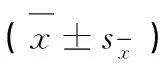
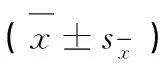

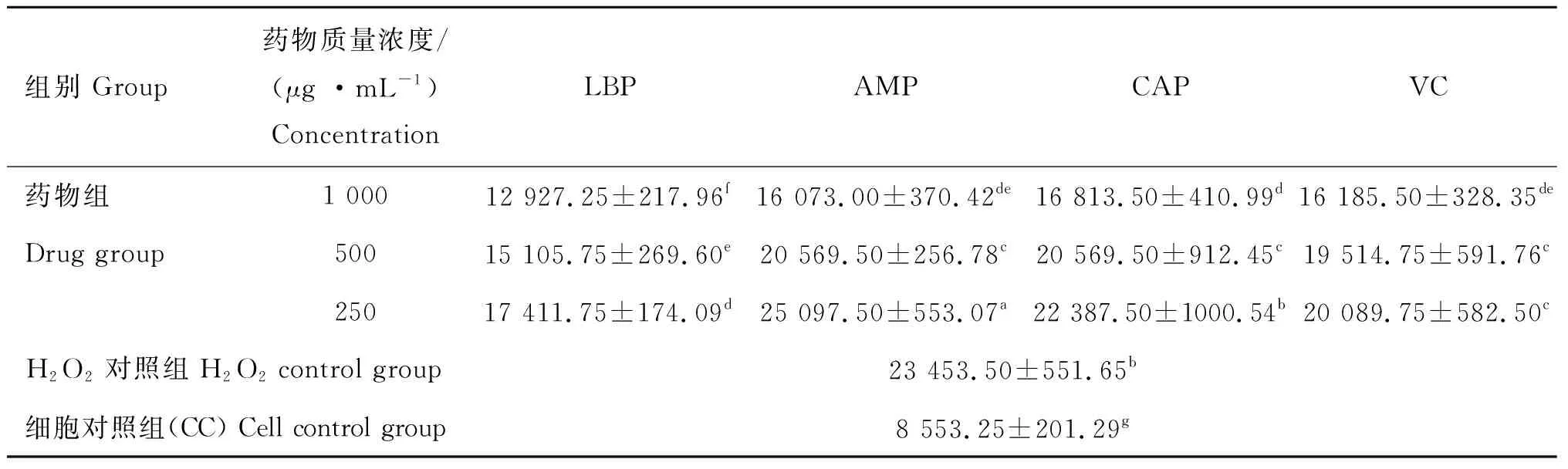
组别 Group药物质量浓度/(μg·mL-1) ConcentrationLBPAMPCAPVC药物组1 000410.20±0.71b394.29±1.87e396.73±0.71d423.45±1.43aDrug group500405.71±1.22c388.16±0.71f394.29±0.71e422.86±1.22a250397.96±0.71d368.16±1.87h382.86±0.71g396.89±1.01dH2O2对照组 H2O2 control group366.12±1.87h细胞对照组(CC) Cell control group386.12±1.22f
3 讨 论
3.1 多糖对鸡胚肝细胞活力的影响
H2O2是一种重要活性氧,高浓度的H2O2可抑制细胞的生长和增殖,导致细胞凋亡,其极易透过细胞膜,可与胞内的铁离子反应形成高活性的自由基,从而诱发一系列反应。由于H2O2具有性质相对稳定、容易获得等优点,常作为细胞氧化损伤研究的重要工具[7-9],因此本试验采用H2O2诱发鸡胚肝细胞氧化损伤,测定细胞活力、细胞内ROS含量和抗氧化酶活性的变化。结果显示,H2O2组的细胞A570 nm值、GSH-Px和SOD活性最低,细胞内ROS含量最高,与细胞对照组的差异显着,表明本试验造模成功。
中药多糖不但能提高机体的免疫功能,而且能抗氧化损伤,可作为自由基清除剂,抑制细胞内氧化应激从而减少细胞核坏死细胞的数量[10-12]。VC能显着提高动物机体的生长性能和抗氧化性能,提高ROS、GSH-Px和SOD活性,降低MDA含量,常被作为抗氧化阳性对照药[13]。本试验采用先加多糖、然后用H2O2刺激,测定肝细胞活力的变化。结果显示,4个药物组的细胞A570 nm值均高于H2O2组,LBP在1 000和500 μg·mL-1、AMP在1 000 μg·mL-1、CAP和VC在3个浓度组的细胞A570 nm值均显着大于H2O2组,表明它们在这些浓度能显着抵抗H2O2引起的细胞活力降低。3个多糖相比,LBP组的细胞A570 nm值最高,抗氧化活性最强,接近阳性对照VC组。
3.2 多糖对鸡胚肝细胞内ROS含量的影响
活性氧簇(ROS)是在细胞有氧代谢中产生的化学性质活泼的氧自由基和能转化为自由基的物质,如羟自由基、超氧阴离子自由基、过氧游离基等氧自由基和过氧化氢、氢过氧化物等非自由基[14]。ROS可氧化损伤DNA、蛋白质等生物分子而导致细胞功能障碍,甚至诱导细胞凋亡或坏死[15-16]。本试验结果显示,4个药物组的ROS含量多低于H2O2组,LBP和VC的3个浓度组、AMP和CAP在1 000和500 μg·mL-1组的ROS含量显着低于H2O2组,表明它们在这些浓度能显着抑制H2O2引起的ROS升高。4个药物组相比,LBP组的ROS含量最低,表明其抗氧化活性最强,明显优于阳性对照VC。
3.3 多糖对鸡胚肝细胞内GSH-Px和SOD活性的影响
抗氧化酶被认为是防御细胞免受损害的一个主要的部分,组织中的抗氧化酶可以有效地清除异物代谢所产生的自由基[17]。GSH-Px和SOD作为自由基清除系统的抗氧化酶存在于所有氧代谢的细胞中,使细胞免受自由基损害,并为被氧化的细胞膜提供修复机制,已发现许多退化性疾病与机体的GSH-Px和SOD活性抑制相关联。GSH-Px是一种重要的过氧化物分解酶,其功能主要是催化GSH参加过氧化反应、清除机体代谢过程产生的过氧化物和羟自由基、保护细胞膜及结构的完整性,SOD是机体内清除氧自由基的重要抗氧化酶,能清除超氧阴离子自由基和保护细胞免受损伤,在维持机体的氧化和抗氧化平衡发挥重要作用[18-19]。本试验结果显示,4个药物组的GSH-Px和SOD活性均高于H2O2组,LBP和VC的3个浓度组、AMP和CAP在1 000和500 μg·mL-1组的GSH-Px活性显着高于H2O2组;LBP、CAP和VC的3个浓度组、AMP在1 000和500 μg·mL-1组的SOD活性均显着高于H2O2组;尤其它们在高、中浓度组两个酶的活性多显着高于细胞对照组,表明三种多糖能够抑制H2O2引起的抗氧化酶活性降低,而且能显着提高抗氧化酶活性超过正常水平。3种 多糖中仍以LBP组两个酶的活性值最高,抗氧化活性最强,与阳性对照VC组相当。
4 结 论
LBP、AMP、CAP 3种多糖均有较强的抗氧化作用,能显着抑制H2O2攻击引起的鸡胚肝细胞活力降低、细胞内ROS升高、GSH-Px和SOD活性降低,并能显着提高两种抗氧化酶活性超过正常水平,从而保护肝细胞免受氧化损伤。其中LBP的抗氧化作用最强,接近甚至优于VC,可考虑作为多糖类抗氧化剂。



