梁 圣,赵新新,2,3*,程安春,2,3*
(1. 四川农业大学动物医学院预防兽医研究所,成都 611130;2. 四川农业大学动物医学院禽病防治研究中心,成都 611130;3. 动物疫病与人类健康四川省重点实验室,成都 611130)
多杀性巴氏杆菌(Pasteurellamultocida)是一种重要的畜禽病原菌,隶属于巴氏杆菌科、巴氏杆菌属多杀亚种[1]。其宿主谱广泛,可引起多种动物(如鸭、鸡、火鸡、牛、猪)的接触性传染病[2]。人们依据多杀性巴氏杆菌不同的表面抗原将其划分为不同的血清型:根据荚膜类型可分为A、B、D、E、F 5个型,根据脂多糖(LPS)抗原的不同分为1~16个型[3-4]。不同血清型的宿主嗜性是不同的,比如牛出血性败血症的病原菌血清型一般是B:2和E:5,D血清型的菌株主要引起猪萎缩性鼻炎,而禽霍乱主要由血清型A:1、A:3和A:4的菌株引起[5]。普遍认为,呼吸道是禽多杀性巴氏杆菌入侵宿主的主要途径,细菌首先入侵、定殖于上呼吸道的黏膜,然后扩散到气囊和肺,最终通过某种途径(可能是黏膜巨噬细胞)进入血液循环并迁移至肝、脾等实质器官,引发系统性疾病[6]。禽霍乱的感染会导致火鸡、鸡、鸭、鹅等禽类的高发病率和高死亡率,给养禽业造成巨大的经济损失。病原体能够在宿主体内持续存在[7],污染饲养环境,给养禽业的发展和公共卫生安全造成严重威胁。
目前我国针对禽霍乱的治疗主要依赖于抗生素,但随着抗生素耐药和残留问题日趋严重,发展安全、高效的禽霍乱疫苗成为疾病防控的迫切需求。目前预防该病的商品化疫苗包括油乳剂灭活疫苗、减毒CU疫苗等,然而均存在一些缺陷。油乳剂灭活苗的免疫保护期短暂,并且容易在注射部位引起不良反应,而自然筛选的减毒苗为经验性研制,其基因背景不清楚,毒力返强的现象时有发生[8]。随着多杀性巴氏杆菌的致病机制和免疫学的发展,多种毒力因子和保护性抗原被逐渐揭示,与之相关的减毒疫苗、亚单位疫苗、DNA疫苗得到发展。本文概述几种近年来禽霍乱新型疫苗的研究进展,旨在为研制高效、安全的疫苗提供参考。
1 新型减毒疫苗
灭活苗通常提供的交叉保护力不足,而多杀性巴氏杆菌血清型众多,在实际应用中常发生免疫失败。为了解决这一现实问题,人们转向研究交叉免疫更具潜力的减毒疫苗。制备减毒疫苗首要条件是高度减毒,由于技术受限,早期的减毒疫苗一般是通过筛选自然减毒株或化学诱变减毒而制成的。在20世纪70年代,来自Clemson University的Bierer和Derieux[9]从火鸡禽霍乱的病例中分离到一株血清3型的多杀性巴氏杆菌减毒株,并将该减毒株通过饮水免疫火鸡,发现该菌株能帮助火鸡预防禽霍乱的发生。之后经研究该菌株被优化为CU疫苗,这是第一个被广泛应用的禽霍乱活疫苗。Hertman等[10]用化学物质亚硝基胍诱导突变血清Ⅰ型菌株,得到无毒力菌株M3G,将M3G免疫火鸡后能抵抗同源菌株和血清3型菌株的感染。但这类疫苗存在使疾病暴发的潜在风险,其安全性不容忽视[11]。
随着分子生物学和DNA重组技术的发展,对禽多杀性巴氏杆菌基因进行改造的减毒方法日益受到人们的推崇。其中aroA基因便是典型例子,该基因所编码的5-烯醇丙酮酰莽草酸-3-磷酸合成酶参与催化合成芳香族氨基酸的中间反应。由于脊椎动物不具备该合成途径,因此ΔaroA缺失株在宿主体内因缺乏重要氨基酸而毒力减弱[12]。1997年,Homchampa等[13]通过无痕缺失构建的ΔaroA缺失株在小鼠上高度减毒,并且该缺失株能够针对致死剂量的野毒感染为免疫动物提供完全保护。之后,Scott等[14]同时构建了血清1型和血清3型的ΔaroA缺失株,分别将106CFU和108CFU的两种缺失株肌肉途径免疫鸡后,发现免疫动物能够完全抵御107CFU野毒的呼吸道感染。其免疫试验发现不同的接种方式会影响免疫保护效果。在比较了肌内注射、气管内注射、口服几种免疫方式之后,发现口服免疫的动物存活率最低,肌内注射、气管内注射方式所提供的免疫保护较好。可能的机制是,与消化道途径相比,呼吸道作为多杀性巴氏杆菌的天然感染途径能最大化地激发毒力相关抗原的表达,而肌肉途径能使抗原相对缓慢地释放。
除了像缺失aroA这样的代谢基因达到减毒的目的,还可以通过改造细菌的毒力因子(如荚膜、脂多糖)来实现减毒。一些研究者在进行菌株的分离与鉴定时发现荚膜A型菌株常导致禽霍乱,于是荚膜参与多杀性巴氏杆菌发病机制的猜测就产生了。Chung等[15]在对荚膜合成位点的核酸序列进行分析后,将四环素抗性基因插入到荚膜多糖输出蛋白基因hexA的序列中,使其失活,从而构建了血清型A:1菌株ΔhexA突变株。该菌株在鸡上完全减毒,将其通过肌内注射免疫自然宿主鸡,发现它能够提供高水平的同源保护效力[16]。透明质酸是A型荚膜的主要组成成分,但也普遍存在于禽类和哺乳类的组织里,因此其免疫原性很弱。荚膜缺失使细菌的抗原更有效地暴露,从而使宿主获得免疫保护,这可能是荚膜缺失株提供免疫保护的机制之一。国内的禽多杀性巴氏杆菌的血清型多以A:1、A:3为主,这种缺失荚膜的减毒策略对于我国研制活疫苗具有很好的参考价值[17-18]。
如同其他革兰阴性菌的LPS,多杀性巴氏杆菌的LPS具有内毒素活性,其结构变化直接影响着细菌的存活与毒力。当缺失了LPS的外核心寡糖上磷酸胆碱基团后,导致禽霍乱的VP161菌株在宿主体内的存活能力明显下降[19]。由于多杀性巴氏杆菌的LPS中类脂A的结构与基因序列尚不清楚,目前人们仅针对缺失LPS的核心寡糖来构建减毒株,动物毒力试验发现其中的庚糖缺失株ΔhptC是明显减毒的[20],但由于该菌株是通过单交换插入突变的,具有毒力回复的可能,使得其作为疫苗候选株的安全性大大降低。另外, Harper等[21]发现,与亲本株制成的灭活苗相比,外核心寡糖缺失株制成的灭活苗在针对同血清型菌株的攻毒时无法为鸡提供好的免疫保护。这表明灭活疫苗所激发的免疫保护应答依赖于LPS的结构相似性,而不同血清型菌株的LPS结构具有多样性,这或许是灭活疫苗的交叉免疫保护力不佳的部分原因。与之相反的是,以ΔaroA缺失株制成的减毒活疫苗的免疫保护效果却不受外核心寡糖结构变化的影响,无论LPS的结构是否保持完整,ΔaroA缺失株均能提供高水平的同源及异源的免疫保护,这提示活疫苗提供的免疫保护不依赖于LPS。造成这种差异的原因可能是由于活疫苗能够激发宿主产生更好的细胞免疫应答,但具体发挥作用的免疫保护因子和免疫保护相关指标有待进一步研究。此外,目前还未开展单独的LPS缺失株的疫苗免疫试验,LPS在活疫苗的免疫应答中的参与作用还需要进一步的验证。
随着对细菌致病机制的研究深入,人们了解到更多的与毒力相关的调控基因可以作为实现毒力降低的靶基因。基于其他革兰阴性菌(如大肠杆菌、沙门菌)的研究证实,crp基因和phoP基因是两个重要的全局调控基因。crp编码的cAMP受体蛋白参与细菌的碳水化合物和氨基酸代谢,并调控诸多毒力基因的表达[22];phoP编码的PhoP蛋白和位于膜上的PhoQ蛋白(一种组氨酸蛋白激酶)构成的双组分调节系统参与了一系列生物学过程,包括调控毒力基因的表达、增强细菌的免疫逃避能力以及对多种限制性生长环境的适应性等[23]。本研究小组通过将沙门菌的这两个基因序列与多杀性巴氏杆菌Pm70全基因组序列比对筛选获得多杀性巴氏杆菌的crp、phoP基因序列,并通过异源回补试验证实了这两个基因的正确性。然后通过分别缺失crp、phoP基因构建了血清A型菌株的减毒株。相比于亲本株,ΔphoP缺失株经鼻途径的LD50增加了153倍。将该缺失株通过滴鼻免疫雏鸭,能针对同源菌株达到54.5%的保护效力[24]。而Δcrp缺失株通过滴鼻免疫雏鸭后,诱导动物产生了显着的血清IgY应答,并使免疫动物获得60%的同源保护力[25]。
从上述研究可知,基因缺失是构建减毒疫苗的有效策略,一些基因缺失株展示了良好的免疫保护潜力。然而缺失不同靶基因造成的毒力降低程度及缺失株提供的免疫保护效果有所差异。aroA、hexA缺失造成菌株高度减毒,而Δcrp、Δphop缺失株仅部分减毒。同时在强毒株高剂量(107CFU、108CFU)攻毒挑战下,ΔaroA或ΔhexA缺失株免疫动物全部存活,而Δcrp、Δphop缺失株仅能提供中等程度的免疫保护。显然ΔaroA或ΔhexA缺失株是更好的疫苗候选株。造成这种差异的原因之一在于仍有一定毒力的Δcrp、Δphop缺失株存在免疫剂量的妥协,即免疫剂量较低。显然影响多杀性巴氏杆菌毒力的远不止这四个基因,在未来研究中我们一方面需要去探讨已知的毒力基因(如荚膜合成基因[16]、LPS合成基因[21]、全局调控基因fis[26]、hfq[27])在疫苗研究中的应用;另一方面还需去挖掘更多的毒力基因,进行毒力基因的组合缺失,因为单基因缺失并不足以保证疫苗株的安全性。
2 重组亚单位疫苗
传统的亚单位疫苗是通过化学分解或蛋白质水解去除与菌体无关甚至有害的成分、仅提取具有免疫活性的成分制成的。此类疫苗的缺陷是生产工艺复杂、成本高,随着生物技术的发展,利用重组DNA技术来研发基因工程亚单位疫苗成为现代疫苗学的一个新方向。这类亚单位疫苗是通过基因重组技术将编码保护性抗原的基因连接载体后,将重组载体导入表达系统,使其高效表达后提取纯化,再联合佐剂而制成的。在多杀性巴氏杆菌上,最早是Bording等[28]在1994年研制的多杀性巴氏杆菌毒素重组亚单位疫苗,该疫苗在猪场的免疫试验中能降低外耳畸形程度和后代感染率。经过多年的尝试,更多具有免疫保护作用的多杀性巴氏杆菌蛋白逐渐被揭示和发现。这类蛋白的作用通常是帮助细菌黏附、入侵宿主,往往表达于细胞膜表面或分泌到细胞外,易于被宿主免疫系统识别。因此,这些相关蛋白被人们选择应用于研制亚单位疫苗。这些蛋白大致包括脂蛋白、外膜蛋白、菌毛蛋白和一些与细菌黏附入侵相关的蛋白(表1)。
2007年,Wu等[29]将血清型A:1菌株X-73的脂蛋白合成基因plpE和plpB分别克隆到大肠杆菌中,并使PlpE和PlpB蛋白高效表达,再加入氢氧化铝佐剂制成重组疫苗,然后评估两种疫苗在小鼠和鸡模型上的免疫保护效力。结果显示,rPlpE免疫可使小鼠和鸡同时抵抗同源菌株X-73(血清型A:1)及异源菌株P-1662(血清型A:4)的感染;相比之下,rPlpB免疫无法为动物提供免疫保护,可能是由于提纯过程的部分抗原表位丢失。之后,Hatfaludi等[30]通过对Pm70全基因组进行生物信息学分析比对,推测出71个潜在的具有免疫原性的蛋白,其中只有PlpE具有免疫保护作用。王红勋[31]首次在国内构建出多杀性巴氏杆菌plpB基因的表达载体,该试验为了保留PlpB良好的免疫原性,从包涵体蛋白中通过优化复性得到生物活性高的蛋白。在免疫保护试验中,rPlpB免疫小鼠后的保护率为100%。
外膜蛋白普遍存在于不同血清型多杀性巴氏杆菌中,具有很好的免疫原性。其中OmpA作为多杀性巴氏杆菌表面结构的稳定剂,有着黏附素、入侵素等多重角色。OmpH作为外膜上的孔蛋白,具有暴露于细菌表面的抗原表位,其氨基酸序列高度保守[32]。rOmpA重组疫苗可刺激小鼠产生高水平的IgG1抗体应答,但免疫保护试验显示这种免疫反应不具有保护效力[33];研究发现,多杀性巴氏杆菌15种 血清型之间的OmpH蛋白质序列高度相似[34],预示着rOmpH是具有潜力的交叉保护抗原,这促使人们研究其异源免疫保护潜力。早期人们通过在变性条件下的Ni-NTA亲和层析提纯rOmpH,但是在这个过程中rOmpH的化学结构被改变,导致其免疫保护效果不甚理想[35]。之后曹素芳和黄青云[36]利用谷胱甘肽琼脂糖亲和层析方法纯化rOmpH,然后将其与弗氏完全佐剂混合制成重组亚单位疫苗,发现其能为免疫鸡提供约70%的同源免疫保护。之后Sthitmatee等[37]在杂合条件下纯化rOmpH,其免疫活性得以保留,但这种方法的重复性低,蛋白的损失量大。之后来自清迈大学的研究团队选择了电洗脱法,这种方法易于操作、重复性高且提取的蛋白量多。免疫保护试验表明电洗脱法不仅能较大程度地保留rOmpH蛋白的免疫原性,还能明显提高其交叉免疫保护效率[38]。此后该团队在电洗脱纯化rOmpH的基础上采用了CpG-ODN和肠毒素作为rOmpH重组疫苗的佐剂,并配合鼻内免疫途径,发现免疫鸡群产生的IgY和sIgA抗体水平显着提高,并且CpG-ODN免疫组诱导的交叉免疫保护稍高于肠毒素的免疫组[39]。CpG-ODN是含有CpG基序的DNA序列,而CpG基序是由六个核苷酸组成的具有免疫刺激活性的特定DNA序列,其基本结构为5′-嘌呤-嘌呤(或T)-CpG-嘧啶-嘧啶-3′。作为一种新型的疫苗佐剂,CpG-ODN不仅能增强体液免疫和细胞免疫,而且比肠毒素、霍乱毒素等佐剂更安全[40]。
2004年,Ali等[41]从多杀性巴氏杆菌P1059的荚膜中提取出一种相对分子质量为39 ku的蛋白,经免疫试验证实,该蛋白可为小鼠提供完全的针对同源野生毒株感染的免疫保护,以及中等程度的针对异源菌株X-73攻毒挑战的免疫效应。同时通过免疫电镜技术确定该蛋白是一个重要的黏附因子[42],它能够帮助病原体更有效地黏附到宿主的黏膜上并实现入侵。之后,Sthitmatee等[37]确定了该蛋白是荚膜中的黏附蛋白(Cp39),并证实接种重组疫苗rCp39可帮助免疫鸡同时抵抗同源菌株P1059 和异源菌株X-73的攻毒挑战,且异源保护效力达到60%。进一步地,将该39 ku的蛋白缺失后,发现相应的基因缺失株无法使宿主获得抵抗异源毒株的特异性免疫[43]。恩特马克·布拉提白等[44]比较了天然Cp39、rCp39和天然荚膜的交叉保护作用,发现前两者均能刺激小鼠免疫系统产生明显的免疫应答,免疫剂量100 μg的天然Cp39和rCp39针对同源菌株C48-3的保护率为100%,针对异源菌株C51-3的保护率为80%。吾鲁木汗·那孜尔别克等[45]分析了16个血清型多杀性巴氏杆菌cp39基因核苷酸序列相似性在81.5%~100%,说明该基因具有高的保守性。并且,Borrathybay等[46]发现抗rCp39抗体能够抑制禽多杀性巴氏杆菌对于鸡胚成纤维细胞(CEF)的黏附。根据以上国内外研究结果,rCp39的免疫保护机制可能是诱导的抗体能阻止禽多杀性巴氏杆菌对宿主细胞的黏附从而产生免疫保护。另外,cp39基因在不同血清型之间的保守性解释了rCp39的交叉保护作用。
前期研究表明,与细菌黏附、入侵有关的丝状血凝素肽(FHAB2)对细菌的毒力有重要影响,其合成基因fbaB2的缺失会导致菌株的致病性明显降低,这可能是由于细菌定殖到黏膜和入侵宿主的能力减弱所致。FHAB2在毒力方面的重要影响促使人们研究其免疫保护潜力。Tatum等[47-48]证实来源于P1059菌株的丝状血凝素肽制成的亚单位疫苗rFHAB2 具有较高的免疫保护效果,针对107CFU的同源菌株的鼻内攻毒,该疫苗为免疫火鸡提供80%以上的免疫保护效率。同时作者发现fhaB2基因在不同血清型菌株中具有99%的高相似性,预示着rFbaB2具有发挥交叉保护作用的潜力。
此外,研究证实IV型菌毛蛋白PtfA与多杀性巴氏杆菌的致病性有关,并且还具有一定的免疫原性[49-50]。基于此,Gong等[51]制备禽多杀性巴氏杆菌的重组疫苗rPtfA,免疫试验结果显示rPtfA免疫组的血清抗体水平持续上升,稍低于弱毒活疫苗组。攻毒后rPtfA组和弱毒活疫苗组的动物存活率为 45%和75%。这表明rPtfA免疫原性不够好,不足以为禽类提供强的保护力,但可以将其与其他抗原应用于研制多种抗原融合的重组疫苗。
重组亚单位疫苗免疫保护效果的关键在于候选抗原的选择以及抗原的表达纯化。目前已筛选到具有良好的同源免疫效力的抗原包括Cp39、PlpE、OmpH、FHAB2,其中前三者还可为免疫动物提供一定程度的交叉保护。同时为了获取生物活性良好的重组蛋白,人们对表达纯化过程进行了很多改良工作,目前已证实重组的rCp39、rOmpH蛋白与天然形式的蛋白免疫效果相当。未来的研究工作除了继续挖掘更多的具有免疫保护作用的抗原,还应以这些候选抗原为基础优化蛋白提纯从而制备最优的重组亚单位疫苗,并探究它们在其他主要的养殖禽类上的免疫效力。
表1禽霍乱重组亚单位疫苗潜力评价
Table1Evaluationoffowlcholerarecombinantsubunitvaccine
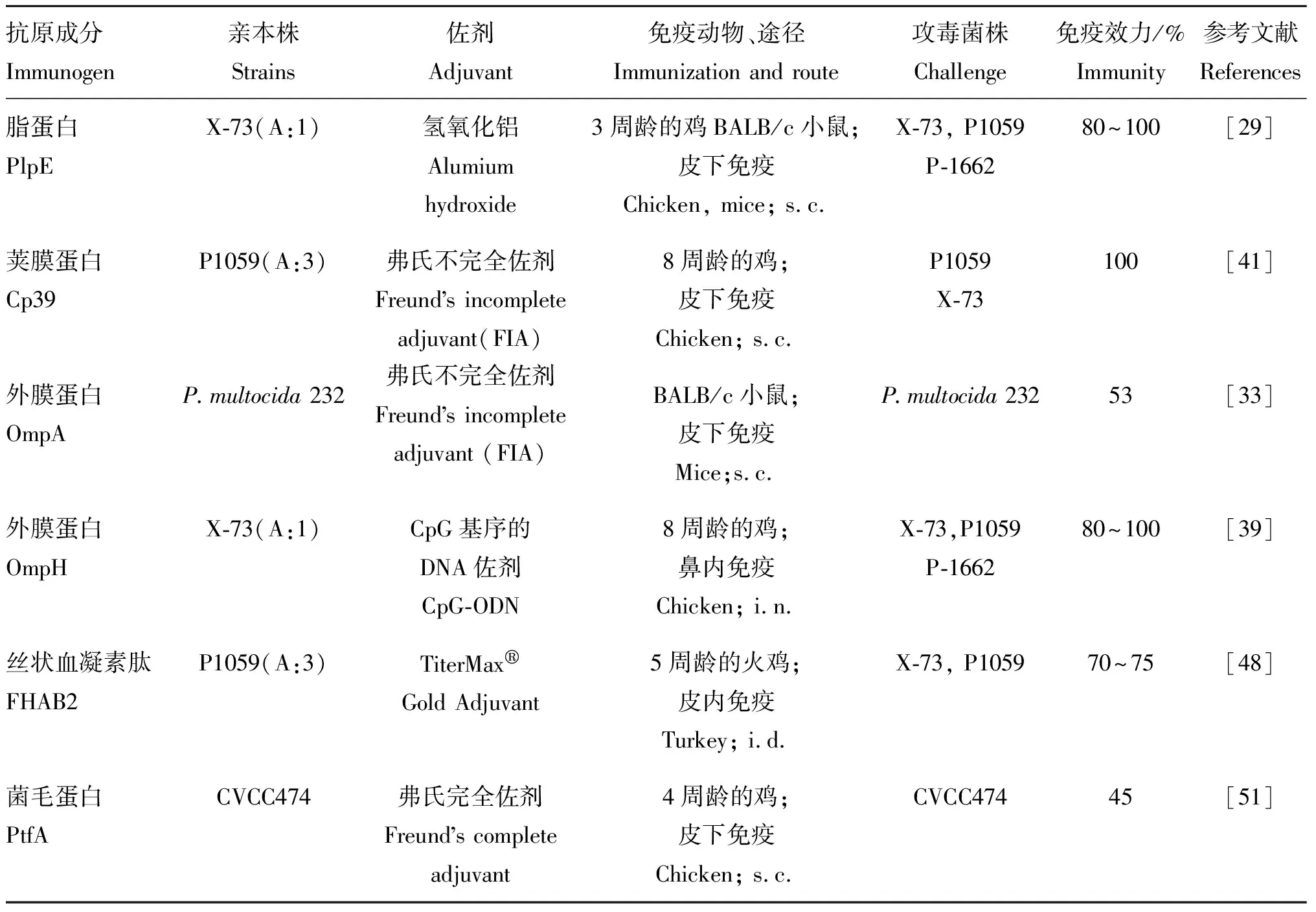
抗原成分Immunogen亲本株Strains佐剂Adjuvant免疫动物、途径Immunization and route攻毒菌株Challenge 免疫效力/%Immunity参考文献References脂蛋白PlpEX-73(A:1)氢氧化铝Alumium hydroxide3周龄的鸡BALB/c小鼠;皮下免疫Chicken, mice; s.c.X-73, P1059 P-166280~100[29]荚膜蛋白Cp39P1059(A:3)弗氏不完全佐剂Freunds incomplete adjuvant(FIA)8周龄的鸡;皮下免疫Chicken; s.c.P1059X-73100[41]外膜蛋白OmpAP.multocida 232弗氏不完全佐剂Freunds incomplete adjuvant (FIA)BALB/c小鼠;皮下免疫Mice;s.c.P.multocida 23253[33]外膜蛋白OmpHX-73(A:1)CpG基序的DNA佐剂CpG-ODN8周龄的鸡;鼻内免疫Chicken; i.n.X-73,P1059P-166280~100[39]丝状血凝素肽FHAB2P1059(A:3)TiterMax®Gold Adjuvant5周龄的火鸡;皮内免疫Turkey; i.d.X-73, P105970~75[48]菌毛蛋白PtfACVCC474弗氏完全佐剂Freunds complete adjuvant4周龄的鸡;皮下免疫Chicken; s.c.CVCC47445[51]
3 DNA疫苗
DNA疫苗是将编码保护性抗原的基因与真核细胞表达载体构建的重组质粒直接免疫机体,借助宿主细胞系统表达出保护性抗原,从而激活宿主的免疫系统。DNA疫苗的生产成本低,易于贮存与运输,接种方便,并且可以组合多种抗原基因,使疫苗研制的灵活性大大增加。
2011年,Gong等[52]将编码外膜蛋白OmpA和OmpH的基因融合,与真核表达载体重组从而制成DNA疫苗,并在体外通过间接免疫荧光验证了OmpA和OmpH的表达。该DNA疫苗针对同源菌株的攻毒可提供73.3%的保护效力,激发免疫鸡产生的抗体水平与减毒疫苗组相似。两年后,同一研究团队将分别表达OmpA、OmpH的DNA疫苗(pOMPA、pOMPH)和融合了OmpA、OmpH的DNA疫苗(pOMPHA)同时接种于4周龄鸡,并比较了保护效果。各免疫组所引起的抗体水平、淋巴细胞增殖、IFN-γ分泌水平都很显着,其中融合DNA疫苗pOMPHA为抵抗致死量的野毒感染提供的保护效果最好,不弱于减毒疫苗免疫组[53]。此外,Okay等[54]选择了血清型A:3菌株的ompH基因以及plpE基因的两个片段(plpEN、plpEC),通过融合以上片段和连接pCMV载体制成了3种DNA疫苗:pCMV-ompH、 pCMV-plpEN-ompH和pCMV-plpEC-ompH。同时比较了这三种DNA疫苗与rPlpE和rOmpH融合的两种重组亚单位疫苗(rPlpEN-OmpH、rPlpEC-OmpH)的免疫保护效力。结果显示,所有免疫小鼠的IFN-γ水平明显升高,但免疫保护效果不理想,其中3种DNA疫苗免疫小鼠均无法抵抗10倍LD50野生株的腹膜感染,在同一试验条件下PlpE和OmpH融合的亚单位疫苗的保护效力也仅有40%。说明以上DNA疫苗所激活的免疫反应不具有保护性,但具有免疫反应显着的特点,可以考虑将其作为基础免疫。在国内,曹素芳等[55]通过将多杀性巴氏杆菌的ompH基因片段插入到真核表达载体pcDNA3中,从而构建了OmpH的真核表达载体,为之后的DNA疫苗的研制奠定了基础。
从上述研究可知,目前应用于禽霍乱的DNA疫苗主要是外膜蛋白OmpA、OmpH、脂蛋白PlpE的基因序列,虽然只有二价融合的DNA疫苗所提供的免疫保护效果差强人意,但各疫苗诱导的体液免疫和细胞免疫都很显着。另一方面,花费低廉、技术受限少也是此类疫苗不容忽视的优点。未来这类疫苗研究的主攻方向是在稳定外源抗原表达水平的前提下,进一步提高DNA疫苗的免疫效果。随着DNA疫苗研究的深入和技术上的改进,这类新型疫苗有望在防治禽霍乱方面发挥显着作用。
4 总结与展望
禽霍乱的流行对养禽业的健康发展造成重大威胁。抗生素治疗仍是我国养殖业控制该病的主要手段,但随着流行菌株抗生素耐药性问题的日益严重,疫苗这一预防疾病最经济有效的手段应在未来发挥更重要的作用。如前所述,目前的商品化禽霍乱疫苗均存在一定的缺陷,因此发展更加安全、高效的疫苗成为疾病防控的重要需求。
传统的灭活苗在预防禽霍乱的早期发挥了重要的作用,但该种疫苗具有副反应较大、交叉保护力不足等缺陷。随着分子生物学的发展,多杀性巴氏杆菌的致病机制被逐步揭示,这显着推动了新型减毒疫苗的发展。相比传统弱毒苗,新型减毒疫苗具有基因背景明确的优点;相比传统灭活苗,减毒疫苗又具有可同时激发体液免疫、细胞免疫、可经黏膜接种、交叉保护力强等多种优势。但减毒疫苗的安全性令人担忧,因此,在保持菌株免疫原性的前提下,通过致病机制的深入研究发现更多毒力基因,以及利用多种毒力基因的组合缺失等策略提高减毒疫苗的安全性是未来研究的重要内容。同时,分子生物学、免疫学的发展也促使多杀性巴氏杆菌的多种保护性抗原被逐步发现,人们将这些抗原以蛋白质或DNA的形式制备成两种新型疫苗——亚单位疫苗和DNA疫苗。这两种疫苗也具有其特定的优势,包括制备方便、安全稳定、基因靶向明确、可制备多联、多价疫苗等。由于这两种疫苗的研制大多情况下都需要加入佐剂以提高免疫原性,因此如何开发新型佐剂激发免疫系统,尤其是通过激活固有免疫提升适应性免疫应答是发展这两种疫苗所需解决的关键科学问题。
综上,本文综述了预防禽霍乱新型疫苗种类的发展与现状,这一发展过程表明高效疫苗的研制有赖于致病机制与免疫保护机制的深入研究。一种理想的疫苗是能提供长期的同源和异源免疫保护效力,不仅能够阻止疾病暴发,而且能治愈已感染动物,同时在生产实际中接种简易,便于储存以及价格低廉。减毒疫苗符合上述大部分要求,但其安全性仍是人们所担忧的问题。在实际免疫程序中,应在免疫减毒疫苗之后接种安全无毒的灭活疫苗,达到既杜绝疾病暴发的风险又高效预防禽霍乱的目的。



