张晓战,杨 磊,邓同炜,赵攀登,彭志锋,陈露露,郭懿文,夏艳勋,乔宏兴,边传周*,王 增
(1. 河南牧业经济学院动物医药学院,郑州 450046; 2. 河南农业大学动物医学院,郑州 450046)
猪塞内卡病毒病是一种新近在猪群暴发流行的急性传染病,病原是猪塞内卡病毒(Senecavirus A, SVA),又称为塞内加谷病毒(Seneca Valley virus, SVV),属于塞内卡毒属(Senecavirus),为该病毒属的唯一成员,且只有一种血清型[1]。SVA基因组为单股正链RNA,全长约7.3 kb,包含一个大的开放阅读框(open reading frame, ORF),其两侧分别为5′和3′非编码区(untranslated region, UTR)。其中,ORF编码由2181个氨基酸组成的多聚蛋白前体,该多聚蛋白前体在宿主和病毒蛋白酶的共同作用下裂解为12个成熟的病毒蛋白,包括4个结构蛋白和8个非结构蛋白,蛋白布局遵循标准的“L-4-3-4”小核糖核酸病毒基因组的布局,从氨基端到羧基端依次为L-VP4-VP2-VP3-VP1-2A-2B-2C-3A-3B-3C-3D[2]。VP2、VP3和VP1蛋白位于SVA病毒粒子衣壳表面,且能够与受体蛋白炭疽毒素受体1结合,介导病毒的感染[3]。2C、3A、3C和3D蛋白在病毒复制过程中参与病毒基因组的复制与合成、蛋白合成和前体蛋白酶解等过程,是病毒复制过程中重要的参与者[4-5]。
近年来,随着分子生物学和细胞生物学的快速发展,研究人员利用反向遗传操作技术将外源报告基因插入到病毒基因组中,构建病毒复制子或重组病毒来进行抗病毒蛋白和药物筛选及细胞受体筛选等过程,大大地提升了病毒学相关研究的进程[6]。截至目前,荧光蛋白或荧光素酶基因已经成功的插入到人冠状病毒[7]、肠道病毒EV71型[8]、猪瘟病毒[9]、坦布苏病毒[10]等病原中,能够稳定的伴随着病毒的复制而表达。其中,增强型的绿色荧光蛋白(enhanced green fluorescent protein, EGFP)荧光强度高,细胞内表达稳定和检测荧光活性简便,广泛的应用到报告病毒的开发和应用。鉴于此,国内外学者先后将EGFP基因插入到SVA基因组中,成功拯救了表达荧光蛋白的重组毒株,证实重组毒株具有较好的遗传稳定性,且表现与亲本株类似的生长特性[11, 12],但后续基于该重组毒株筛选抗SVA药物的研究报道较少。
本研究将EGFP基因引入SVA 毒株CH/HeN-2018基因组2A和2B基因间。为了使EGFP蛋白能够正常合成,且不影响SVA病毒前体蛋白的翻译后修饰过程,在EGFP基因末端引入猪捷申病毒1型(porcine teschovirus-1)的2A基因,成功构建pSVA-EGFP载体。随后转染细胞,获得重组报告病毒rCH/HeN-2018-EGFP,并进一步证实该报告病毒能够稳定表达EGFP荧光蛋白,且病毒复制特性与亲本毒株相似,能够满足后期SVA病毒学试验的需求。
1 材料与方法
1.1 细胞与病毒
猪肾细胞系PK-15由河南省猪病工程中心实验室保存,猪源SVA临床分离株wtCH/HeN-2018分离自2018年河南地区发病猪群[13],重组毒株rCH/HeN-2018由本实验室构建及拯救[14]。PK-15细胞生长液为含8%胎牛血清、100 U·mL-1青霉素、100 μg·mL-1链霉素的高糖DMEM培养基,置于37 ℃含5% CO2培养箱中培养。病毒生长所需细胞维持液为含2%胎牛血清、100 U·mL-1青霉素、100 μg·mL-1链霉素的高糖DMEM培养基。
1.2 质粒与主要试剂
含CH/HeN-2018株全基因组感染性克隆pwtSVA由本实验室构建及保存[14];含有EGFP基因的pEGFP-C1由本实验室保存。DMEM培养基、opti-MEM培养基及0.25%-EDTA胰酶购自Gibco公司;胎牛血清购自四季青天杭生物公司;无缝克隆试剂盒、Lipo6000TM转染试剂和CCK-8溶液为碧云天生物公司产品;细胞培养瓶及细胞培养板为NEST公司产品;病毒RNA提取试剂盒购、质粒提取试剂盒和胶回收试剂盒购自天根生化生物公司;高保真DNA聚合酶和反转录试剂盒购自TOYOBO生物;黄芩苷、姜黄素和DMSO购自索莱宝生物公司。
1.3 携带EGFP标签重组SVA病毒的构建与拯救
1.3.1 pSVA-EGFP感染性克隆载体的构建 以实验室前期构建的含CH/HeN-2018株全基因组感染性克隆pwtSVA为基础,在基因组2A和2B蛋白间插入EGFP-P2A基因,构建载体pSVA-EGFP。其中,P2A为猪捷申病毒1型2A基因,其编码的2A蛋白具有高效的体内自我剪切活性[15]。将P2A基因由苏州鸿讯生物公司合成,并克隆连接至pEGFP-C1载体中EGFP基因末端,获得pEGFP-P2A载体。分别利用SVA-2B F/SVA-2A R和EGFP F/P2A R引物对(表1),以载体pwtSVA和pEGFP-P2A为模板进行PCR,PCR产物进行DpnI限制性内切酶37 ℃消化4 h后经胶回收,获得基因片段PSVA和PE-2A。将片段PSVA和PE-2A按照浓度比例1∶4进行配比,与等量的2X Seamless Cloning Mix缓冲液混合,50 ℃连接15 min,连接产物转化DH10B感受态细胞,经菌液PCR和测序鉴定阳性克隆,获得重组载体pSVA-EGFP(图1)。
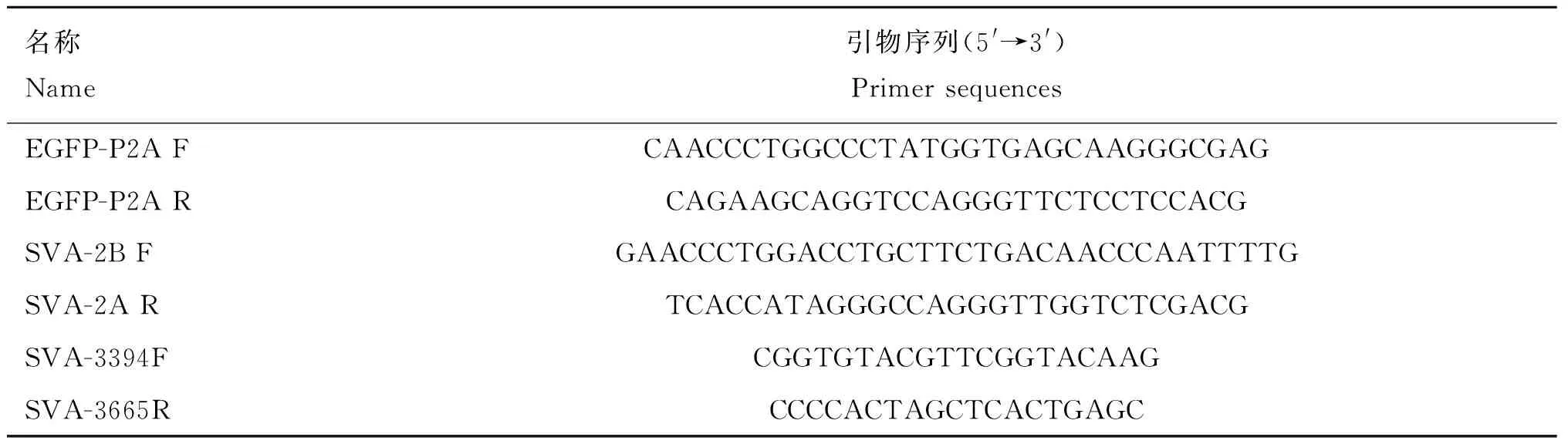
表1 引物信息
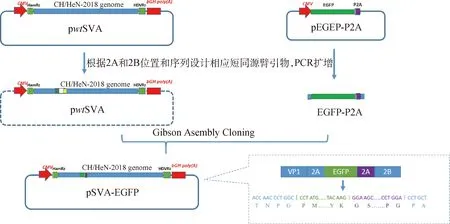
图1 携带EGFP标签重组SVA病毒载体的构建策略Fig.1 Schematic representation of the construction of recombinant SVA vector with EGFP gene
1.3.2 SVA重组荧光病毒的拯救 参照文献报道的方法[14]拯救SVA重组病毒。铺PK-15细胞于6孔板, 待其汇合度至80%左右,吸取5 μL转染试剂Lipo6000TM,在opti-MEM溶液背景下与2.5 μg重组质粒pSVA-EGFP混合均匀,室温孵育5 min,随后转染入状态良好的PK-15细胞。转染后4 h更换细胞维持液,间隔24 h观察细胞荧光表达情况。继续培养2 d,冻融细胞,离心,收取上清,即为重组毒rCH/HeN-2018-EGFP P0代。随后接种PK-15细胞,盲传至出现明显细胞病变,观察绿色荧光表达情况,记录病毒传代次数,获得重组毒rCH/HeN-2018-EGFP。
1.3.3 SVA重组荧光病毒的生长曲线 将生长良好PK-15细胞铺于96孔细胞培养板中,待其汇合度至85%左右时,将96孔细胞培养板中生长液吸弃,PBS洗涤2次,每孔加入100 μL细胞维持液。分别取临床分离株wtCH/HeN-2018、重组毒株rCH/HeN-2018和rCH/HeN-2018-EGFP病毒液用细胞维持液进行10倍倍比稀释,稀释度从10-1到10-10,将各个稀释度的SVA病毒稀释液加入96孔板,每孔100 μL,每个稀释度做8个重复。同时设置阴性对照组。逐日观察病变情况并记录,按照Reed-Muench氏法计算病毒滴度TCID50。
铺PK-15细胞于12孔板,待其汇合度至85%时,按照病毒感染复数MOI为0.1分别接种wtCH/HeN-2018、rCH/HeN-2018和rCH/HeN-2018-EGFP,37 ℃孵育1 h后PBS洗涤两次,添加细胞维持液继续培养。在12、24、36和48 hpi收取细胞上清。各毒株每个时间段设置3个重复。随后按照Reed-Muench氏法计算病毒滴度TCID50。
1.4 基于SVA重组荧光病毒检测抗病毒药物
1.4.1 姜黄素和黄芩苷细胞毒性试验 将生长良好PK-15细胞铺于96孔细胞培养板中,待其汇合度至90%左右时,PBS洗涤细胞2次后添加细胞维持液,分别加入终浓度10、20、40 μmol·L-1姜黄素和55、110、220 μmol·L-1黄芩苷。每组3个重复,同时设置DMSO对照组和空白组。培养48 h后,加入1/10体积的CCK-8溶液,置37 ℃、5%CO2培养箱培养1.5 h,酶标仪测OD450 nm值。计算(OD药物组-OD空白组)/(ODDMSO组-OD空白组)比值,分析不同浓度药物对PK-15细胞增殖的影响。
1.4.2 姜黄素和黄芩苷对SVA荧光毒复制的影响 将生长良好PK-15细胞铺于96孔细胞培养板中,待其汇合度至90%左右时,更换维持液,分别加入终浓度20 μmol·L-1姜黄素和110 μmol·L-1黄芩苷,同时设置DMSO对照组和空白组,每组3个重复。置37 ℃、5%CO2培养箱培养预处理2 h后,每孔加入0.1 MOI的rCH/HeN-2018-EGFP。在12、24、36和48 hpi观察各组细胞内荧光表达情况。48 hpi收取细胞上清,按照Reed-Muench氏法计算病毒滴度TCID50。
1.4.3 姜黄素和黄芩苷对SVA野毒株复制的影响 将生长良好PK-15细胞铺于24孔细胞培养板中,待其汇合度至90%左右时,更换维持液,设置终浓度20 μmol·L-1姜黄素、终浓度110 μmol·L-1黄连素、DMSO对照组和空白组,每组3个重复。预处理2 h后,每孔加入0.1 MOI的wtCH/HeN-2018,48 hpi收取细胞上清,按照Reed-Muench氏法计算病毒滴度TCID50。
2 结 果
2.1 rCH/HeN-2018-EGFP重组荧光病毒的拯救
将重组载体pSVA-EGFP转染PK-15细胞,转染后12 h时观察到部分细胞中存在绿色荧光,48 h时绿色荧光细胞增多,但无明显的细胞病变现象。rCH/HeN-2018-EGFP盲传至P2代时,在48 hpi出现明显的细胞的病变,80%细胞变圆、皱缩,且在感染细胞中观察到明显的绿色荧光;60 hpi感染70%细胞脱落,贴壁细胞病变,内含明显绿色荧光(图2A)。自P2代,rCH/HeN-2018-EGFP病毒病变时间稳定,在48 hpi诱使感染细胞明显病变,80%感染细胞脱落。通过PK-15细胞感染试验,测定P3代的rCH/HeN-2018-EGFP病毒滴度为107.76TCID50·0.1 mL-1(图2B)。

图2 rCH/HeN-2018-EGFP荧光观察(A)、重组病毒病毒效价(B)和不同代次重组病毒RT-PCR检测(C)Fig.2 Observation of the fluorescence of rCH/HeN-2018-EGFP(A),the virus titer of rCH/HeN-2018-EGFP(B) and the result of the RT-PCR assays for different passages of recombinant SVA virus(C)
2.2 rCH/HeN-2018-EGFP重组荧光病毒的生长特性
为进一步分析SVA重组荧光病毒遗传稳定性,将rCH/HeN-2018-EGFP连续在PK-15细胞传代10次,分析其病毒感染时荧光和基因组稳定性。荧光观察结果表明,P3~P10代次的rCH/HeN-2018-EGFP在感染过程中均能观察到大量的绿色荧光细胞。针对CH/HeN-2018株1D和2B基因设计上下游引物(SVA-3394F/SVA-3665R),RT-PCR试验证实各代次rCH/HeN-2018-EGFP中含有EGFP基因,能够克隆出1 055 bp的目的条带,而不含有EGFP基因的野毒株wtCH/HeN-2018克隆出272 bp的目的条带(图2C)。此外,对P10代病毒RT-PCR产物进行测序,发现EGFP-P2A基因序列没有出现突变的现象。
为验证SVA重组荧光病毒与亲本株之间生长特性的差异,分别将wtCH/HeN-2018、rCH/HeN-2018和rCH/HeN-2018-EGFP感染PK-15细胞,分析病毒生长曲线。试验结果表明,wtCH/HeN-2018、rCH/HeN-2018和rCH/HeN-2018-EGFP 3种病毒在PK-15细胞中表现相似的生长曲线。均在感染后12、24和36 hpi病毒滴度逐步明显上升,在36 hpi病毒滴度达到最高值。wtCH/HeN-2018和rCH/HeN-2018在48 hpi病毒滴度略有下降,而rCH/HeN-2018-EGFP在36 hpi 和48 hpi病毒滴度差异不明显(图3)。
2.3 基于rCH/HeN-2018-EGFP检测姜黄素和黄芩苷抗SVA活性
为分析SVA重组荧光病毒作为抗SVA病毒药物筛选工具的可行性,本研究进一步以SVA重组荧光病毒为研究对象,检验姜黄素和黄芩苷体外抑制SVA复制的影响。细胞毒性试验结果表明姜黄素和黄芩苷药物终浓度为20和110 μmol·L-1处理PK-15细胞时,其细胞活性与対照度无明显差异(图4)。姜黄素和黄芩苷药物预处理PK-15细胞2 h后,接种0.1MOI的rCH/HeN-2018-EGFP 24 h,发现姜黄素处理组和黄芩苷处理组绿色荧光细胞数量较DMSO处理组明显减少,其中,黄芩苷处理组减少极显着(图5A)。48 hpi时,观察到黄芩苷处理组绿色荧光细胞数量较DMSO处理组多,但黄芩苷处理组存在较多细胞贴壁,贴壁细胞呈现绿色荧光,而DMSO处理组细胞脱落达70%左右。结果表明,黄芩苷和姜黄素药物菌能够抑制rCH/HeN-2018-EGFP体外复制,其中,黄芩苷能够抑制效果较显着。
2.4 姜黄素和黄芩苷体外抑制wtCH/HeN-2018增殖活性
为进一步证实姜黄素和黄芩苷体外抑制SVA增殖的效果,使用wtCH/HeN-2018对姜黄素和黄芩苷抗SVA效果进行评价。结果表明,48 dpi时,黄芩苷处理组和姜黄素处理组细胞病变的程度较缓和,可见较多细胞贴壁,而DMSO处理组细胞病变明显,细胞脱落达85%左右。收取细胞上清进行病毒滴度试验,结果表明,黄芩苷处理组病毒毒价明显低于DMSO处理组,其中,黄芩苷处理组48 dpi病毒毒价与DMSO处理组相差100倍左右,抑制效果显着(图5B),进一步证实黄芩苷药物对SVA体外复制具有明显的抑制效果。

姜黄素 1.0× 代表20 μmol·L-1,黄芩苷1.0× 代表110 μmol·L-11.0× curcumin represent of 20 μmol·L-1,1.0× baicalin represent of 110 μmol·L-1图4 不同浓度药物处理对PK-15细胞生长的影响(A)和对细胞活性的影响(B)Fig.4 Effect of drugs at different concentration on the growth and viability of PK-15 cells
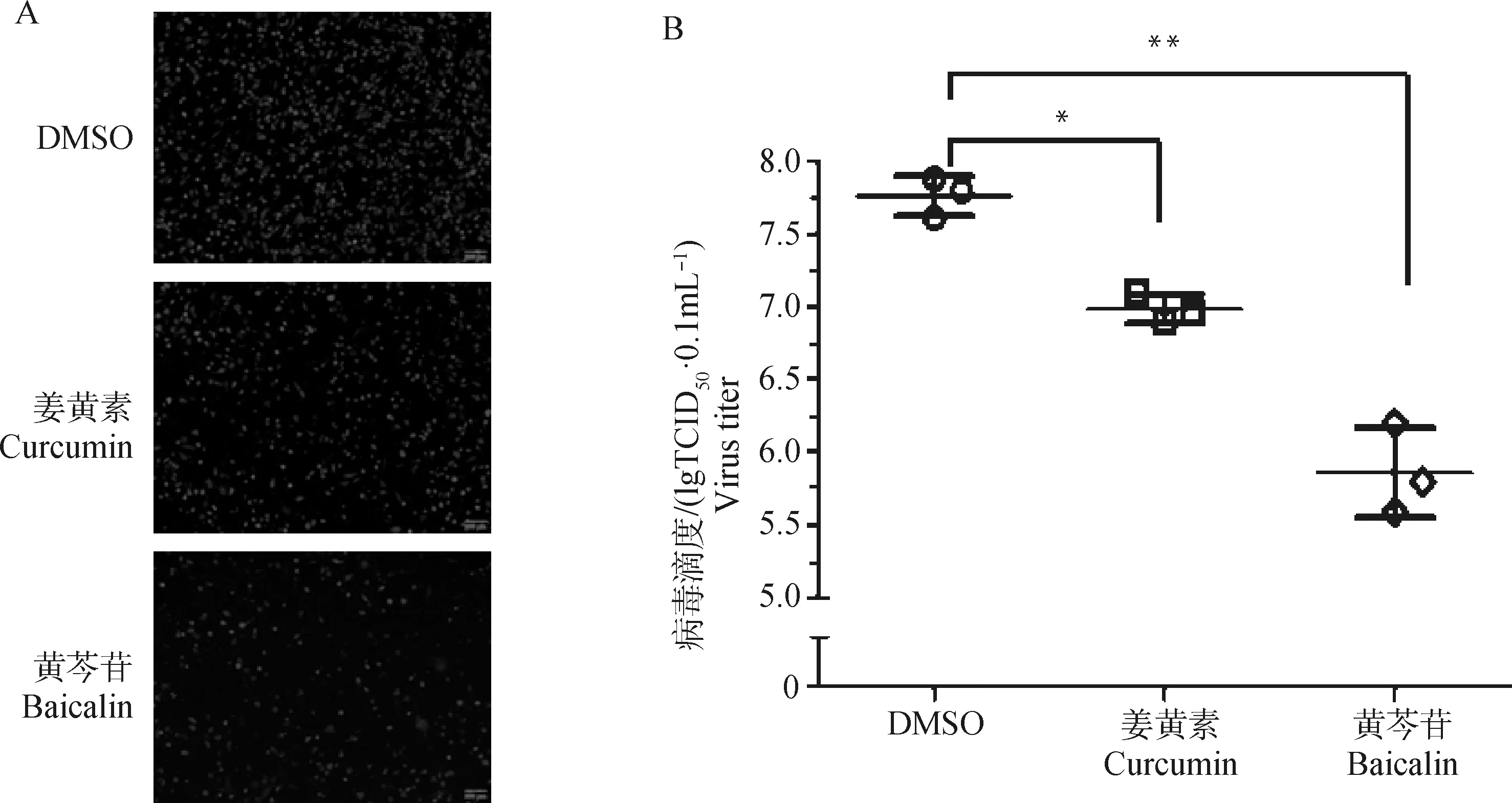
图5 姜黄素和黄芩苷处理对rCH/HeN-2018-EGFP(A,24 hpi)和wtCH/HeN-2018(B,48 hpi)复制的影响Fig.5 Effect of curcumin and baicalin treatment on the replication of rCH/HeN-2018-EGFP(A,24 hpi)and wtCH/HeN-2018(B,48 hpi)
3 讨 论
病毒的反向遗传技术是以获得的病毒基因组序列为基础,利用分子克隆技术构建病毒的感染性克隆模拟真实病毒粒子感染宿主,并复制、传代,形成具有感染性的新病毒粒子的过程。自1981年Racaniello和Baltimore[16]首次建立了脊髓灰质炎病毒的反向遗传操作系统以来,研究人员建立了针对副黏病毒、冠状病毒、黄病毒、疱疹病毒、细小病毒等病毒的反向遗传操作系统,该技术极大地扩展了人们对病毒的可操作性,推动了病毒学的快速发展。研究人员利用反向遗传操作技术将绿色荧光蛋白、红色荧光蛋白和荧光素酶等外源报告基因插入到病毒基因组中,构建病毒复制子或重组病毒,实现了抗病毒药物的体外快速筛选过程。Li等[9]构建的绿色荧光蛋白标记的猪瘟病毒,并以此作为工具用毒简化了血清中猪瘟中和抗体检测试验流程。申梁[7]将海参萤火虫酶基因插入到人冠状病毒HCoV-OC43基因组中,重组病毒rOC43-ns2DelRluc生长特性与亲本株类似,可稳定高效表达Rluc基因,并成功应用HCoV-OC43易感细胞和敏感药物的筛选研究中。研究人员先后将海参萤火虫酶和FMDV 2A蛋白的融合基因插入到寨卡病毒、登革热病毒和坦布苏病毒基因组结构基因第25氨基酸之后,拯救的重组病毒能够稳定表达荧光素酶蛋白,且应用到抗病毒蛋白和抗病毒药物的筛选中[10, 17]。本研究中将EGFP基因和猪捷申病毒1型2A蛋白的融合基因插入到SVA基因组的2A和2B基因间,获得了能够稳定表达绿色荧光蛋白SVA重组病毒。
目前,在兽医临床中存在多种可用的抗病毒的药物制剂,且实践证明存在较好的动物疫病治疗效果。关于抗病毒药物的有效成分研究是近年来国内外研究的热点方向。黄芪多糖、板蓝根多糖、黄芩苷、姜黄素、山药多糖、白藜芦醇、牛膝多糖等成分能够通过多种途径抑制病毒的复制,具有较好的抗病毒治疗疗效[18]。为验证所拯救的重组荧光SVA病毒是否能够应用于抗病毒药物的筛选试验,本研究选用黄芩苷和姜黄素两种药物进行病毒抑制试验。结果表明,黄芩苷具有明显抑制SVA病毒复制的效果,能够明显降低rSVA-EGFP感染细胞的荧光表达量,且缓和病毒感染所造成病变现象的发生。黄芩苷是一类中药黄芩主要活性成分,为黄酮类化合物,具有抵御病原微生物感染、抗炎和抗癌等多种生物功能[19]。Li等[20]研究表明黄芩苷能处理能够明显抑制EV71病毒体外复制过程,且降低感染细胞的凋亡。Qian等[21]研究表明,黄芩苷能够降低禽白血病ALV-J感染时病毒细胞内化过程和感染性病毒粒子的产生,从而抑制ALV-J体外复制。Chen等[22]研究表明,黄芩苷和黄芩苷磷脂复合物能够在体外明显抑制鸭病毒性肝炎1型DHAV-1体外复制的能力,且黄芩苷能够减弱DHAV-1内部核糖体进入位点的生物功能,从而影响病毒蛋白的翻译过程。Geng等[23]证实黄芩苷能够促进机体M1巨噬细胞极化,激活机体I型干扰素信号通路,从而抑制流感病毒复制。
自2014年起,SVA先后在多个美洲和亚洲养猪业发达国家暴发流行,如美国、巴西、加拿大、中国、泰国、哥伦比亚、越南等[1, 24]。2015年,SVA疫情首次在我国珠三角养猪密集地区暴发,随后蔓延至湖北、河南、山东、福建、黑龙江、甘肃等多个省市地区,已经给我国养猪业带来了一定的经济损失[25]。鉴于目前国内外尚无可用SVA商品化疫苗上市,多数的SVA疫苗生物制品尚处于研发初级阶段,到临床应用存在较长的时间间隔,不能有效地解决当前防控SVA疫情的难题。本研究基于SVA反向遗传操作系统构建并拯救SVA荧光毒株,为体外筛选具有抗SVA病毒活性的药物提供一种快速有效的工具,能够促进SVA防控药物研发和致病机制的研究进程,符合防控SVA疫情当前阶段的迫切需求。
4 结 论
将EGFP基因和猪捷申病毒1型2A蛋白的融合基因插入到SVA基因组的2A和2B基因间,获得了能够稳定表达绿色荧光蛋白SVA重组病毒,可以作为一种工具报告病毒应用于抗SVA药物和蛋白的筛选过程。



