陈清贻,从光雷,肖蕴祺,施寿荣*
(1.安徽农业大学动物科技学院,合肥 230036;2.中国农业科学院家禽研究所,扬州 225125)
血管紧张素转化酶2(angiotensin converting enzyme 2,ACE2)是一种发现于2000年的糖蛋白,它由信号肽、跨膜结构域及HEXXH锌结合域3部分组成[1]。ACE2可有效地将血管紧张素Ⅱ(AngⅡ)降解为血管紧张素1-7(Ang1-7),发挥其舒张血管及抗增殖作用。Ang(1-7)通过与Mas受体结合,发挥血管扩张和抗细胞增殖等作用[2-6]。因此研究ACE2蛋白的病理学作用对于治疗糖尿病、高血压等疾病具有重要意义[7],同时它还能作为一种生物标记物,在心血管疾病建立之前预测心血管风险[8]。ACE2广泛存在于心、血管、肠道、肺(尤其是2型肺细胞和巨噬细胞)、肾、睾丸和脑[9-10]。ACE2受体能够介导SARS-CoV、NL63和SARS-CoV-2三种冠状病毒进入细胞[11],测序发现,2019年新型冠状病毒肺炎(COVID-19)也是一种SARS-CoV[12],因此ACE2也被认为是COVID-19的受体之一。经溯源研究发现,COVID-19可能已经在蝙蝠中传播了数十年[13],并且在向人类传播的过程中存在中间宿主,因此研究多种动物ACE2的差异对于疾病的传播与控制而言十分重要。
目前对于ACE2基因的研究大多数都集中于啮齿类动物和哺乳动物[14-15],在禽类中也主要集中于水禽和国外白羽肉鸡品系[16-17],已经通过多种技术手段对ACE2蛋白功能进行了研究[18-21]。对我国黄羽肉鸡ACE2基因的研究还未见有报道。本试验以中国黄羽肉鸡的代表雪山草鸡作为研究对象,采用分子生物学手段获得雪山草鸡ACE2基因编码区序列,利用生物信息学方法对雪山草鸡的ACE2基因序列进行分析,用绝对定量的方法对雪山草鸡ACE2基因组织表达规律进行研究。旨在了解雪山草鸡ACE2基因结构及表达特性,为后续研究ACE2基因在肠道组织中的功能奠定试验基础。
1 材料与方法
1.1 试验材料
本试验在中国农业科学院家禽科学研究所邵伯试验基地进行。试验选取体重相近的雪山草鸡300只,公母各半。整个试验期间,所有鸡只自由饮水,常规光照和免疫。在45和90日龄时,公、母分别随机选取6只屠宰,无菌采集心、肺、肝、气管、胆囊(去除胆汁)、肾、十二指肠、盲肠、法氏囊、胸腺、空肠和回肠组织,PBS清洗后,快速放入2 mL进口无菌RNase-free EP管,置于液氮中速冻后,在-80 ℃保存用于组织基因表达研究。
1.2 主要仪器与试剂
TRIzol Reagent、反转录试剂盒购自美国Thermo公司;QuantiNovaTMSYBR®Green PCR Kit购自德国Qiagen公司;dNTP、Taq DNA聚合酶、DNA Marker DL5000、PCR切胶回收试剂盒、pMD19-T载体均购自大连宝生物TaKaRa公司;E.coliDH5α菌株由本实验室保存。
超微量分光光度计购自美国Thermo公司;电泳槽购自中国北京六一生物科技有限公司。
1.3 引物设计
根据GenBank上公布的红色原鸡(Gallusgallus)ACE2基因的mRNA序列(登录号:XM-416822.5),使用Primer 5.0软件设计引物。设计了ACE2基因CDS区克隆引物和荧光定量引物。具体的引物序列如表1所示。
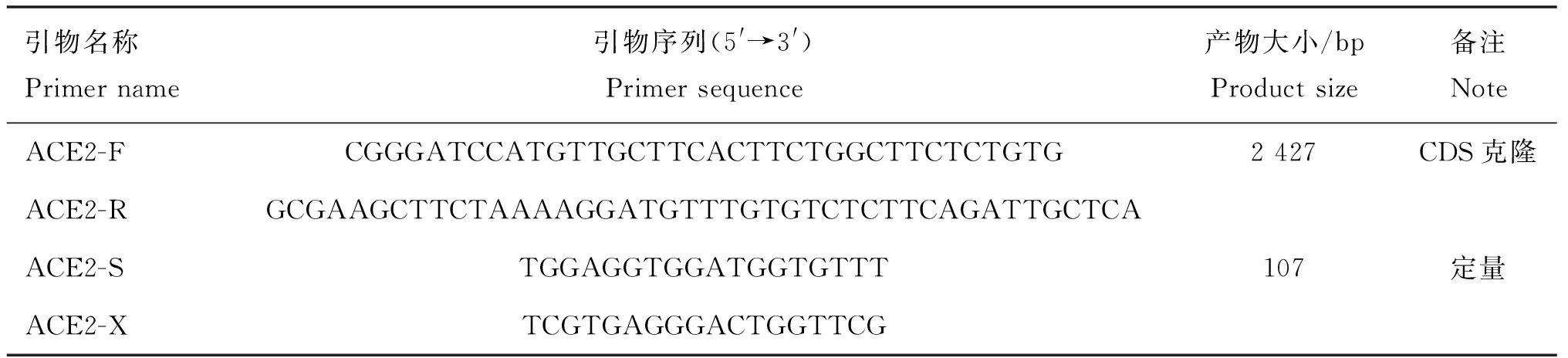
表1 用于克隆及定量的引物序列
1.4 总RNA的提取与cDNA合成
采用TRIzol法提取各组织总RNA,加入DNase 1去除可能存在的基因组DNA,用超微量分光光度计测定RNA浓度和纯度,OD260 nm/OD280 nm比值在1.8~2.1,说明RNA纯度较好;1.5%琼脂糖凝胶电泳检测可见清晰28S、18S和5S rRNA条带,且28S亮度约为18S亮度的两倍,说明RNA未降解,可用于后续试验。按照反转录试剂盒说明书,配置如下20.0 μL逆转录反应体系:2.0 μL的10×RT Buffer,0.8 μL的25× DNTP Mix(100 mmol·L-1),2.0 μL的10× RT Random Primers,1.0 μL的MultiscribeTMReverse Transcriptase,4.2 μL的DEPC H2O,总RNA10.0 μL(100 ng·μL-1)。震荡混匀后离心上述反应体系,置于普通PCR仪进行逆转录,反应条件为25 ℃ 5 min;42 ℃ 60 min;70 ℃ 5 min;4 ℃保存。
1.5 雪山草鸡ACE2基因CDS区克隆
以反转录合成的cDNA为模板进行PCR反应,RT-PCR扩增鸡ACE2基因CDS区,反应总体系为50 μL:cDNA模板2.0 μL,10 μmol·L-1上、下游引物各自1.0 μL,Platinum®PCR SuperMix, High Fidelity 45.0 μL,ddH2O到1 μL。扩增程序:94 ℃预变性2 min;94 ℃变性45 s,62 ℃退火30 s,72 ℃延伸1.5 min,38个循环;72 ℃再延伸10 min;最后4 ℃保存。PCR结束后,采用1.5%琼脂糖凝胶电泳进行分析,对PCR产物的特异性条带切胶回收后,连接pGM-T载体,转化高效化学感受态细胞DH5α,送往生工生物工程(上海)股份有限公司进行测序分析。
1.6 雪山草鸡ACE2基因生物信息学分析
从NCBI网站中搜索并下载数据库中常见动物的ACE2基因序列,使用dnastar软件进行序列的整理编辑分析。利用UCSC基因组浏览器和NCBI基因组数据库分析鸡ACE2基因结构及定位。选择常见的代表性物种,使用EMBL的多序列比对工具(http://www.ebi.ac.uk/Tools/msa)Clustal Omega 进行多序列比对及同源性分析。利用MEGA 10.0软件(https://www.megasoftware.net/)采用基于距离参数的邻接法(Neighbor-joining, NJ),自展分析Bootstrap 1 000次,构建常见脊椎动物ACE2基因的系统进化树。使用SignalP-5.0(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽分析;使用NetPhos 2.0 Server进行磷酸化位点预测。利用PSIPRED在线软件(http://www.bioinf.cs.ucl.ac.uk/psipred/)对ACE2蛋白进行二级结构分析。
1.7 雪山草鸡ACE2基因组织表达分析
以cDNA为模板,按照QuantiNovaTMSYBR®Green PCR Kit(Qiagen公司,德国)说明书,配置反应体系:避光混合离心上述反应体系,进行实时荧光定量PCR反应。RT-qPCR反应条件为:95 ℃ 2 min;95 ℃ 5 s,60 ℃ 10 s,共40个循环。该反应在实时荧光定量PCR 仪中进行,每个试验数据做3次 技术重复。利用Nano Drop 2000超微量分光光度计测定标准品浓度,根据如下公示计算其拷贝数,测定其拷贝数1.33×1010个·μL-1。将标准品进行10倍稀释:浓度1.33×109、1.33×108、1.33×107、1.33×106、1.33×105、1.33×104个·μL-1和空白对照,以其为模板进行RT-qPCR测定,建立标准曲线,用绝对定量的方法来测定各组织中ACE2基因的表达变化。
1.8 统计与分析
结果采用绝对定量计算方法,使用SPSS 26.0软件对试验数据进行独立样本T检验分析,P<0.05为显着性差异,P>0.05为差异不显着。
2 结 果
2.1 雪山草鸡ACE2基因克隆
对雪山草鸡ACE2基因CDS区序列设计引物进行PCR,对产物进行1.5%琼脂糖凝胶电泳,结果如图1所示,获得了约2.5 kb的序列,进行测序分析后发现序列长度为2 427 bp,经过比对分析,确认为雪山草鸡ACE2基因序列。ACE2基因共编码808个氨基酸残基,位于1号染色体,有18个外显子,17个内含子。经过与白羽肉鸡ACE2基因进行比对后发现,二者序列长度均为2 427 bp。但是在黄羽肉鸡序列中存在大量突变位点,其中127、146、510、540、575、1 180、2 048和2 165位的突变均使得编码的氨基酸发生了变化。
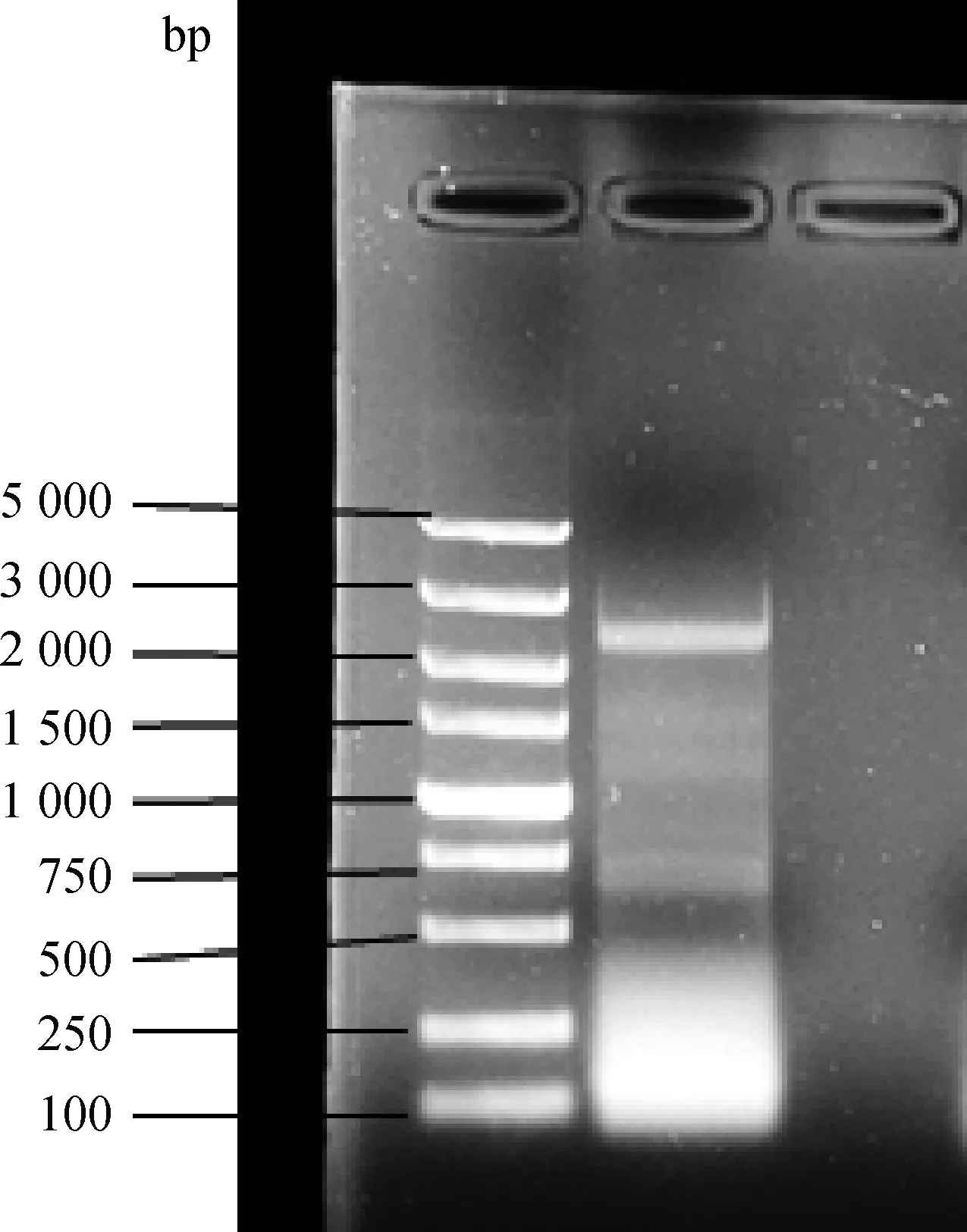
图1 雪山草鸡ACE2克隆电泳图
2.2 雪山草鸡ACE2基因的生物信息学分析
2.2.1 雪山草鸡ACE2基因序列理化性质及同源性分析 通过NCBI在线网站对雪山草鸡ACE2基因与其他物种的ACE2基因核苷酸序列进行理化性质及同源性分析,发现雪山草鸡的ACE2基因序列中含有丙氨酸(29.2%)、半胱氨酸(21.7%)、甘氨酸(25.1%)和苏氨酸(23.9%)4种氨基酸,其分子式为C7 252H12 079N2427O3 009S527,分子量大小为180 ku。同源性分析结果见表2,与家禽的同源性要高于哺乳动物,与红色原鸡的同源性最高为99%,其次与绿头鸭为88%,与哺乳动物的同源性为73%~76%,其中与人的同源性为76%。对常见物种的ACE2氨基酸序列构建分支进化树,结果如图2所示,雪山草鸡先与红色原鸡聚为一支,然后再与其他禽类聚为一支,最后与哺乳动物聚为一支,这与同源性分析结果一致。
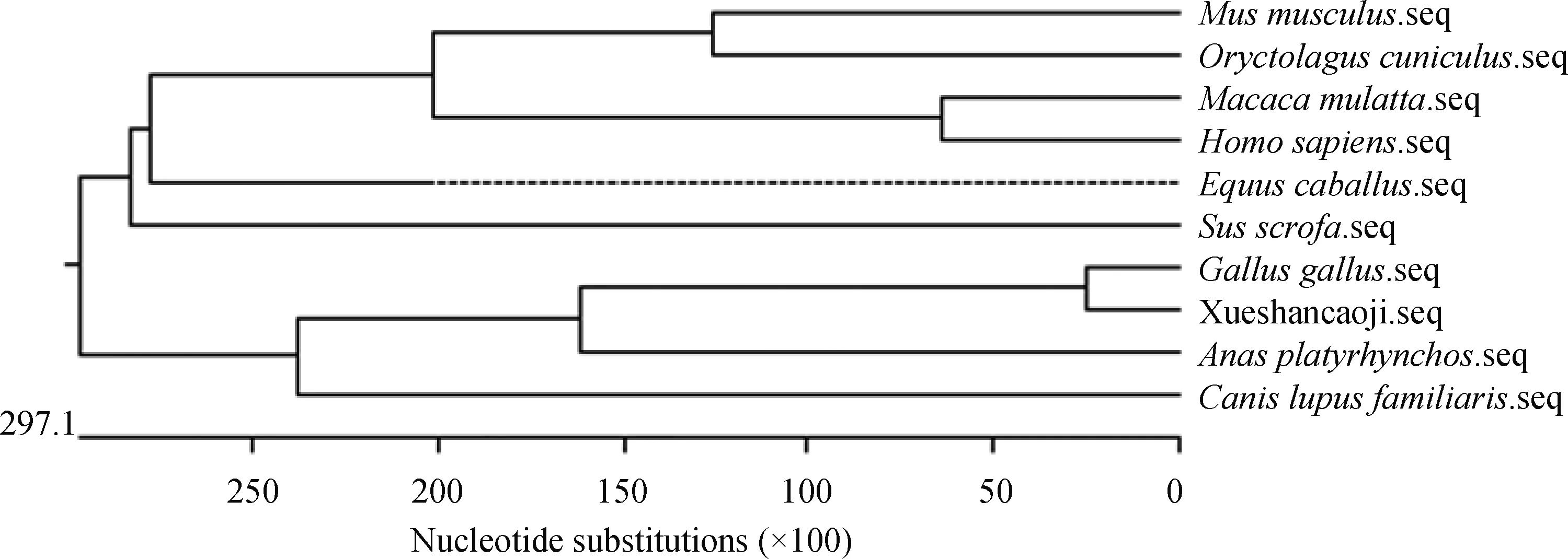
图2 雪山草鸡与不同物种ACE2分子进化树
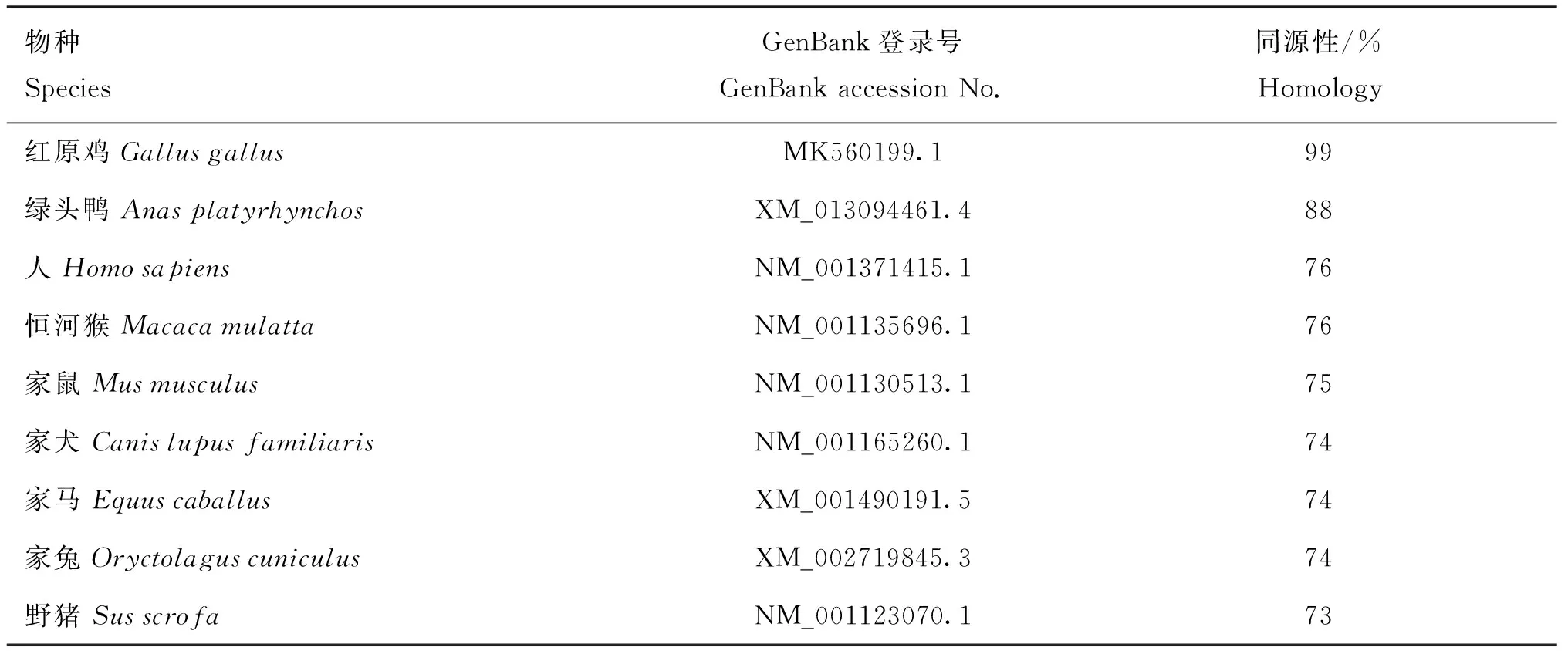
表2 雪山草鸡ACE2基因同源性分析结果
2.2.2 雪山草鸡ACE2蛋白二级结构及多参数分析 利用PSIPRED在线软件对雪山草鸡ACE2蛋白的二级结构进行预测,结果如图3所示,该片段有452处α螺旋(56.01%),20处β折叠(2.48%)。较多的α螺旋可以维持蛋白质的刚性结构,使得ACE2蛋白更好地与冠状病毒S糖蛋白的S1亚基内的受体结合结构域CTD1结合。

图3 雪山草鸡ACE2蛋白二级结构分析
2.2.3 雪山草鸡ACE 2蛋白信号肽分析 结果如图4所示,图框处OTHER值最大为0.946 8,SP值其次,CS值最高峰在第17~18氨基酸之间存在潜在的裂解位点。该蛋白此处D值为0.594 1,是分泌性蛋白,信号肽区域在第1~17氨基酸之间。
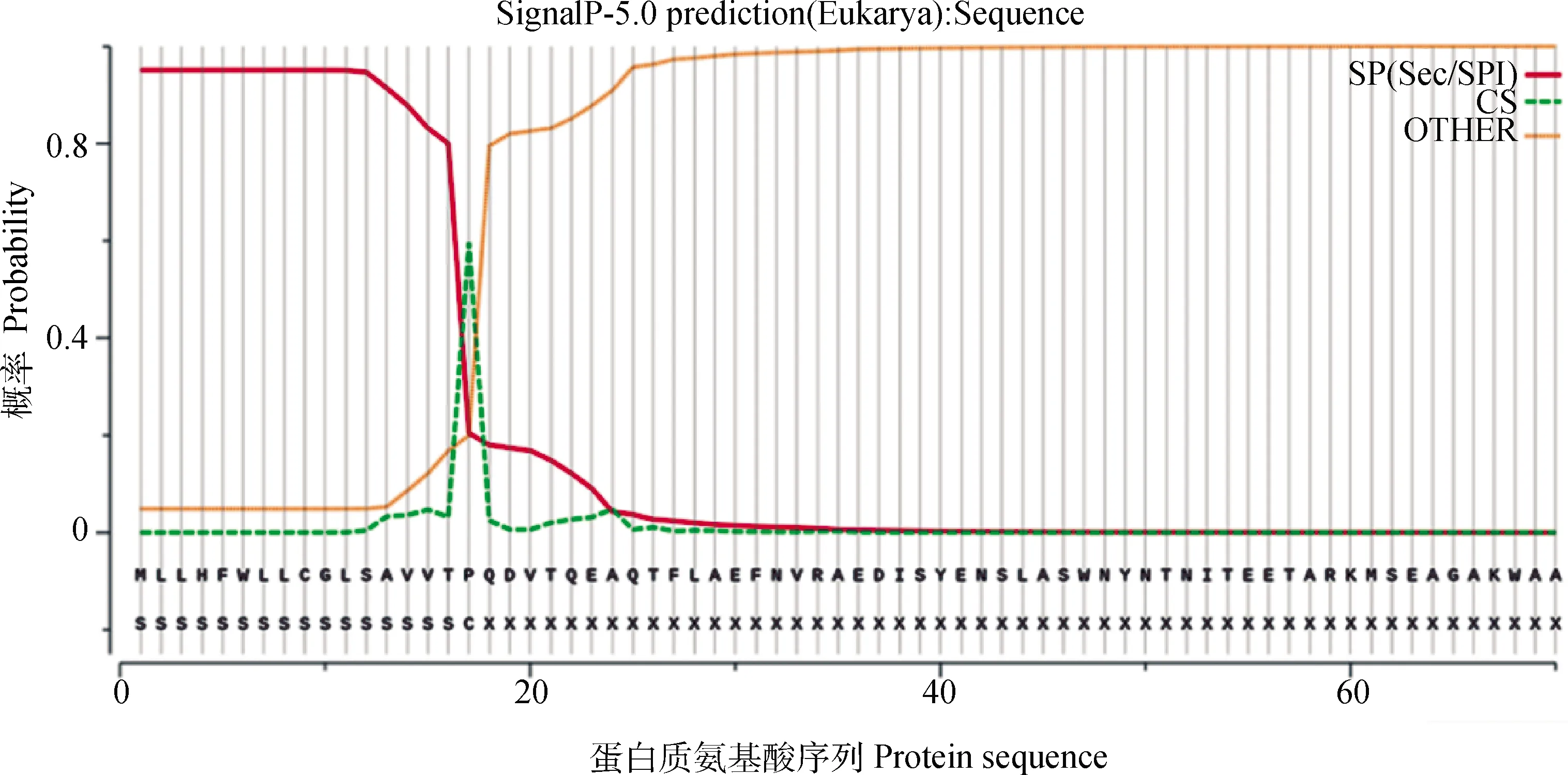
图上有3种可能性概率,SP(Sec/SPI),CS(裂解位点)和OTHER(序列没有任何类型的信号肽)
2.2.4 雪山草鸡ACE2基因编码蛋白质磷酸化位点分析 统计结果见图5,显示雪山草鸡ACE2蛋白有46处磷酸化位点,其中19处丝氨酸磷酸化位点(41.30%),12处苏氨酸磷酸化位点(26.09%)和15处酪氨酸磷酸化位点(33.61%)。较多的磷酸化位点暗示,ACE2蛋白功能发挥过程中受到多种磷酸化修饰。

A.ACE2蛋白氨基酸序列;B.磷酸化位点预测结果。T、Y、S分别表示苏氨酸、酪氨酸和丝氨酸磷酸化位点,点代表非磷酸化位点
2.3 雪山草鸡ACE2基因组织表达分析
2.3.1ACE2基因在雪山草鸡不同组织中表达变化 由表3可知,小肠(十二指肠、空肠和回肠)中ACE2表达量显着高于其它组织(P<0.05)。法氏囊、气管、胆囊和脾中ACE2表达量较低,脾中表达量最低。
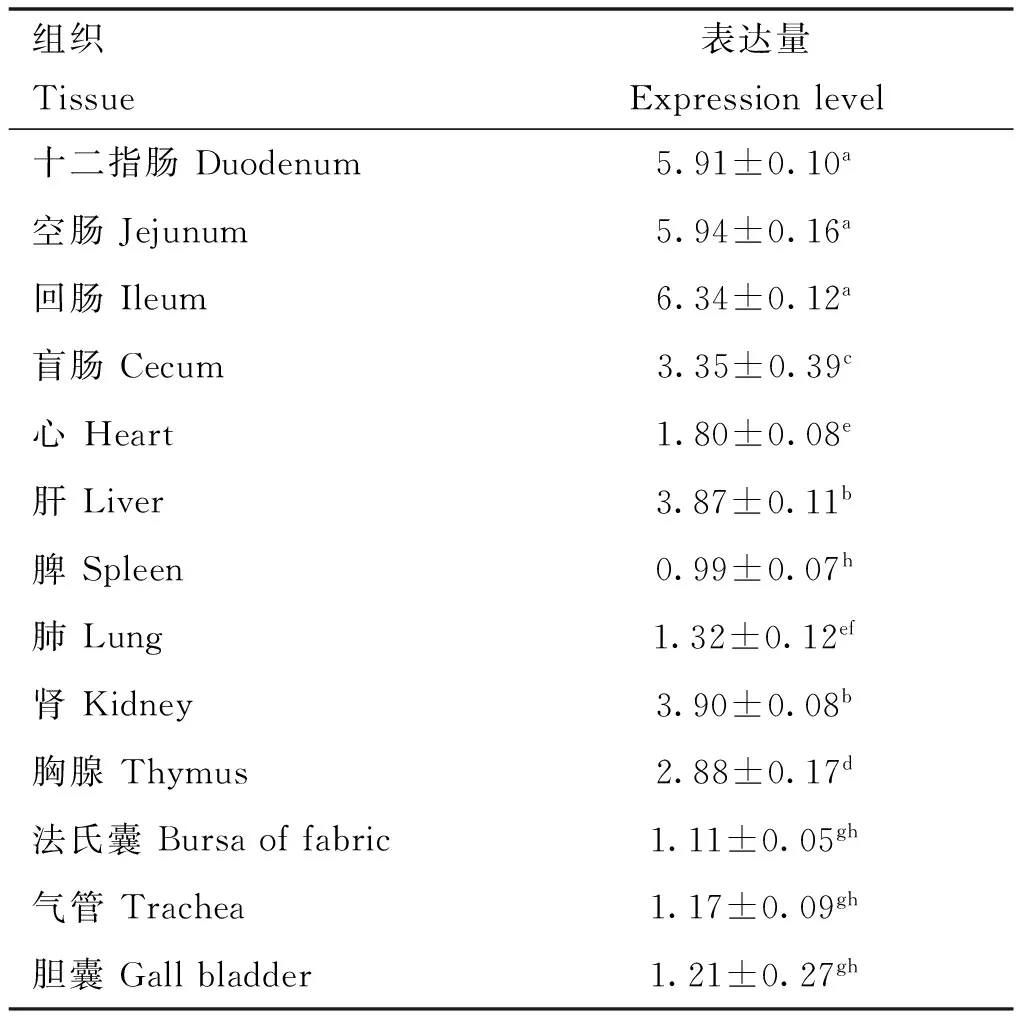
表3 ACE2基因在不同组织中的表达量
2.3.2ACE2基因在雪山草鸡不同性别间的表达变化 由表4可知,母鸡空肠、盲肠、脾和肺中ACE2基因表达量显着高于公鸡(P<0.05)。公鸡肾和心中ACE2基因表达量显着高于母鸡(P<0.05)。
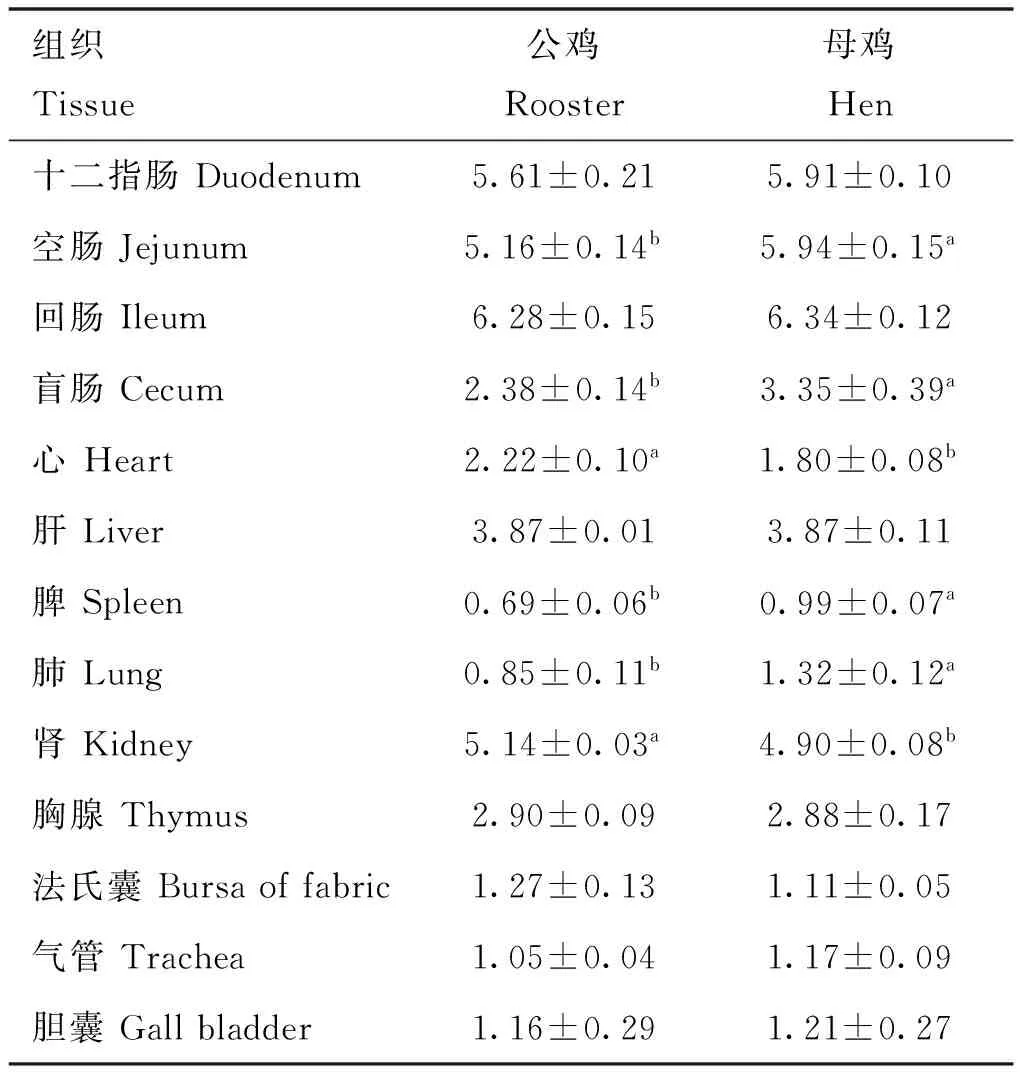
表4 ACE2基因在不同性别间的表达量
2.3.3ACE2基因在雪山草鸡不同日龄间的表达变化 由表5可知,90日龄雪山草鸡的十二指肠、空肠、肺、脾和回肠组织ACE2基因表达量均显着低于45日龄雪山草鸡(P<0.05),在法氏囊和肾组织中结果呈相反趋势(P<0.05)。
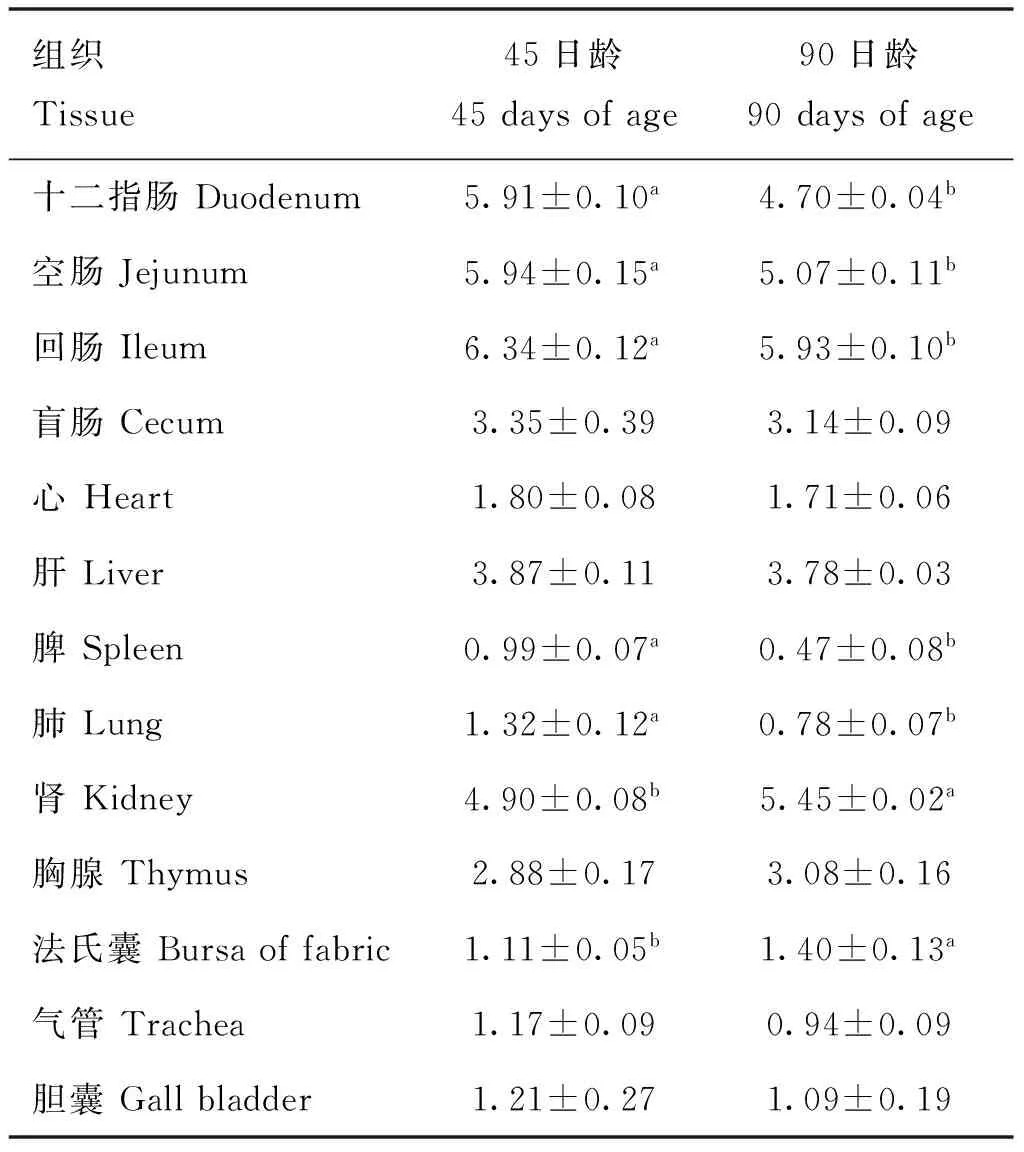
表5 ACE2基因在不同日龄间的表达量
3 讨 论
3.1 雪山草鸡ACE2基因的克隆及生物信息学分析
ACE2是一种参与机体心血管体液调节的跨膜糖蛋白,其基因改变能够诱导如高血压、代谢及行为功能障碍等疾病的发生[22-24]。该基因编码蛋白是SARS和HCoV-NL63等人类冠状病毒S糖蛋白的功能受体。故而在2019年COVID-19爆发后,ACE2基因就备受关注。已知冠状病毒最早于1937年从鸡中分离出来,它引发了禽类中传染性极高的禽传染性支气管炎[25],产生了较大的经济损失,故而研究鸡ACE2基因具有重要意义。ACE2全长片段最早在2000年被克隆和报道[4-5],自此之后相继在山羊和猪中成功克隆ACE2基因的序列,而在家禽中的报道相较甚少。
杨维维等[14]在山羊肾组织中克隆得到ACE2基因的全长片段(2 415 bp,GenBank登录号:KF921008.1),其共编码氨基酸805个,生物信息学分析预测山羊ACE2的蛋白属于I型跨膜蛋白,第1~18氨基酸之间是其信号肽区域。肖航[15]克隆了仔猪的ACE2全基因序列(2 418 bp),编码氨基酸805个。生物信息学分析预测仔猪ACE2蛋白也是Ⅰ型跨膜蛋白,第1~17氨基酸之间是其信号肽区域。本研究发现,雪山草鸡ACE2基因共编码808个氨基酸,比对后发现,虽然与白羽肉鸡序列同样编码808个氨基酸,但是却存在大量的突变位点,其中8个位点的突变可以导致编码的氨基酸发生变化,序列结构决定了功能,这可能是黄羽肉鸡和白羽肉鸡在免疫以及抵抗病毒侵袭方面差异的原因之一,下一步应对突变在这一过程中的作用加以重点研究。ACE2属于Ⅰ型跨膜蛋白,信号肽区域位于1~17氨基酸之间。另外,其与红原鸡同源性高达99%。通过对该蛋白二级结构预测,发现其α螺旋比率达56.01%,另外,有46个磷酸化位点,其中有19处丝氨酸磷酸化位点(41%),12处苏氨酸磷酸化位点(26%)和15处酪氨酸磷酸化位点(33%)。这些分析结果与前人研究其它物种的结果相一致[16-17]。ACE2由808个氨基酸组成,是具有单一胞外催化结构域的I型跨膜糖蛋白。像ACE一样,ACE2有2个结构域:氨基末端催化结构域和羧基末端结构域。催化结构域有1个活性位点—锌金属肽酶结构域。ACE2首先在结构上保守,这决定了其功能的保守性,即作为受体与冠状病毒外壳S糖蛋白受体结构域结合,传递信号。ACE2被鉴定为SARS冠状病毒基本受体,而在SARS中,ACE2的下调在病毒感染后严重肺衰竭的发病机制中起着重要作用。ACE2在多个物种中表现出结构上的保守性,预示着其在物种间发挥功能可能依赖着某种共有的模式。
3.2 雪山草鸡ACE2基因组织表达差异
ACE2是ACE的同源物,近年来研究发现,ACE2基因在心、肾、睾丸等器官中均有表达[4-5],另外在肺和肝等组织中也均有表达[26]。目前,已明确人体小肠(十二指肠、空肠和回肠)、肾、心和睾丸中呈现高表达,其中以回肠中表达量最高,而在免疫器官和神经器官中表达量较低[27-28]。本试验选取13个组织进行ACE2基因表达量的检测,涵盖了免疫系统、消化系统、生殖系统以及循环系统。试验结果发现,雪山草鸡机体ACE2基因表达量最高的3个脏器依次为回肠、空肠和十二指肠;脾和法氏囊等器官表达量偏低。肠道等消化系统器官ACE2基因表达量高的结果与前人研究结果一致,王珊珊等[29]对仔猪体内ACE2基因克隆的研究也指明ACE2基因表达与胃肠道发育有关。Wong等[30]也证实,小鼠小肠ACE2基因表达量最高,且主要在肠道上皮细胞中表达,具有转运物质的作用。PubMed数据库中公布了研究人员对来自27个不同组织的95个人的组织样本进行了RNA-seq分析,该分析结果表明,ACE2蛋白在小肠和十二指肠中高表达,而在肺部组织中有较低的表达水平[31]。但是尤其值得注意的是,ACE2是病毒进入宿主细胞的受体,生物进程是与宿主病毒相互作用。按照推测,ACE2应该与免疫性状密切相关,应该在免疫组织器官中有明显的变化,而目前的研究均表明,其在小肠中有较高的表达,这提示ACE2基因或与雪山草鸡的胃肠道生长发育有较大相关性。已有的研究表明,ACE2并不与肾中的氨基酸转运蛋白结合,而是与肠道中的氨基酸转运蛋白结合,故而在肠道中ACE2表现出高度表达,氨基酸被吸收[32]。而ACE2的这一功能与其肽酶活性无关,其肽酶活性不是与氨基酸转运蛋白配对所必需。
本试验选取相同日龄的公鸡与母鸡,对13个组织进行ACE2基因表达检测。结果发现,肺、心、肾、盲肠、脾和空肠组织中ACE2基因表达量具有性别特异性。Cai[33]在新冠肺炎的临床调查发现,男性的患病率略高于女性,但是差异并不显着。Zhao等[34]在全球范围内采集大量数据,但结果发现不同性别肺组织ACE2基因表达量差异不显着。本试验结果与上述研究结果并不一致,这可能是试验对象或生理不同造成的。而雪山草鸡在肺、心和肾等组织中的表达差异可能是生殖激素造成的,后续还需进一步研究。娄丽丽等[35]使用全转录组测序法研究发现,在不同日龄小鼠组织中ACE2基因表达存在动态变化,提示年龄与ACE2基因表达具有一定相关性。Chen等[36]使用绵羊作为研究RAS发育的动物模型,发现新生羊ACE2基因的表达显着低于成年羊,提示成人ACE2基因表达水平可能高于儿童。Xie等[37]研究发现,老年人的ACE2基因表达量低于青年人。本试验分别选取45与90日龄雪山草鸡进行比对,除了十二指肠、空肠与肾差异显着外,肺和脾表达量也有差异。90日龄雪山草鸡中ACE2基因表达量明显小于45日龄,说明ACE2基因表达确实会随着日龄的增长而降低,这与前人研究结果相似[38]。
本试验中观察到ACE2基因在小肠中表达量高于其他组织,其原因可能在于ACE2在小肠中与氨基酸转运蛋白结合,促进氨基酸在肠道中的吸收,与肠道的生长发育有着密切关系[1];但是必须指出的是,作为与冠状病毒的外壳S糖蛋白结合的受体蛋白,它又充当着为病毒入侵宿主提供信号转导的角色。这意味着一旦家禽感染传染性支气管炎等冠状病毒类的疾病,由于ACE2角色的特殊性,必定先在肠道组织中产生症状,在家禽粪便中也就必定会存在大载量的病毒(2019年人新冠肺炎疫情中已经被证实[39-40]),由于鸡舍的环境条件,通过粪-口传播的风险也更加高。这提示我们,在家禽生产中防治家禽传染性支气管炎时,要注意切断这一传播途径,从而减少损失。
4 结 论
本研究以雪山草鸡为试验素材,通过克隆获得了雪山草鸡ACE2基因编码区序列全长;生物信息学分析发现,雪山草鸡ACE2基因在家禽中较为保守,ACE2蛋白属于分泌型蛋白;ACE2基因表达规律呈现出在雪山草鸡肠道组织中高于其他组织,母鸡中高于公鸡,随着时间表达水平下降的趋势。研究结果为开展ACE2基因在黄羽肉鸡肠道中的功能研究奠定了试验基础。



