左 扬,李 田,胡秀花,宋志强,孙城涛,吴聪明,王少林*
(1.中国农业大学动物医学院,北京 100193; 2.内蒙古伊利实业集团股份有限公司,呼和浩特 010080)
奶牛乳房炎是奶牛养殖中的常见疾病,不仅危害奶牛本身健康,增加病牛的淘汰率,还会在影响牛奶品质及引发食品卫生安全问题的基础上造成生产经济的巨大损失。根据美国国家乳房炎委员会(National Mastitis Council, NMC)报告表明,由奶牛乳房炎造成的全球经济损失高达390亿美元[1];而我国据统计约有1 400万头奶牛,仅临床型奶牛乳房炎的每年发生率可高达60%,平均年发生率为33.4%,每年造成的经济损失超过6亿元人民币[2]。
病原微生物是引起奶牛乳房炎最重要的原因,包括细菌、真菌、支原体、病毒等,细菌占95%以上,其中,金黄色葡萄球菌是造成奶牛养殖行业经济损失的关键因素,肺炎克雷伯菌引起的奶牛乳房炎与其他细菌性乳房炎相比更难控制[3]。根据病原菌的感染方式与传播途径,可以将引起奶牛乳房炎的病原菌又分为传染性病原菌和环境性病原菌,其中,以金黄色葡萄球菌、大肠杆菌、乳房链球菌、无乳链球菌等分离率最高(表1)。

表1 中国各地区常见奶牛乳房炎病原种类
β-内酰胺类抗生素是包括奶牛乳房炎在内的各种抗感染治疗的首选抗生素,随着近几十年的广泛应用,病原菌经基因突变产生了超广谱β-内酰胺酶(extended-spectrum beta-lactamases,ESBL)[17],并且已有研究表明ESBL的出现是目前耐药菌对广谱β-内酰胺类抗生素产生抗性的重要原因。编码ESBL的基因具有多种类型,目前,全球大约发现300种,主要分为3种:blaCTX-M、blaSHV和blaTEM[18],编码ESBL的基因可以在不同菌种的细菌之间通过克隆或基因的水平转移传播[19]。迄今为止,有多种病原菌都被报道携带编码该酶的基因。就乳房炎病原菌来说,国外包括日本、英国、法国、德国、印度以及突尼斯等国家报道的产ESBL乳房炎病原菌常见肠杆菌科细菌,基因类型以CTX-M型为主[20-25]。而国内近几年报道的产ESBL乳房炎病原菌以大肠杆菌、肺炎克雷伯菌最为常见[26-27],此外还包括鲍曼不动杆菌、阴沟肠杆菌、蜡样芽胞杆菌、铜绿假单胞菌等,携带的ESBL耐药基因以TEM、CTX-M、OXA型多见[28-29]。这些产ESBL病原菌导致了奶牛乳房炎的高发生率和低治愈率,极大地限制了奶牛乳房炎的临床用药,增加了奶牛养殖业的经济损失。
现今的奶牛养殖模式使大数量的奶牛暴露在一个共同的养殖环境下,若养殖环境中存在较多产ESBL耐药菌,在奶牛躺卧、挤奶操作不当等情况下使产ESBL耐药菌进入奶牛乳区成为引起奶牛乳房炎的病原菌,增加环境耐药菌引起奶牛乳房炎的危险性[30]。并且产ESBL耐药菌在进入牛奶后经药物作用会产生内源性β-内酰胺酶。自2009年起,卫生部《全国打击违法添加非食用物质和滥用食品添加剂专项整治抽检工作指导原则和方案》的通知(食品整治办〔2009〕29号)中明文规定:“添加β-内酰胺酶(拮抗剂)等非食品用物质属违法行为”[31]。不同学者对北京[32]、江苏淮安[33]、新疆巴州[34]等地区的市售牛乳或生鲜牛乳进行了内酰胺酶残留检测,发现每个地区的检测样品均有阳性检出,且样品来源广泛。但是常规检测方法无法区分耐药菌产生的内酰胺酶与人工添加的内酰胺酶,牧场只能对内酰胺酶阳性的牛奶丢弃或者销毁,对牧场造成巨大的经济损失。因此,对于奶样呈现内酰胺酶阳性的牧场应尽快开展溯源工作,消除污染源。
综上,本研究对5个牧场的产ESBL耐药菌进行了流行性研究,并对第6个牧场原奶内酰胺酶的来源进行追溯研究,为控制牧场中内酰胺酶的流行提供了科学依据。
1 材料与方法
1.1 主要材料
大肠杆菌ATCC 25922购自美国典型微生物菌种保藏中心(American Type Culture Collection, ATCC);科玛嘉ESBL显色鉴别培养基购自法国梅里埃公司;阿莫西林购自中国药品生物制品鉴定所;头孢他啶购自北京偶合科技公司;头孢噻肟购自Sigma-Aldrich公司;β-内酰胺酶快速检测试纸条购自北京维德维康生物技术有限公司。
1.2 主要仪器
超净工作台购自苏州净化设备有限公司;基质辅助激光解吸电离飞行时间质谱仪购自德国Bruker公司。
1.3 试验设计
1)对内蒙古和宁夏5个牧场养殖环境产ESBL耐药菌流行特征研究,2)对第6个“内酰胺酶检测长期阳性”特殊牧场的内源性内酰胺酶进行溯源研究。
1.4 试验方法
1.4.1 样本采集 样本采集时间为2020—2021年,采集对象为内蒙古和宁夏6个牧场养殖奶牛的牛奶以及与奶牛养殖相关的样本,6个牧场分别以A、B、C、D、E和F命名,其中,F为“内酰胺酶检测长期阳性”牧场。采样过程随机,力求覆盖牧场。采集直接使用15 mL离心管采集目标样本,并且采样过程中使用无菌技术,戴无菌乳胶手套。采集完成后,在简易冰盒中妥善保存,并加急送往实验室,收到立即进行分菌工作,而后将其保存于-80 ℃冰柜中备用。
1.4.2 牛奶样本β-内酰胺酶检测 采用β-内酰胺酶快速检测试纸条法对6个牧场的24份牛奶样本进行检测(外加1份上市奶粉样用作阴性对照)。
1.4.3 产ESBL耐药菌的分离鉴定 所有样本均采用“三区划线法”划线科玛嘉ESBL显色鉴别培养基,37 ℃培养18~24 h后,用一次性接种环挑取颜色不一的可疑菌落,再次划线加有2 μg·mL-1头孢噻肟的BHA琼脂平板,37 ℃18~24 h后,挑单菌落采用基质辅助激光解析电离飞行时间质谱法(matrix-assisted laser desorption/ioniation time of flight mass spectrometry, MALDI-TOF MS)进行细菌的种属鉴定。
首先对任务之间的距离进行计算,然后通过聚类将距离相近的任务分群。最后根据任务群周边信息和打包策略确定最终的定价方案。对比分析任务标价情况,发现打包后任务标价分布更加密集,任务标价相比打包前更加统一,更有利于提高任务成功率。
1.4.4 药敏试验 采用琼脂稀释法进行药敏试验,以大肠杆菌ATCC 25922为质量控制标准菌株,测定A~E 5个牧场牛奶样本、乳区皮肤拭子以及环境样本中分离到的产ESBL耐药菌对阿莫西林、头孢他啶、头孢噻肟3种β-内酰胺类抗生素的最小抑菌浓度(minimal inhibitory concentration,MIC),测定MIC后参照CLSI标准及EUCAST标准判断菌株的耐药表型。
1.4.5 菌株全基因组测序 A和D牧场选择14株分别来源于牛奶、皮肤拭子以及环境中的产ESBL大肠杆菌,F场选择两株分别来源于健康奶牛和乳房炎奶牛的牛奶样本的产ESBL鲍曼不动杆菌,用细菌DNA提取试剂盒提取菌株基因组,而后送北京赛默百合公司进行全基因组测序。
2 结 果
2.1 牧场中产ESBL耐药菌流行情况
A~E 5个牧场采集了17份牛奶样本、97份乳区皮肤拭子样本以及39份养殖环境样本(包括新鲜粪便、卧床垫料、运动场土壤和污粪、舍饲草料等),F牧场采集了7份牛奶样本(表2)。样本来源涵盖健康奶牛以及乳房炎奶牛。根据试纸条的检测结果表明,上市奶粉样确为阴性,24份牛奶样本的检测结果成立。据统计前5个牧场的17份样本共检测出16份阳性样本,1份阴性样本,0份无效样本;F牧场7份样本全为阳性。此外A~E 5个牧场17份牛奶样本仅A和D场各分离出两株产ESBL大肠杆菌(extended-spectrum beta-lactamases resistantEscherichiacoli, ESBL-Ec),其余136份样本中有65份样本分离到产ESBL耐药菌。总之,在A场(51.6%,16/31)、B场(33.3%,10/30)、C场(53.3%,16/30)、D场(35.5%,11/31)和E场(51.6%,16/31)中均有不同种类的产ESBL耐药菌被分离出来,以产ESBL大肠杆菌占比最大(79.5%,62/78),其余为产ESBL塞氏柠檬酸杆菌(9.0%,7/78)、产ESBL阴沟肠杆菌(5.1%,4/78)、产ESBL鲍曼不动杆菌(2.6%,2/78)、产ESBL肺炎克雷伯菌(2.6%,2/78)以及产ESBL丙二酸盐阴性枸橼酸杆菌(1.3%,1/78)等;以上分离菌株对阿莫西林(100%)耐药率最高,而后依次为头孢噻肟(91.0%)、头孢他啶(78.2%)。
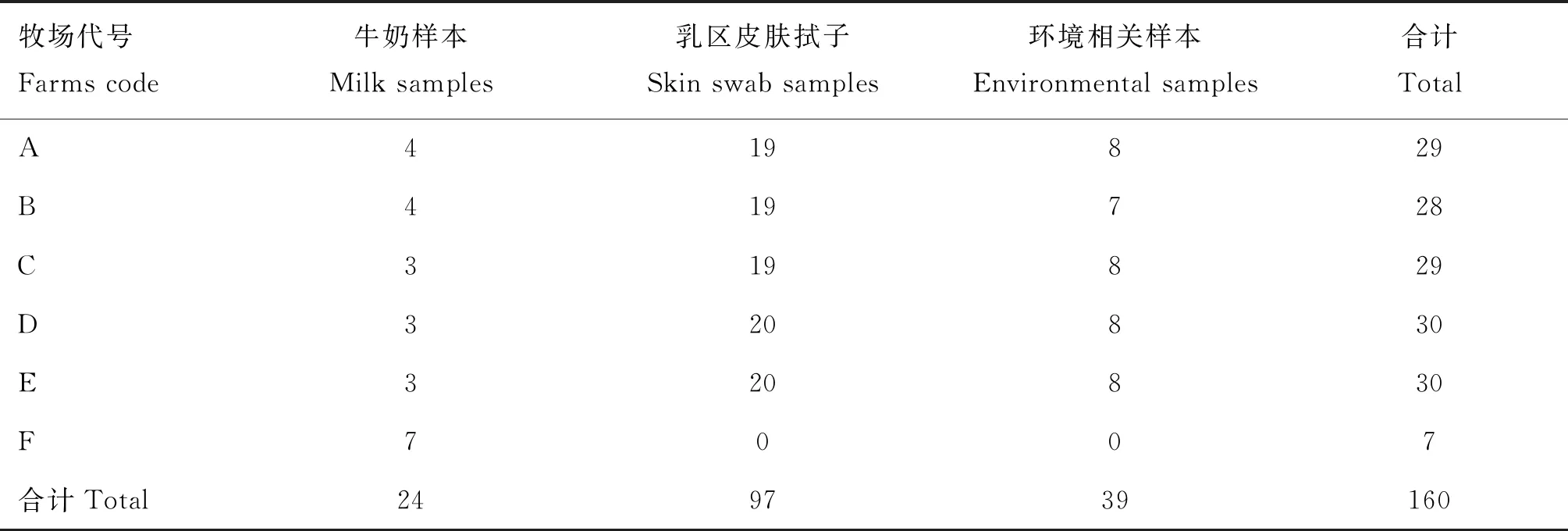
表2 样本采集明细
F牧场的7份牛奶样本共分离出2株产ESBL鲍曼不动杆菌,一株来源于健康奶牛,另一株来源于乳房炎奶牛。
2.2 产ESBL耐药菌的基因组特征
根据细菌全基因组测序结果显示,测序的产ESBL大肠杆菌检测到多种类型的耐药基因,包括氨基糖苷类耐药基因、β-内酰胺类耐药基因、磺胺及增效剂耐药基因、林可胺类耐药基因、大环内酯类耐药基因以及四环素类耐药基因等,其中,以β-内酰胺类耐药基因的携带率最高,尤其是blaCTX-M的携带率高达100%;氨基糖苷类耐药基因、磺胺类耐药基因、大环内酯类耐药基因以及四环素类耐药基因的携带率均为33.3%;林可胺类耐药基因仅1株分离菌株携带,携带率为6.7%。并且A场有3株(37.5%,3/8)、D场有4株(57.1%,4/7)分离菌株携带有两种或两种以上耐药基因。
另外,F场的两株产ESBL鲍曼不动杆菌经全基因组测序发现它们的MLST分型相同,并携带相同的毒力基因和β-内酰胺类耐药基因(表3)。
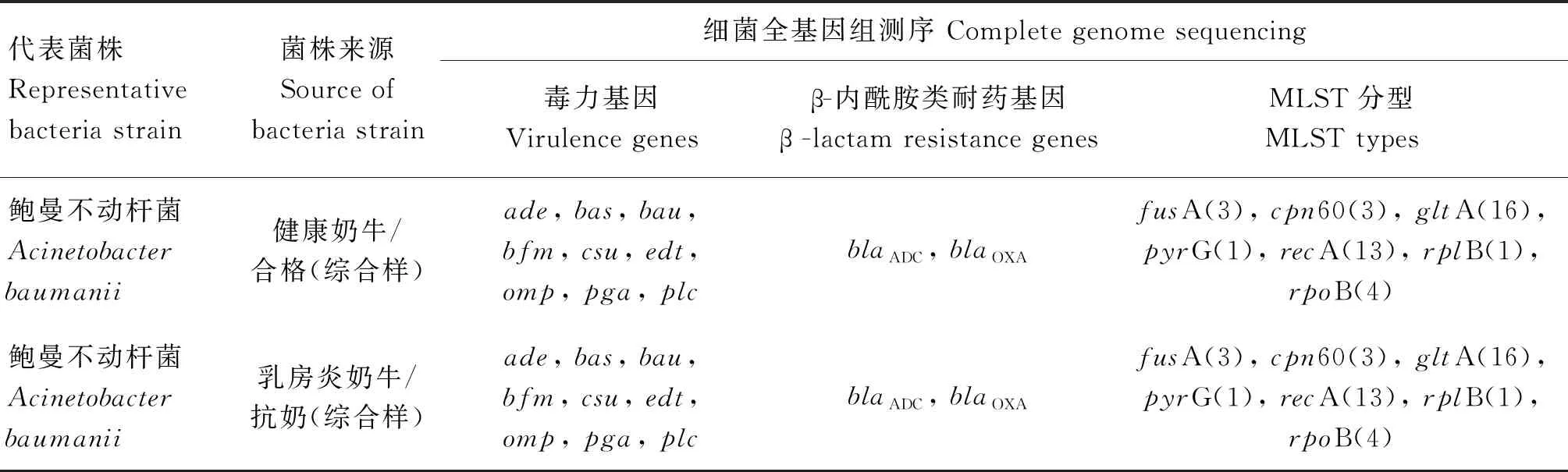
表3 两株产ESBL鲍曼不动杆菌的全基因组测序结果
3 讨 论
经调查发现,这些牧场在奶牛乳房炎的治疗或其他感染性疾病的治疗中多使用β-内酰胺类抗生素,但不同牧场在抗生素的使用方面有一定的习惯与偏好,导致来自不同牧场的样本分离出的产ESBL耐药菌的菌株以及分离菌株的耐药情况都有不同程度的差异。从分离结果来看牧场的产ESBL耐药菌主要是肠杆菌科细菌,以环境分离率高,但也有部分来自牛奶,与国内外报道情况类似[35-37]。奶牛牧场养殖环境中广泛存在产ESBL耐药菌,这些细菌在增加奶牛乳房炎感染概率的同时,还会降低抗生素的治疗效果,而且该类型细菌产生的β-内酰胺酶还会极大程度地降低牧场牛奶质量,并使其检测不合格。以上均严重影响牧场的经济效益。随着耐药菌的迅速传播与发展,抗生素联合用药显得更为重要。
自20世纪80年代以来,β-内酰胺类抗生素与β-内酰胺酶抑制剂的组合制剂随势而生且不断发展,至今上市的β-内酰胺酶抑制剂有克拉维酸、舒巴坦、他唑巴坦、阿维巴坦和法硼巴坦5种,组合制剂有头孢他啶-阿维巴坦、亚胺培南-西司他丁-雷利巴坦以及美罗培南-法硼巴坦等[38]。而兽用的组合制剂主要是阿莫西林-克拉维酸钾片、阿莫西林钠克拉维酸钾注射液、氨苄西林-舒巴坦甲苯磺酸盐以及注射用氨苄西林钠-舒巴坦钠[39]。牧场在单独使用β-内酰胺类抗生素无效情况下可以尝试使用这些组合制剂,以提高抗菌药物对产ESBL耐药菌的抑制和/或杀灭作用。
自采集于A和D场的产自乳房炎奶牛的牛奶样本、乳区皮肤拭子样本以及环境样本中分离纯化获得的ESBL-Ec经过细菌全基因组测序可发现,它们均携带有β-内酰胺类耐药基因blaCTX-M,推测这些基因很可能来源于环境。奶样中β-内酰胺酶检出率很高,在排除外源人为非法添加β-内酰胺酶后,内源性β-内酰胺酶需要引起高度重视。推测其来源有3种可能性:1)奶牛体内其他来源的产β-内酰胺酶耐药菌进入奶牛乳腺产生的,但未引起奶牛乳房炎或/和未引起奶牛明显全身症状,这些产酶菌很可能来源于牧场养殖环境;2)引起奶牛乳房炎的产β-内酰胺酶耐药菌产生的,很可能也来源于牧场养殖环境;3)大罐奶存放时被环境中的产β-内酰胺酶耐药菌污染,且奶中可能有抗生素残留,耐药菌与抗生素相互作用后产生β-内酰胺酶。
F牧场采集的7份牛奶样本中,分离出产ESBL鲍曼不动杆菌的样本β-内酰胺酶检测呈阳性,通过细菌全基因组测序发现两株不同来源的产ESBL鲍曼不动杆菌具有高度相似性。产ESBL鲍曼不动杆菌一般主要存在于奶牛养殖环境中,可以从堆肥、垫料、运动场等环境中分离到,所以推测产ESBL鲍曼不动杆菌是造成该场β-内酰胺酶检测长期阳性的主要菌株,很可能来源于环境。
4 结 论
本研究揭示了A、B、C、D和E这5个牧场养殖环境中产ESBL耐药菌广泛存在,并探明耐药菌携带的耐药基因类型;明确β-内酰胺酶在原奶中广泛分布,评估牧场产ESBL耐药菌存在的风险;探明造成F牧场原奶中内酰胺酶检测长期阳性的原因,为指导牧场乳房炎的防控与治疗提供科学依据。



