李艳萍,刘婷丽,李 红,陈国梁,王立群,郭小腊,骆学农,2*
(1.中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,兰州 730046;2.扬州大学,江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
多房棘球蚴病(Echinococcosismultilocularis,Em),又称泡球蚴病(alveolar echinococcosis,AE),是多房棘球蚴绦虫的中绦期幼虫-多房棘球蚴(E.multilocularis,Em)寄生于人和啮齿类动物的肝所引起的一种严重的人畜共患寄生虫病,广泛流行于欧洲、北美、亚洲北部及我国西北地区[1-2]。犬、狐狸、狼等为其终末宿主,而啮齿类动物为其中间宿主[3]。人因误食虫卵而感染,幼虫寄生于肝,如恶性肿瘤一样形成局部侵袭性和浸润性生长,并可转移到其他组织器官[4],未经治疗的患者死亡率高达90%[5]。目前,使用手术切除结合阿苯达唑(ABZ)药物是公认的治疗方法[6]。
巨噬细胞亚群主要包括促炎的M1型和抗炎的M2型。M1型巨噬细胞通常产生高水平的促炎细胞因子,如TNF-α、IL-1β、IL-6、IL-12和诱导型一氧化氮合酶(inducible NO synthase,iNOS)等,从而表现出强大的抗微生物和肿瘤活性;而M2型巨噬细胞通常产生高水平的甘露糖受体(CD206)、精氨酸酶1(Arg1)及IL-10和TGF-β等,从而抑制炎症反应,促进组织重塑、血管生成和肿瘤形成[7-11]。肝巨噬细胞主要由常驻枯否氏细胞(KCs)和单核巨噬细胞(MoMφs)组成,在免疫耐受、维持肝稳态和抗炎微环境中发挥重要作用[12]。研究证实,多房棘球蚴感染早期刺激宿主产生Th1型免疫应答,随着AE的发展逐渐转变为Th2型免疫抑制反应。同时,在感染过程中也可能伴随M1/M2型巨噬细胞极化[13]。据报道,多房棘球蚴感染小鼠在第5天时肝中就出现大量以M1表型(F4/80+)为主的巨噬细胞浸润,通过产生促炎细胞因子来清除早期幼虫。而在慢性感染阶段极化为M2表型,从而有利于虫体的持续性感染[14]。
微小RNA(miRNAs)和环状RNAs(circRNAs)参与不同水平的转录调控[15]。miRNA通常与靶基因3′UTR互补结合,抑制mRNA的转录或降解,从而下调靶基因的表达[16]。circRNAs作为一种内源性RNAs,通过与miRNAs的竞争性靶向结合,从而调节靶基因的表达[17]。越来越多的证据表明,miRNAs和circRNAs参与细胞自噬、凋亡、增殖等生理病理过程[18-22],在调控疾病进程中发挥重要作用[23-27]。在寄生虫感染过程中,很多miRNAs参与宿主巨噬细胞的极化[28-30],在调节宿主与病原相互作用中发挥关键作用。目前,circRNA-miRNA-mRNA调控网络在疾病的致病机制、诊断、治疗领域具有很大的研究潜力[31]。因此,本研究通过RNA高通量测序分析,筛选并鉴定与多房棘球蚴感染诱导巨噬细胞极化相关的非编码RNA(ncRNA),并建立与之相关的circRNA-miRNA-mRNA调控网络,旨在探索ncRNAs在多房棘球蚴感染诱导的KCs极化中的作用机制,为进一步揭示多房棘球蚴的免疫逃避机制,探索其诊断标志提供重要的理论依据。
1 材料与方法
1.1 材 料
1.1.1 实验动物及虫体 BALB/c小鼠,雄性,6~8周龄,购自中国农业科学院兰州兽医研究所实验动物中心。长爪沙鼠(Merionesunguiculatus)购自北京首都医科大学,多房棘球蚴于长爪沙鼠体内保种。
1.1.2 主要试剂 胶原酶Ⅳ(Gibco, USA)、胎牛血清(Fetal bovine serum,FBS)、RPMI-1640培养基、Opti-MEM无血清培养基、0.25%的胰蛋白酶(trypsin)均购自Gibco公司;lipofectamine 3000、TRIzol试剂购自Invitrogen公司;HiScript®III 1 st Strand cDNA Synthesis试剂盒购自南京诺维赞生物公司;All-in-One qPCR Mix、qPCR内参GAPDH、U6引物均购自Gene Copoeia;mmu-miR-466c-5p模拟物购自上海生工生物公司。
1.1.3 主要仪器 恒温循环水浴、ABI 7500实时荧光定量PCR仪(Termo Fisher)、CO2恒温培养箱(Termo Fisher)、水浴锅、低速冷冻离心机和倒置荧光显微镜(Leica)等。
1.2 方 法
1.2.1 多房棘球蚴原头蚴感染小鼠模型的建立 采用颈椎脱臼处死长爪沙鼠,取出腹腔内寄生的多房棘球蚴包囊,研磨过滤后收集原头蚴,并进行计数。将60只BALB/c小鼠随机分为感染组和对照组,每组30只。感染组每只小鼠腹腔接种600只原头蚴,对照组腹腔注射等体积PBS,分别在感染后1、2和3月处死小鼠,分离肝KCs。
1.2.2 小鼠肝KCs的分离鉴定 分别取感染组和对照组小鼠各3只,麻醉后暴露腹腔,将乙二醇双四乙酸(EGTA)经肝门静脉注入肝。2 min后,灌注含0.04%的胶原酶Ⅳ的EB(Earle’s balanced salt solution)溶液,消化6 min。摘取肝,剔除胆囊及结蹄组织,放入含0.1 mg·mL-1DNase Ⅰ及0.08%的胶原酶Ⅳ的EB中,充分研磨,于37 ℃水浴内消化30 min,用70目细胞筛过滤后,收集滤液于50 mL离心管,45×g离心5 min,收集上清液,加入等体积的GBSS(Gey’s balanced salt solution)缓冲液,600×g离心10 min。弃上清,用少量GBSS重悬沉淀,并加入GBSS溶液至50 mL,500×g离心10 min,弃上清,用2~3 mL GBSS重悬细胞沉淀。用GBSS分别配制20%和11.5% 的optiprep溶液,并用长针头将20%、11.5% optiprep溶液及细胞悬液依次沿管壁缓慢加入15 mL离心管中,1 400×g离心17 min,收集最上面的KCs层于15 mL离心管,加入GBSS缓冲液,600×g离心10 min,收集细胞沉淀,用含10% FBS的RPMI-1640进行培养。
KCs培养4 h后,用TRizol提取总RNA, HiScript®III合成cDNA第一链,用All in one qPCR Mix进行qRT-PCR反应,检测KCs表面标志分子F4/80及肝星状细胞(hepatic stellate cell,HSC)标志分子Col1a1、Col3a1、a-SMA及GFAP的水平。反应体系:2×All in one qPCR Mix 10 μL,Rox Reference Dye 0.4 μL,上、下游引物(2 μmol·L-1)各1 μL,cDNA模板2 μL,DEPC水 6.5 μL。反应程序参数:95 ℃预变性10 min,94 ℃变性10 s,60 ℃退火延伸1 min,40个循环。每个试验设3个生物学重复,以GAPDH为内参基因,采用2-ΔΔCt方法计算基因的相对表达水平。
1.2.3 不同感染时期KCs表型分子的相对表达水平 分别分离多房棘球蚴感染1、2和3月的小鼠肝KCs,用qPCR检测M1型巨噬细胞标志分子IFN-γ、IL1β、IL12α、IL18、TNF-α、iNOS、IL6及M2型标志分子IL4、IL10、IL13、TGF-β、Arg1的mRNA水平。同时,用Western blot检测M2型标志分子IL13 和Arg1的表达水平。
1.2.4 circRNA-miRNA-mRNA调控网络分析 将感染2月的小鼠肝KCs进行RNA高通量测序分析,筛选出与M2型巨噬细胞极化相关的部分差异表达的circRNA、miRNA和mRNA,结合Target Scan在线软件预测基因靶向结合位点,利用Cytoscape2.0软件构建相关ceRNA调控网络,并利用qPCR验证部分基因的转录水平。
1.2.5 miR-466c-5p抑制circ_0000372和IL13的表达 分离正常小鼠的KCs,用人工合成的miR-466c-5p模拟物(mimics)转染KCs,利用qPCR分析miR-466c-5p过表达对circ_0000372和IL13的转录水平的影响,进一步验证上述构建的ceRNA调控网络关系。
2 结 果
2.1 小鼠KCs的纯度鉴定
qPCR结果显示(图1),KCs表面标志分子F4/80的表达水平显着高于HSCs的标志分子Col1a1、Col3a1、a-SMA及GFAP的mRNA表达水平(P<0.000 1),说明分离的KCs纯度较好。
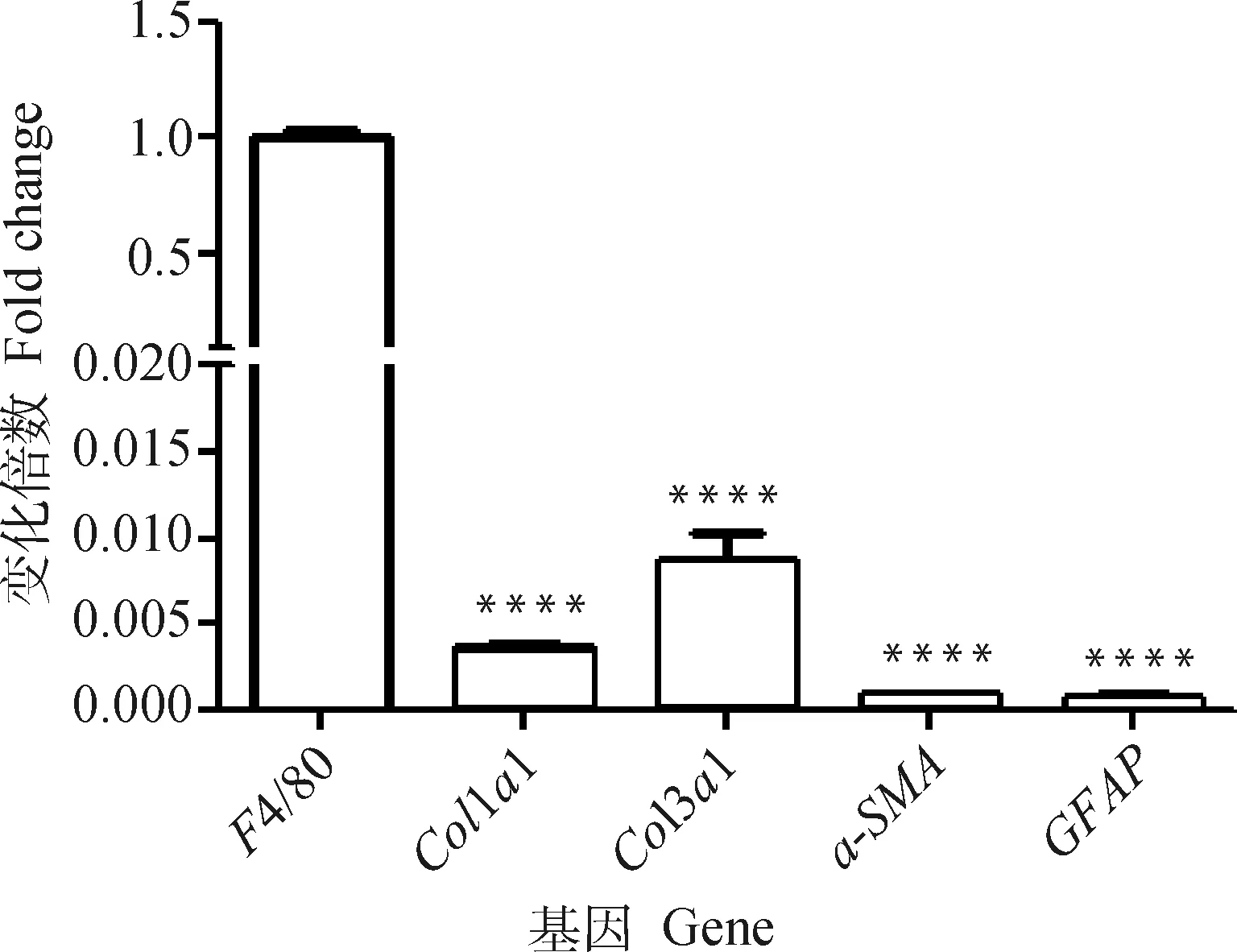
****. P<0.000 1图1 KCs纯度检测Fig.1 Detection of KCs purity
2.2 小鼠KCs表型标志分子检测
qPCR检测发现(图2),感染1月时,M1型标志分子IL1β和TNF-α极显着上调(P<0.001),M2型标志分子IL10和IL13极显着上调(P<0.000 1)(图2A);感染2和3月时M1型标志分子均显着(P<0.05)或极显着(P<0.001)下调,而M2型标志分子的转录和蛋白表达水平均显着上调(P<0.01)(图2B、C,图3)。说明多房棘球蚴感染先诱导KCs产生M1型和M2型混合型极化,而后逐渐转变为以M2型巨噬细胞为主的极化,产生抗炎因子Arg1和IL13等。
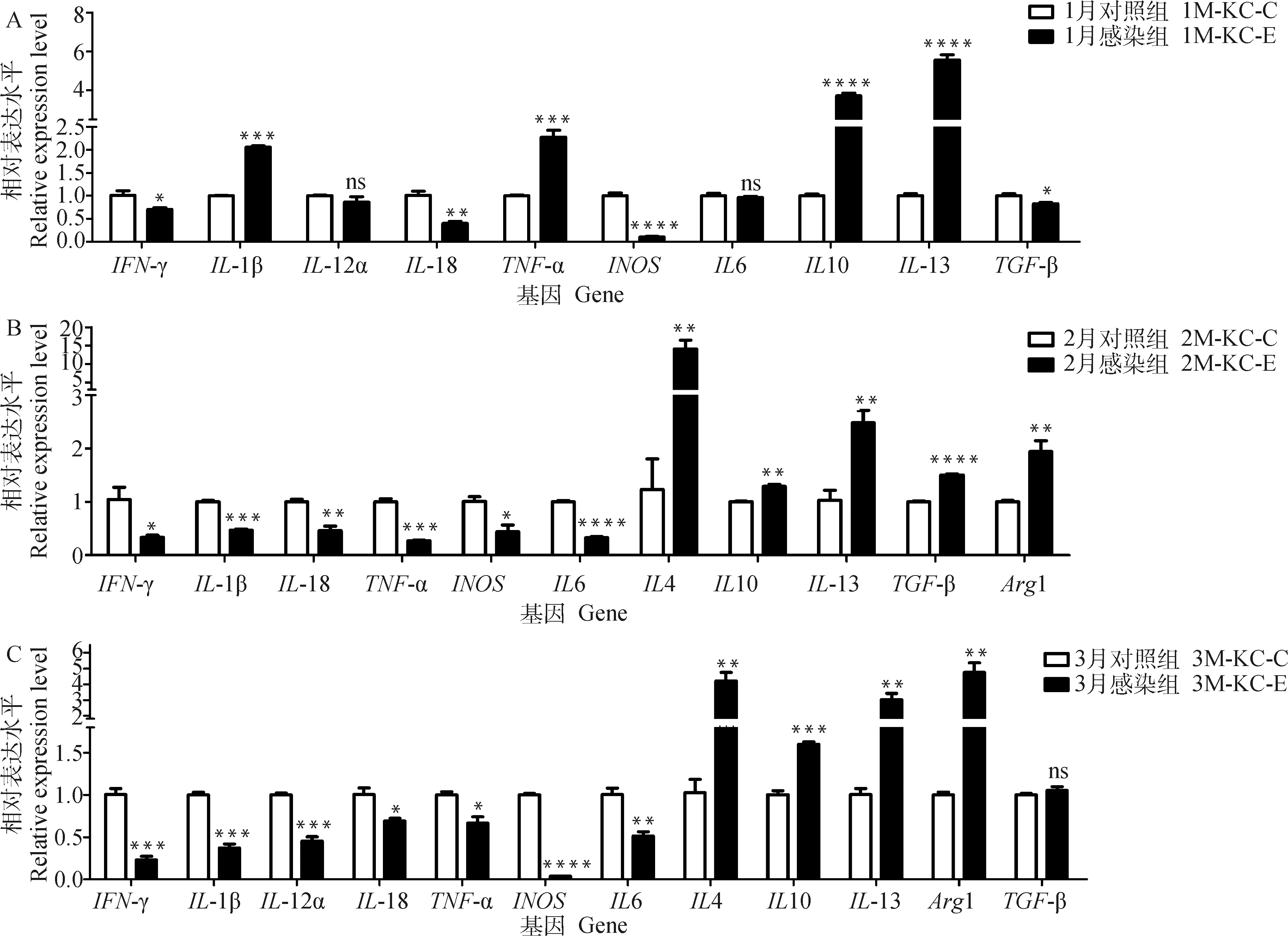
*. P<0.05,**. P<0.01,***. P<0.001, ****. P<0.000 1, ns. P>0.05图2 多房棘球蚴不同感染时期KCs表型标志分子的相对表达水平Fig.2 Relative expression levels of phenotypic markers in KCs at different stages of E. multilocularis
2.3 ceRNA调节网络分析
根据RNA高通量测序分析,筛选出与多房棘球蚴感染相关的M2型标志分子IL10、IL13及Arg1呈显着正相关的circRNAs,然后预测与IL10、IL13及Arg1具有负调控关系的miRNA,构建出由5个circRNA、9个miRNA及3个mRNA(IL10、IL13和Arg1)组成的12对circRNA-miRNA-mRNA调控网络关系(图4)。
2.4 qPCR验证网络关系
为了验证构建的ceRNA调控网络关系,对网络图中的部分非编码RNA和mRNA的转录水平进行了qPCR检测(图5)。结果显示,circ_0000372、circ-0001571及circ-0001684在多房棘球蚴感染2月的小鼠KCs中均显着上调表达(P<0.05),而miR-449a-5p、miR-142a-5p、miR-182-5p、miR-466c-5p均呈显着下调表达(P<0.05),其靶基因IL10、IL13及Arg1均显着上调表达(P<0.01)。circRNA、miRNA及mRNA的表达趋势与测序结果及它们间的调节关系基本一致。
2.5 circ_0000372-miR466c-5p-IL13调控关系
以circ_0000372-miR466c-5p-IL13调控轴为例进一步验证ceRNA调控网络关系。qPCR检测发现(图6),在KCs中过表达miR466c-5p后,circ_0000372及IL13的表达水平均显着下调(P<0.01)。结果说明circ_0000372、miR-466c-5p及IL13之间可能存在靶向调控关系。
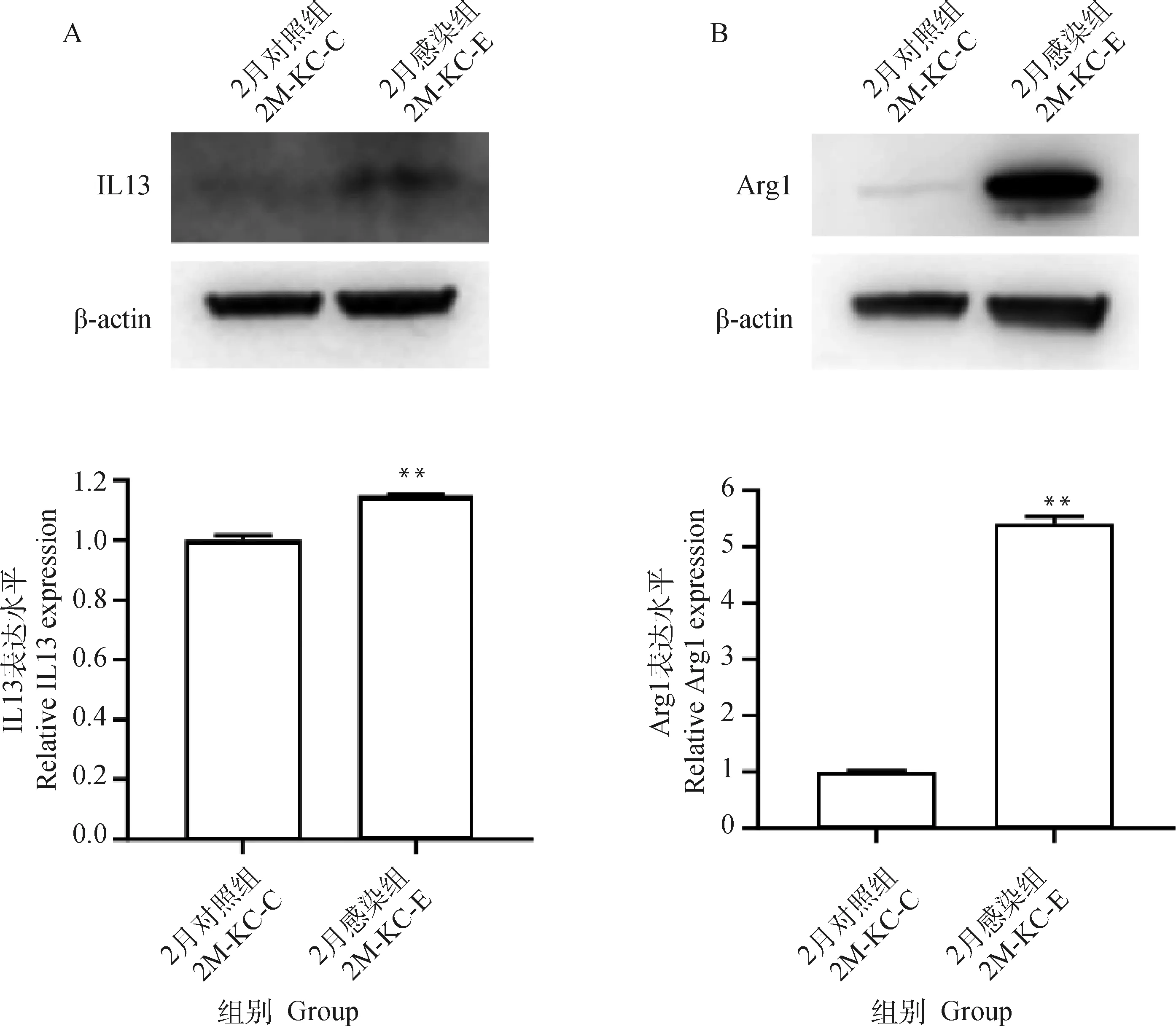
**. P<0.01图3 多房棘球蚴感染2月的KCs M2型标志分子的表达水平Fig.3 Expression level of KCs M2 marker molecule in 2 months infected with E. multilocularis
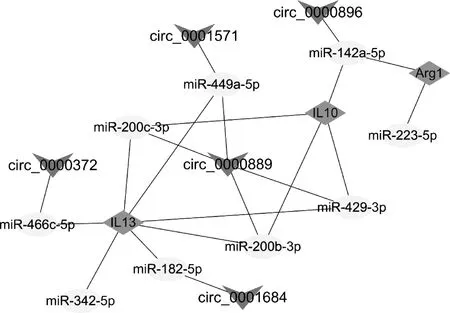
图4 与KCs M2型极化相关的ceRNA调控网络Fig.4 Construction of ceRNA network related with M2 polarization of KCs
3 讨 论
AE于1965年在我国新疆首次被报道[32],随后,在甘肃、宁夏、西藏、青海、四川等地陆续出现病例[33-37],严重威胁牧民的生命健康以及畜牧业的发展。AE在临床上有“虫癌”之称,虫体浸润性生长压迫肝及周围器官,阻塞肝门静脉引起肝功能障碍、肝硬化、继发胆管炎,并可通过血液循环转移至其他器官组织[38]。多数寄生虫为了达到长期生存的目的,进化出了多种逃避宿主免疫应答的策略,一方面是改变其表面抗原从而逃避宿主免疫系统的识别,另一方面,分泌一些活性物质,调节宿主的免疫应答。有研究报道,多房棘球蚴感染能诱导宿主淋巴细胞和树突状细胞(DC)凋亡[39-40],并可上调BALB/c小鼠肝中抗凋亡相关因子的表达水平,有利于虫体在宿主体内的发育和存活[41]。此外,多房棘球蚴感染诱导宿主Th1/Th2失衡也是其逃避宿主免疫应答的主要手段。目前大多数研究认为,棘球蚴感染早期宿主为了清除虫体感染主要产生Th1型免疫应答,但随着棘球蚴的生长和转移,机体的免疫应答逐渐向Th2型转化[42]。KCs是肝常驻巨噬细胞,肝炎症受促炎的M1型KCs和抗炎的M2型KCs的平衡调节。有研究发现,AE晚期的KCs中抗炎细胞因子的转录水平和蛋白质水平均高于促炎细胞因子,而且KCs能分泌大量TGF-β1,激活HSCs,进一步促进肝纤维化[43]。本研究通过qPCR检测发现,多房棘球蚴感染小鼠1月时KCs中M1表型标志分子IL1β、TNF-α显着上调,在感染后2和3月时M1型标志分子均显着下调,而M2型标志分子却显着上调,说明多房棘球蚴感染后期诱导KCs向M2型极化,这一结果进一步验证了先前的报道。
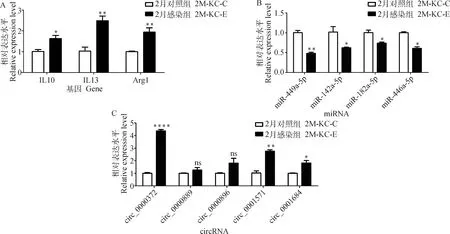
*. P<0.05,**. P<0.01, ***. P<0.000 1, ns. P>0.05图5 qPCR验证ceRNA网络Fig.5 CeRNA network verified by qPCR
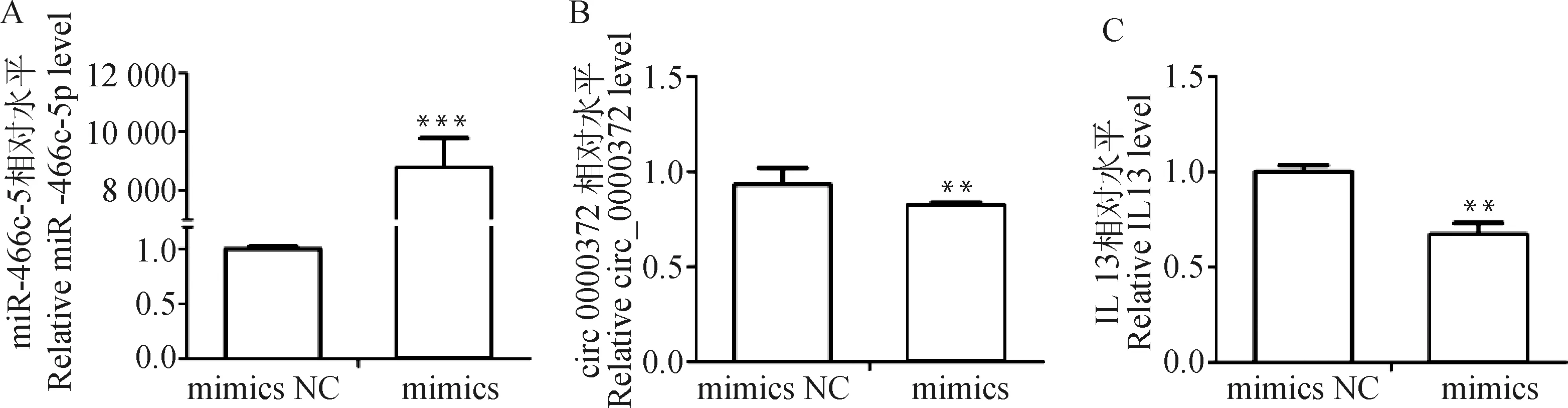
**. P<0.01,***. P<0.001图6 circ_0000372-miR466c-5p-IL13调控轴验证Fig.6 Verification of circ_0000372-miR466c-5p-IL13 axis
miRNA参与巨噬细胞的极化,而且与巨噬细胞的极化相关的miRNAs具有治疗炎症相关疾病的潜力[44]。既然miRNAs 与多房棘球蚴感染引起的巨噬细胞极化有关,而circRNA又能竞争性与miRNAs的靶基因结合,那么circRNA也可能参与多房棘球蚴诱导的巨噬细胞极化。Li等[45]发现食管鳞状细胞癌中circRNA ciRS-7显着上调,而miR-7却显着下调,说明ciRS-7可能通过竞争性结合miR-7,消除miR-7的肿瘤抑制作用。推测ciRS-7可作为预测疾病预后的生物标志物和食管鳞状细胞癌患者的潜在治疗靶点。Liu等[46]用小鼠异种移植模型探索了circ_0000372对直肠癌体内生长的影响,发现circ_0000372通过结合miR-495而上调了IL6的表达,可能参与JAK2/STAT3信号通路的激活,而当干扰circ_0000372时,则显着抑制了体外直肠癌细胞增殖、迁移和侵袭及体内肿瘤的生长。说明circ_0000372-miR-495-IL6调控轴在直肠癌进程中发挥关键作用。本研究发现,多房棘球蚴感染小鼠后2月时circ_0000372的转录水平显着上调,而miR-466c-5p的水平显着下调,同时miR-466c-5p的靶基因IL13的表达显着上调。推测circ_0000372-miR-466c-5p-IL13轴可能参与了M2型巨噬细胞极化过程。为了验证这种调控关系,将miR-466c-5p在KCs中过表达,发现circ_0000372和IL13均被显着下调,说明多房棘球蚴感染可诱导circ_0000372的显着上调,从而竞争性与miR-466c-5p结合,引起miR-466c-5p的水平下调,最终导致其靶基因IL13的表达水平上调。此外,从构建的ceRNA网络图中,验证了circ_0001684-miR-182-5p-IL13轴、circ_0001571-miR-449a-5p-IL13轴、circ_000896-miR-142-5p-IL10/Arg1轴上基因的表达趋势均与预期的一致。推测这些ceRNAs对mRNA的调控网络关系可能在多房棘球蚴感染诱导宿主M2型巨噬细胞极化过程中均发挥一定的作用。上述研究结果充分表明,多个circRNAs和miRNAs参与了多房棘球蚴感染诱导的巨噬细胞极化,而且同一个mRNA的表达水平,可能受多个ncRNAs的调节,形成了复杂的circRNA-miRNA-mRNA网络调控关系。因此,下一步将对该网络关系进行深入研究,为揭示ncRNAs在多房棘球蚴持续感染中所发挥的调节作用提供更多的理论依据。
4 结 论
多房棘球蚴感染BALB/c小鼠后,其肝KCs由抗炎的M1型逐渐向抑炎的M2型极化,这一过程受一些circRNA和miRNA调控,并与之靶基因形成了复杂的ceRNA调控网络,其中,circ_0000372-miR-466c-5p-IL13调控轴可能发挥了重要作用。提示ceRNA调控网络在多房棘球蚴感染诱导的巨噬细胞极化中发挥重要作用。



