王佳丽,周 宁,陈 曦,岳 华,汤 承
(西南民族大学畜牧兽医学院,成都 610041)
犬腺病毒(canine adenovirs, CAV)属于腺病毒科哺乳动物腺病毒属,是一种无囊膜、线状的双链DNA病毒,具有两种血清型:I型(CAV-1)、II型(CAV-2)[1]。CAV-1主要引起犬传染性肝炎、狐狸脑炎;而CAV-2主要引起犬传染性气管支气管炎,临床表现为高热、流涕、咳嗽等[2],还可能与致死性腹泻病相关[3]。除了感染犬以外,CAV-2还有感染浣熊[4]、棕熊[5]、红狐[6]以及狼[7]等野生动物的报道。1962年,Dithfield等[8]从呼吸道病犬首次分离出CAV-2毒株;1988年,Macartney等[3]从犬腹泻样本中分离出CAV-2,证实了可在犬的消化道中增殖;2009年,张洋等[9]首次从犬子宫上皮组织中分离出CAV-2,表明了该病毒有多种组织嗜性。据报道,CAV-2与犬呼吸道冠状病毒、犬副流感病毒、犬瘟热病毒等病毒存在混合感染[10]。
当前,GenBank中仅有3条CAV-2全基因组,分别来源于美国、加拿大、日本,基因组全长约31 000 bp。该病毒衣壳蛋白主要由Fiber、Hexon和Penton组成,Fiber由凸起、轴、尾三部分构成,可介导病毒与宿主细胞受体间融合,在感染过程中起到关键作用[11];Hexon含量最多,是决定腺病毒抗原性的主要蛋白;Penton主要发挥内化作用[12],并对病毒存活功能稳定性有着重要作用。E3基因属于早期转录基因,主要编码免疫调节蛋白[13],具有免疫抑制的作用[14]。此外,E3基因是CAV-2分子检测的靶基因[15]。
目前国内关于CAV-2的病原流行病学资料不多。薛林杰[16]对河南省2018—2020年采集的1 410份犬粪便样本进行CAV-2检测,结果显示阳性率为2.48%;张发明等[17]对成都地区2016—2017年出现呼吸道症状的78份犬鼻拭子以及消化道症状的213份犬肛门拭子进行CAV-2检测,结果显示鼻拭子检出率为17.95%,粪便样本检出率为15.96%;冀君(Ji)等[18]对河南、湖北、江苏三省2017—2019年的224份犬腹泻样本进行CAV-2检测,阳性率为8.5%。上述资料显示不同地方CAV-2在犬中的流行率差异较大,但未见关于国内CAV-2基因组研究的报道,其分子特征和遗传演化仍待调查。本研究的目的是对川渝部分地区CAV-2的流行情况进行调查,并对流行毒株的基因组及生物学特性进行探究。
1 材料与方法
1.1 材料
1.1.1 主要试剂 MDCK细胞由本实验室保存;DMEM培养基、DNA提取试剂盒购自Aidlab Biotech 北京有限公司;PCR PremisTaq酶购自南京诺唯赞有限公司;胎牛血清购自武汉普诺赛生物;Alexa Fluor 488 山羊抗兔 IgG、DAPI封片液购自Abbkine公司;大肠杆菌感受态细胞、pMD19-T 克隆载体购自宝生物工程(大连)有限公司;兔抗CAV-2高免血清由本实验室保存。
1.1.2 样本来源 2021—2022年,从重庆、成都、西昌7个宠物医院,共采集121份患呼吸道疾病的犬鼻咽拭子,其中重庆30份、成都43份、西昌48份。
1.2 DNA的提取
将样本拭子放入2 mL离心管中,加入适量含有1%双抗的PBS溶液,振荡涡旋混匀以后置于4 ℃,7 000 r·min-1离心10 min后吸取200 μL上清液,采用DNA提取试剂盒提取病毒DNA。
1.3 检测CAV-2的PCR方法
选取CAV-2参考毒株U77082的E3基因作为靶基因,使用Primer5设计一对CAV-2特异性检测引物,F:5′-CCTCAACGAGATGCCTCTTCCCA-3′;R:5′-CATGGGCCTGATTTTGTTGTTT-3′,目的片段736 bp。PCR扩增体系配比:2×PCR PremixTaq12.5 μL,ddH2O 8.5 μL,上、下游引物各1 μL,模板DNA 2 μL;反应程序:94 ℃预变性5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸70 s,35个循环;72 ℃终末延伸7 min。反应结束后,取PCR产物用1.5%琼脂糖凝胶电泳(120 V,25 min)进行鉴定。所有阳性样本的PCR产物纯化后连接到pMD19-T载体上,再转化到大肠杆菌感受态细胞中,阳性质粒送往北京擎科生物有限公司测序及分析。
1.4 病毒的分离
选取3份CAV-2阳性样本,将其上清用0.45 μm的滤器过滤处理后,吸取200 μL上清液接种于长成单层MDCK细胞的六孔板上;同时设置阴性对照,接种等量的DMEM培养基;分离的病毒液经噬斑纯化3次后,进行病毒的鉴定及TCID50的测定。
1.5 病毒的鉴定
1.5.1 PCR鉴定 吸取200 μL纯化后的病毒液提取DNA,采用“1.3”中的方法进行CAV-2检测。
1.5.2 间接免疫荧光试验 病毒液接毒48 h后,弃去培养液,使用PBS清洗三次后,加入冰丙酮放入4 ℃冰箱固定10 min,弃去丙酮使用PBS清洗后,加入5%的BSA溶液放入37 ℃培养箱封闭30 min,弃去BSA溶液后,将兔抗CAV-2血清作为一抗(1∶500稀释),FITC标记山羊抗兔IgG为二抗(1∶3 000稀释),进行免疫荧光,同时设置未接毒的细胞进行同步操作,作为阴性对照。
1.5.3 电镜观察 收集纯化后的病毒液,10 000 r·min-1离心5 min,取上清送往成都里来生物有限公司进行透射电镜制样、观察,观察病毒形态及拍照。
1.6 E3基因自然缺失分离株对幼犬致病性
自某养殖场购买6只1月龄中华田园犬,未接种疫苗、已驱虫,经检测犬细小病毒、犬冠状病毒、犬副流感、犬瘟热、CAV-2均为阴性,将幼犬平均分为2组,一组经口鼻接种2 mL病毒滴度为10-9.46TCID50·0.1 mL-1的分离毒株病毒液;另一组接种等量的DMEM培养基;详细记录幼犬每日体温以及临床表现,每日采集鼻咽拭子与肛门拭子,采用荧光PCR方法[19]检测排毒情况。
1.7 分离株基因组扩增与拼接
根据GenBank中CAV-2全基因参考序列U77082,使用Primer 5设计18对基因组扩增引物,用于扩增分离毒株的全基因,相关引物信息见表1。获得的PCR的产物纯化后连接到pMD19-T载体上,转化到大肠杆菌感受态细胞后,挑取单个菌落送往北京擎科生物公司进行测序,最后使用Seqman软件将所有测序结果拼接,获得分离毒株全基因组序列。
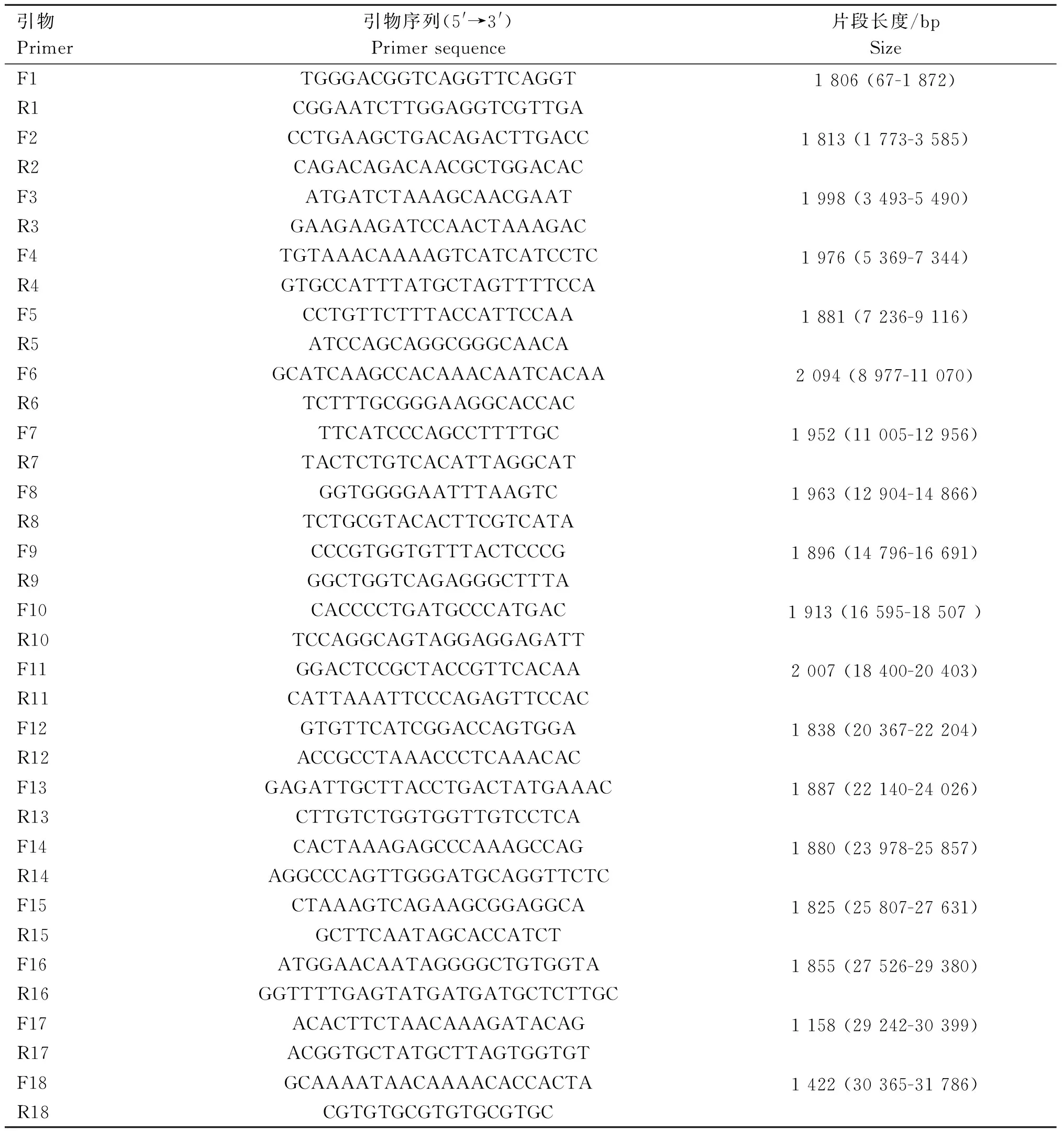
表1 CAV-2全基因扩增引物Table 1 Primers are used to amplify whole gene of CAV-2
1.8 分离毒株的序列分析
将本研究获得的CAV-2全基因、E3基因、Fiber基因、Hexon基因、Penton基因运用MEGA7软件分别与其对应参考序列的核苷酸及氨基酸进行多重比对,并采用最大似然法建立CAV-2全基因、E3基因遗传进化树,进行系统发育分析。采用RDP4.39软件对本研究获得的CAV-2全基因组进行重组分析。
2 结 果
2.1 CAV-2的检测结果
121份样本中,36份检测为CAV-2,阳性率为29.8%,测序结果进一步证实了检测结果的准确性。其中成都地区阳性率为27.8%、西昌地区阳性率为35.4%、重庆地区阳性率为23.3%,表明CAV-2已在上述地区流行,详见表2。值得注意的是,36份CAV-2阳性样本中,有25个毒株的E3基因存在同样的9个核苷酸的连续缺失(1 035~1 043 nt),导致4个氨基酸的缺失(345~348 aa)。
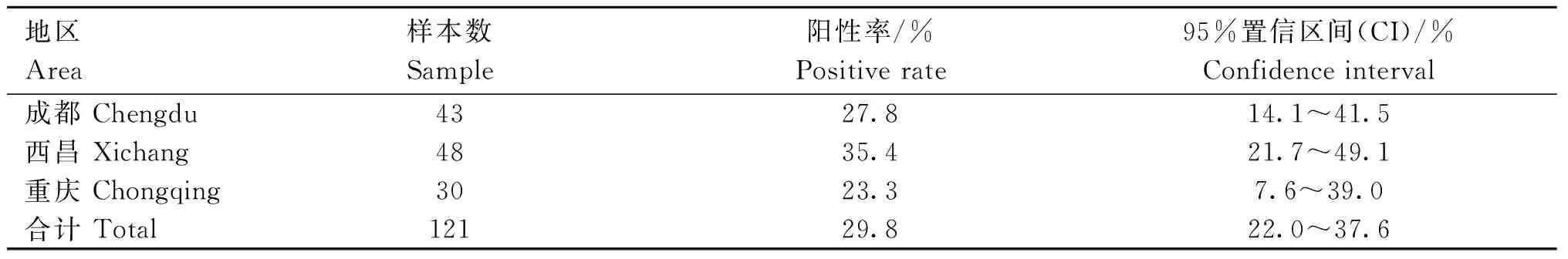
表2 CAV-2检测结果Table 2 The results of detecting CAV-2
2.2 E3基因片段的进化分析
选取GenBank中全部45条CAV-2E3基因片段和本研究获得的36条长度为736 bp的E3基因片段(GenBank登录号:OP018862~OP018896),采用最大似然法建立进化树,结果显示:本研究所获得的36条E3基因序列共分为两大支,其中11条序列与GenBank中现有CAV-2毒株序列聚为一大支,另25条E3基因部分缺失毒株序列则独立聚为一大支,详见图1。
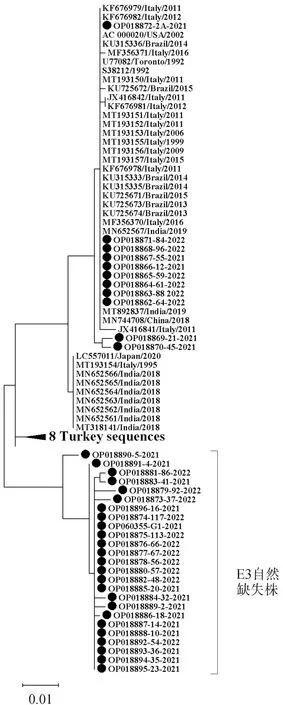
● .本研究获得序列●. Sequences obtained in this study图1 CAV-2 E3基因核苷酸序列进化树Fig.1 Evolutionary tree of CAV-2 E3 gene nucleotide sequence
2.3 病毒的分离与鉴定
样本上清液接种于MDCK细胞,盲传3代以后,其中1份出现了细胞病变,连续传递至第5代后,细胞培养物在48 h左右出现稳定病变,表现为细胞圆缩、聚集呈典型的葡萄串状病毒,如图2B。经测定,该分离株纯化后细胞半数感染值为10-9.46TCID50·0.1 mL-1。
经PCR和间接免疫荧光试验及电镜鉴定该分离株为CAV-2 。间接免疫荧光试验结果显示接毒的细胞胞浆内可见特异性的绿色荧光(图2C);电镜下可见排列整齐、无囊膜、大小约80 nm的典型腺病毒样粒子(图2D)。
综上,本研究成功分离出一株CAV-2E3基因自然缺失株,命名为G1/China/CAV-2。
2.4 G1/China/CAV-2株对幼犬致病性
2.4.1 临床表现 G1/China/CAV-2株经口鼻感染幼犬3 d后,3只幼犬均出现体温增高、流鼻涕、打喷嚏的临床症状,体温变化详见图3A;有2只第5天出现咳嗽的症状。第7天后感染犬临床症状逐渐减轻,第9天恢复正常。阴性组3只幼犬体温、临床表现正常。

A .试验犬体温;B.试验犬排毒情况A. Temperature detection of puppies; B. Detoxification of the puppies图3 G1/China/CAV-2攻毒后幼犬的体温和排毒情况Fig.3 Temperature changes and detoxification of the puppies post challenge
2.4.2 排毒情况 攻毒组幼犬在感染后第2天开始排毒,鼻咽拭子、粪便同时检测到病毒的排出;鼻咽排毒量在第5天达到高峰,第11天结束;粪便排毒第4天达到高峰,第8天排毒结束。排毒情况详见图3B。
2.5 G1/China/CAV-2株基因组分析
2.5.1 G1/China/CAV-2完整基因组特征 本研究成功获得G1/China/CAV-2株完整基因组(GenBank登录号:OP060355),与GenBank中全部3条CAV-2全基因组核苷酸相似性为98.8%~98.9%。与已知CAV-2全基因组相比,本研究分离毒株除了在E3基因第1 035~1 043 nt缺失外,在基因组5′端第341 nt有一个碱基G插入、E1A基因上第531~542 nt缺失、DNA polymerase上第4 034~4 036 nt缺失、基因组5′第28 232 nt处,有一个碱基G插入。与GenBank全部33条Fiber蛋白完整序列相比,G1/China/CAV-2株有2个独特的氨基酸位点突变(F220S、K493R);与GenBank全部35条Hexon蛋白完整序列相比,有1个独特的氨基酸位点突变(A559T);Penton蛋白无独特的氨基酸位点突变,遗传稳定。
选取GenBank中全部3条CAV-2全基因组,以及3条CAV-1和其他物种2型腺病毒全基因序列作为外围毒株,采用最大似然法建立进化树,结果显示G1/China/CAV-2株与CAV-2参考序列聚为一大支,但单独聚为一小分支,见图4。经RDP4.39软件分析未见重组事件发生。
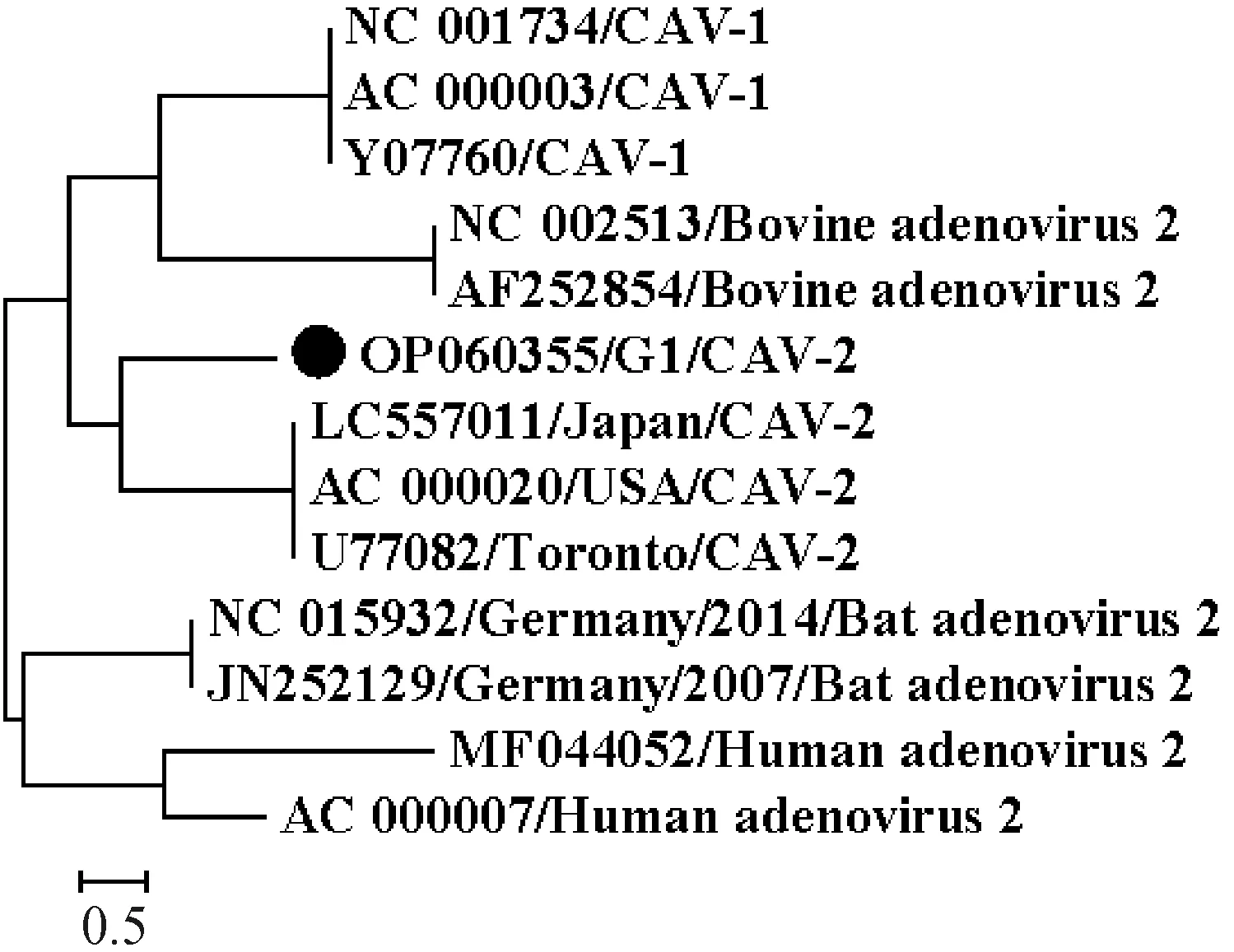
●.本研究所获得的CAV-2基因组●. Complete genome of CAV-2 obtained in this study图4 CAV-2全基因的最大似然法进化树Fig.4 Maximum likelihood evolutionary tree of CAV-2 complete genome
2.5.2 G1/China/CAV-2株E3基因特征 G1/China/CAV-2株的E3基因共1 086 bp,与GenBank中全部3条完整CAV-2E3基因序列核苷酸之间相似性为97.0%~97.4%、氨基酸相似性为95.3%~95.9%。与已知E3基因完整序列比对后发现:G1/China/CAV-2株除了E3蛋白有4个氨基酸连续缺失(345~348 aa)外,还有9个独特的氨基酸位点突变,见表3。基于G1/China/CAV-2株完整E3基因的进化树与基因组进化树一致(结果未展示)。
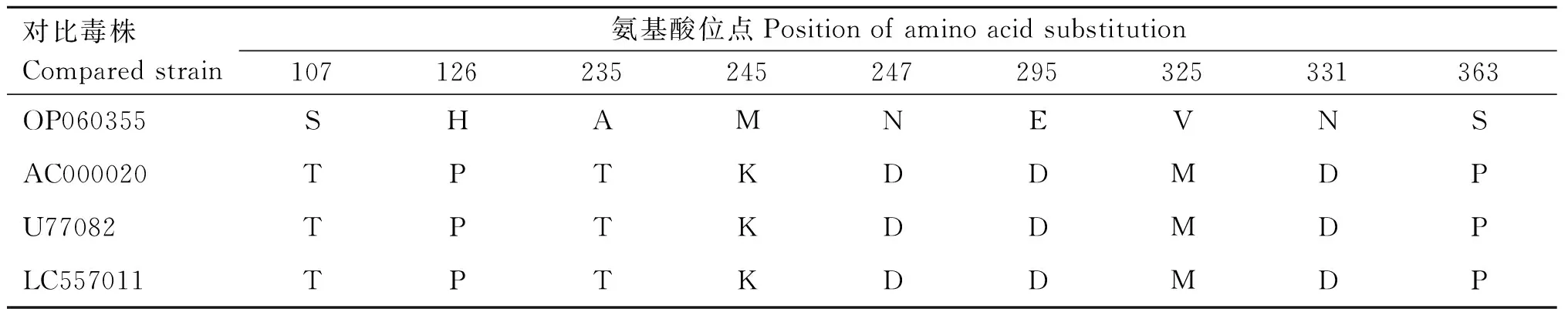
表3 分离毒株G1/China/CAV-2 E3蛋白氨基酸位点突变Table 3 Amino acid site mutation of E3 protein of the isolate G1/China/CAV-2
3 讨 论
犬呼吸道疾病是犬的常见病和多发病,感染性因素是主要原因,常见的病原包括病毒、细菌、支原体等[20];CAV-2是犬重要的呼吸道病毒之一[21],但国内对其研究不多。本研究对2021—2022年川渝部分地区患呼吸道疾病的犬鼻咽拭子进行CAV-2检测的检出率为29.8%,表明CAV-2已在川渝部分地区广泛流行,其与犬呼吸道疾病的关系值得进一步关注。与薛林杰[16]对河南省犬粪便样本的CAV-2检出率为2.48%以及冀君等[18]对河南、湖北、江苏三省犬腹泻样本的CAV-2检出率为8.5%相比,川渝部分地区鼻咽拭子的CAV-2检出率明显更高,可能与地域差异或样本类型有关。本研究成都地区的检出率为27.8%,高于张发明等[17]对成都地区2016—2017年犬鼻拭子的CAV-2检出率(17.75%),提示犬呼吸道样本中CAV-2的流行有上升的趋势,值得进一步关注。
有趣的是,本研究获得的36条E3基因片段中,有25条的E3基因出现9个核苷酸的连续缺失,导致4个氨基酸的缺失(347~349 aa),占阳性样本69.4%,表明E3基因自然缺失株已成为当前川渝部分地区CAV-2优势流行毒株。E3基因序列相对保守,但是近年国外报道了E3基因发生点突变现象[22-23],本研究发现E3基因缺失株,说明当前CAV-2E3基因已经出现变异现象。腺病毒E3基因编码的蛋白可以阻断MHC-Ⅰ类限制性抗原的呈递以减少细胞毒性T细胞对病毒的杀伤作用,以及抑制免疫介质发挥作用,从而使病毒逃避宿主免疫系统攻击[13]。因此,E3基因突变可能会影响其免疫逃避能力,使得病毒粒子更易入侵动物机体,加大了临床防控的难度。本研究E3基因自然缺失毒株有4个氨基酸缺失和9个独特的氨基酸突变,是否会影响该病毒的免疫逃避功能仍需进一步研究。此外,E3基因作为CAV-2检测的靶基因[24],核苷酸突变可能会影响临床检测的准确性,延误动物的疾病诊断与治疗,临床上需要高度关注。
作者成功分离到一株E3基因自然缺失毒株G1/China/CAV-2,该毒株口鼻感染幼犬后引起明显的呼吸道症状,包括打喷嚏、流鼻涕以及咳嗽,未观察到腹泻症状,与其他学者的人工感染结果相似[25-26];也有CAV-2毒株人工感染幼犬后出现腹泻[27-28]或致死[29]的报道,表明CAV-2不同毒株引起的临床症状差异较大。但遗憾的是,所有人工感染试验均无毒株基因组信息的报道,无法分析其症状多样化的分子基础。因此,进一步加强基因组研究对探究CAV-2毒株致病性差异是非常必要的。
本研究成功获得了分离毒株G1/China/CAV-2的基因组序列,这是首次获得中国CAV-2毒株的基因组序列。基于基因组的进化分析显示,G1/China/CAV-2在进化树上单独位于一分支,和已知的CAV-2有明显的遗传距离,显现了独特的遗传进化方式。进一步分析发现该毒株除了E3基因的独特突变外,还在Fiber、Hexon和E1A等蛋白有独特的氨基酸突变,这些氨基酸突变对CAV-2生物学特性的影响还需进一步研究。
4 结 论
本研究对2021—2022年川渝部分地区呼吸道病犬的鼻拭子进行了CAV-2检测,检出率为29.8%,表明CAV-2已在川渝部分地区广泛流行,该病毒与犬呼吸道疾病的关系值得进一步关注。首次发现E3基因自然缺失毒株,且该毒株已成为川渝部分地区优势流行毒株。成功分离出一株E3基因自然缺失毒株,人工感染幼犬后引起典型的呼吸道症状;获得该毒株的完整基因组,这是首次获得中国CAV-2毒株基因组。本研究结果有助于了解CAV-2的流行及遗传进化。



