李春艳,张 彦,吕春荣,邓卫东,权国波*
(1.云南省畜牧兽医科学院,昆明 650224;2.云南农业大学,昆明 650500)
进化上古老的褪黑素分子在自然界中广泛分布,几乎所有生物体均可以形成,具有多种生理和病理作用。最近20年的研究表明,褪黑素通过多种受体介导和受体非依赖的模式发挥功能。褪黑素受体介导模式功能包括睡眠障碍调节、癌症抑制、学习与记忆、脂质与葡萄糖代谢、神经保护、靶向药物使用等[1-3],而受体非依赖模式则与褪黑素清除自由基的能力有关,从而保护关键分子免受氧化应激的影响[4-5]。褪黑素因其多功能性和无毒副作用,日渐成为研究的热点,引起国内外学者的广泛关注。本文综述了褪黑素的生物合成与代谢、抗氧化机制及其在哺乳动物精子冷冻保存中的作用效应,为进一步研究褪黑素在动物细胞体外保存中的应用提供理论参考。
1 褪黑素的生物合成和代谢
褪黑素又名5-甲氧基-N-乙酰色胺,是一种分子量为232.28 g·mol-1的神经内分泌激素,属于色氨酸衍生物[6-7]。早在1958年,美国学者Lerner等[8]首次从牛的松果体中分离获得该物质,并鉴定出它的化学结构,发现其在载黑素细胞中具有抵消α-黑素细胞刺激素(α-MSH)的减轻剂效应。褪黑素长期以来被认为是唯一由松果体释放的。近些年来,随着科学技术进步和研究的逐渐深入,人们发现,动物体的褪黑素主要由松果体以及视网膜产生并释放以协调昼夜节律的睡眠-觉醒周期,保护大脑对抗氧化应激;同时,褪黑素也可以由除松果体及视网膜以外的其他组织合成,如心脏、肝脏、骨髓、胎盘、皮肤、肾脏、肠道等[9],通过自分泌和旁分泌的方式发挥作用。褪黑素因其体积小,具有水溶性和脂溶(亲脂)性,容易跨越多种细胞的质膜,分布于细胞质、细胞核、线粒体、血液以及其他液体(如脑脊液、滤泡液和精液)中,以受体介导或者受体非依赖的方式参与生物机体生理过程和身体内稳态的调节,其在动物体的水平通常维持在5~200 pg·mL-1之间[10-11]。
1.1 褪黑素的生物合成
生物机体的褪黑素是由必需氨基酸—色氨酸经过多个化学反应步骤合成的。在脊椎动物中,L-色氨酸经色氨酸5-羟化酶(TPH)催化后,形成5-羟基色氨酸;5-羟基色氨酸再经芳香族氨基酸脱羧酶(AAD)作用,形成血清素(又称5-羟色胺);接着,血清素经由芳基烷基胺N-乙酰转移酶(AANAT)限速酶或者其他酶催化的乙酰化作用,形成N-乙酰血清素(NAS);最后,NAS通过羟基吲哚O-甲基转移酶(HIOMT)转化,生成褪黑素(图1)[12-15]。

图1 脊椎动物中褪黑素的生物合成示意图[13]Fig.1 Schematic representation of melatonin biosynthesis in vertebrates[13]
1.2 褪黑素代谢及其生理途径
褪黑素能通过多种途径代谢,产生一系列具有抗氧化特性的代谢物,与褪黑素一起构成褪黑素抗氧化级联(图2)[16]。例如,褪黑素通过选择性吲哚途径的代谢:首先,褪黑素经过芳基酰胺酶去乙酰基,形成血清素;血清素进一步被单胺氧化酶A脱氨。另外,褪黑素也可以通过犬尿酸途径代谢,该代谢途径起始于过氧化物酶反应中N1-乙酰-N2-甲酰-5-甲氧基犬尿胺(AFMK)的形成,AFMK进一步被去甲酰化,生成N1-乙酰-5-甲氧基犬尿胺(AMK)。在线粒体中,褪黑素可以通过细胞色素C氧化代谢,形成AFMK[17-18];在皮肤细胞中,褪黑素通过6-羟基化、犬尿酸途径、非酶过程(包括由UVB、UVA诱导的光转化、活性氧(ROS))快速代谢,代谢产物包括6-羟基褪黑素、AFMK、AMK、5-甲氧基色胺、5-甲氧基色醇和2-氢氧基褪黑素[19];在肝脏和脾脏中,褪黑素则主要通过P450单氧酶代谢[20]。
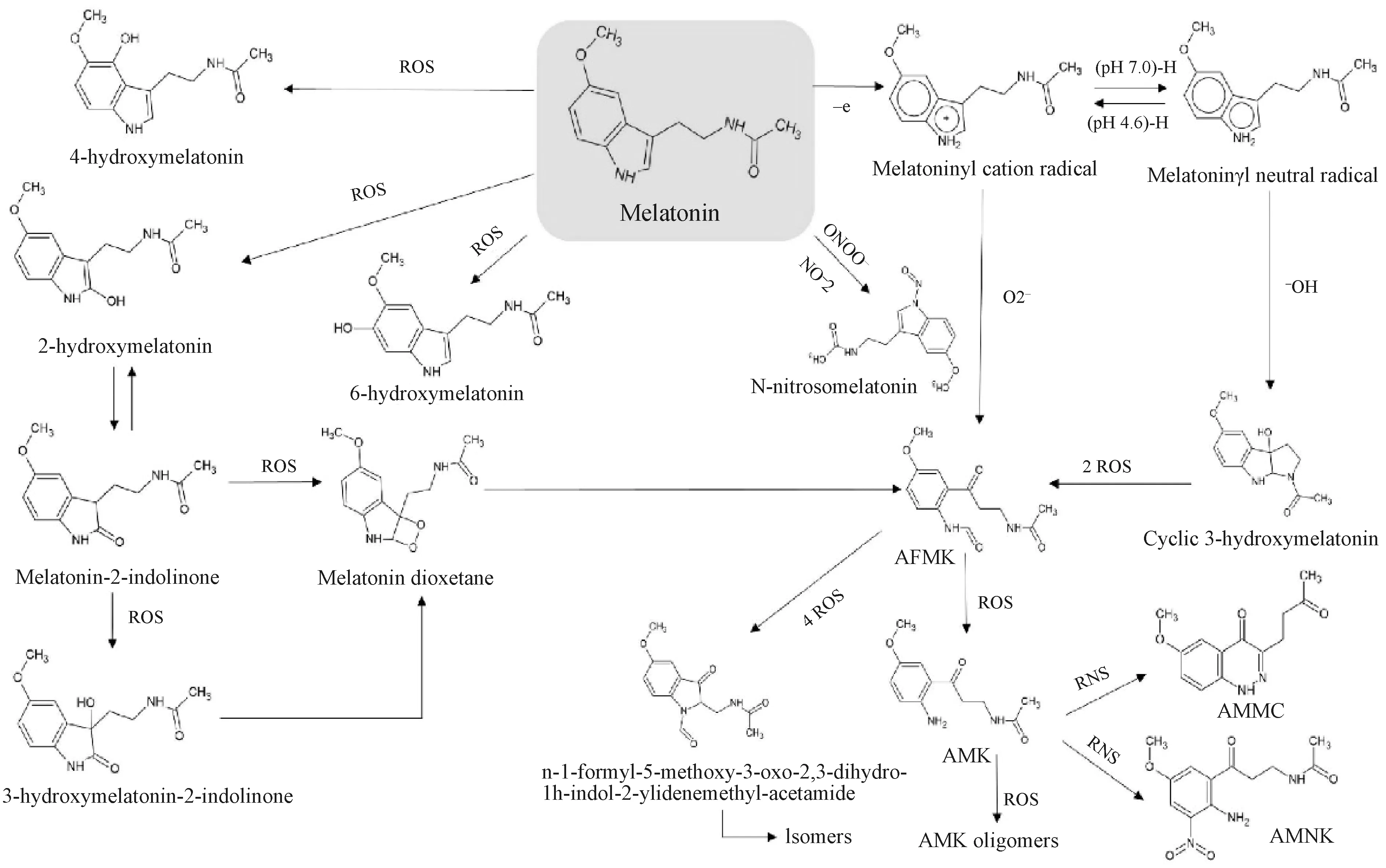
图2 褪黑素代谢及其相关代谢物[16]Fig.2 Melatonin metabolism and its related metabolites[16]
褪黑素代谢途径的多样性决定其生理作用多样性。目前的研究表明,生物机体褪黑素主要通过膜、胞质及核受体介导途径和受体非依赖途径来发挥作用[15]。其中,受体介导途径以两种类型的膜特异性受体:ML1受体(包括MT1/Mel1a和MT2/Mel1b)和ML2受体(也被称作MT3受体)激活为特征。MT1和MT2是褪黑素高亲和力受体,同源性达60%,此二者的激活导致靶细胞中腺苷酸环化酶被抑制,从而调节警戒状态、睡眠-觉醒节律、骨量、脏器功能和免疫系统调节等[15,21-22]。MT3受体则是一种对褪黑素低亲和力的胞质受体,它已被证明是一种醌还原酶,其主要作用是解毒。褪黑素的第三种受体介导途径涉及核受体-类视黄酮孤儿受体(ROR)或者类视黄酮Z受体(RZR),它们可能在免疫和抗氧化酶调节中起作用。褪黑素受体非依赖作用主要包括其可以直接解毒ROS和活性氮(RNS),从而保护细胞功能免受应激损伤[23-24]。
2 褪黑素与氧化应激
2.1 氧化应激损伤
氧化应激即氧化剂和抗氧化剂之间失衡,在这种状态下更有利于氧化剂,导致氧化还原信号中断和分子损伤。根据氧化酶和抗氧化酶及化合物的种类、强度范围差异,氧化应激被分为基础氧化应激、低强度氧化应激、中等强度氧化应激和高强度氧化应激等几种不同的类型[25]。当生物有机体的组织或者细胞中自由基和氧非自由基产生与积累(比如ROS积累、蛋白质氧化、脂质过氧化和DNA损伤)时,容易引起氧化应激,导致氧化还原平衡紊乱[26]。
2.2 褪黑素抗氧化
褪黑素具有天然抗氧化能力,在氧化应激条件下,褪黑素与其代谢物一起,形成抗氧化级联,产生自由基清除物质,直接抵抗高毒性的自由基ROS和RNS。另外,褪黑素还可以通过间接调节内源性抗氧化酶(如CAT、GSH-Px、SOD等)活性以及提高其他抗氧化剂的效率来保护组织和细胞结构,从而抑制氧化损伤[27-28]。褪黑素的自由基猝灭特性使其抵抗羟基(-OH)的能力较GSH强,同时,褪黑素抵抗氢过氧自由基(ROO)的过程涉及单电子转移、氢原转移或自由基加合物形成[29]。除了降低自由基数量,褪黑素也能与非自由基氧化剂如过氧化氢(H2O2)、单态氧(1O2)和过氧亚硝基(HNOO)互作,有效抑制金属(如Cu、Fe、Zn、Lv等)诱导的氧化[28,30]。
2.3 褪黑素维持线粒体氧化还原稳态
褪黑素调节线粒体功能,主要通过清除大部分有毒自由基来加强抗氧化防御系统,保护细胞膜、线粒体和呼吸电子传递链(ETC)免受氧化损伤[31]。细胞外的褪黑素主要依托PEPT1/2寡肽和Glut/SLC2A转运蛋白逆浓度转运进入线粒体,通过多种途径靶向调节线粒体抗氧化:褪黑素直接抑制自由基形成,增强ETC(I、II、III、IV)的效率,促进ATP合成;褪黑素还可以促进线粒体SOD2、GSH和SIRT3等酶的活性,同时,转化生成AFMK,清除高毒性的ROS和RNS,降低氧化应激[32-33]。另外,褪黑素也调节解偶联蛋白UCP2,从而维持线粒体膜潜力(ΔΨ),预防线粒体通透性转换孔(mPTP)开放;同时,褪黑素与其受体MT1、MT2互作,抑制促凋亡蛋白合成以及随后的细胞色素C外泄而引起caspase-3介导的细胞凋亡(图3)。当然,线粒体也可以通过乙酰化途径自合成褪黑素[34-35]。
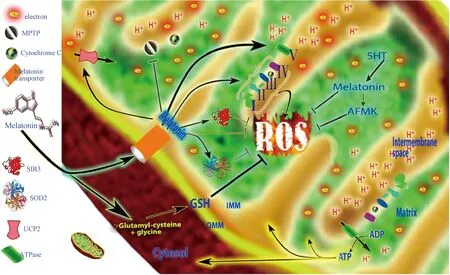
图3 褪黑素的细胞线粒体靶向抗氧化作用机制[35]Fig.3 Mitochondrial targeted antioxidant mechanisms of melatonin[35]
3 褪黑素保护哺乳动物冷冻精子
动物精子在冷冻过程中,由于精细胞本身对低温的超敏感性,加之冷冻保护剂的毒性及其高渗透性,会产生氧化应激,损伤冷冻精子。长期以来,研究人员在冷冻-解冻程序优化和抗冻保护剂筛选的基础上,挖掘各种抗氧化保护剂以提高冷冻精子质量。褪黑素因其自身及其反应产物的安全剂量范围广泛、毒性甚小、能有效抗氧化并清除自由基、保护细胞膜脂质、蛋白质、DNA以及线粒体功能等多种优势特性。它作为理想的抗氧化剂,正在被应用到动物精子的冷冻保存研究中。
3.1 精子冷冻保存的意义和弊端
早在1949年,瑞典学者Polge等[36]冷冻保存动物精子首次获得成功,这个重大发现为动物生育力保存研究和应用奠定了良好基础。目前,成熟精子冷冻保存已经成为一种有效的方法和手段,它可以长期保存雄性生育力、进行胚胎植入前遗传学诊断、转基因系以及濒危物种种质资源保护;同时,精液冷冻保存促进精液远距离分布,有益于世界范围内人工授精和体外受精等生殖技术的发展。
然而,动物精子在冷冻-解冻过程中极易遭受低温胁迫、化学毒性和氧化应激等损伤,使其质量明显下降,严重影响精子的结构、寿命和授精功能[37]。而且,就同一个物种来说,不同雄性个体的精子冷冻耐受性可能因个体、射精质量以及人工收集方法等不同而表现出较大差异。整体上,冷冻保存迫使50%及以上的精子死亡[38]。
3.2 冷冻对精子线粒体和氧化应激的影响
就冷冻精子氧化应激损伤而言,目前的研究发现,氧化应激主要氧化精子轴索并损耗胞内ATP,从而形成4-HNE、MDA等脂质过氧化副产物,破坏精子结构和功能完整性,导致雄性不育[39]。通常,以ROS水平为代表评估冷冻精子氧化应激损伤程度,过量的ROS阻碍精子质膜的流动性和通透性,导致线粒体功能异常[40-41]。冷冻-解冻精子线粒体膜流动性改变表明ΔΨ升高和ROS释放,这些释放的ROS转而造成单链或者双链DNA断裂。多组分蛋白聚集体mPTP在精子线粒体中的双向性功能主要表现为:1)调节氧化磷酸化(OXPHOS),从而合成ATP;2)扮演非特异性的开放通道,释放凋亡诱导因子以及一些促凋亡因子如细胞色素C,使线粒体功能下降,启动细胞死亡。然而,不同物种的精子mPTP开放程度似乎与冷冻损伤有关。例如:人们在种马冻精相关研究中,首次证明了mPTP开放的间接影响,即在冷冻介质中补充mPTP开放的抑制剂米醇菌酸(bongkrekic acid)后,解冻精子中活性半胱天冬酶减少,ΔΨm增加[42];近期,牛冻精相关研究表明,线粒体功能异常是由于胞内Ca2+引起mPTP开放增加,这与ΔΨm损失、ATP含量下降、ROS水平增加和质膜完整性恶化有关[43]。
3.3 褪黑素保护冷冻精子免受氧化应激损伤
基于氧化应激损伤冷冻精子的原因,寻找并实施补救措施显得十分重要,这就需要使用抗氧化剂进行预处理或后处理来改进冷冻保存程序,以提高不育患者或非冷冻耐受动物精子的活率及其生育力。目前,各种抗氧化剂在不同物种精子冷冻-解冻过程中为避免氧化应激损伤的应用已十分广泛[44]。
3.3.1 褪黑素抗冷冻精子氧化具有多效性 褪黑素的多效抗氧化特性决定了其在动物精子冷冻保存中的应用优势。它对冷冻精子的抗氧化效应主要表现为:1)抵消脂质过氧化。褪黑素通过直接清除脂质过氧化早期阶段的自由基尤其是-OH和ONOO-,防止细胞膜流动性异变和膜脂质被自由基氧化以及减少跨膜泄露,从而减少脂质过氧化副产物如4-HNE、MDA等的过度积累[3,45]。2)维护质膜完整性。质膜与顶体保护精细胞内容物与生理过程,当精子受到冷冻刺激时其溶质浓度改变且受稀释剂影响而引起膜完整性破坏,原稳态微环境失衡,氧化应激反应形成过量的ROS,这些ROS干扰蛋白分子结构、脂质以及核酸,引发过氧化链反应和精子形态异常,进一步破坏膜成分[3]。褪黑素的生物学特性决定其可以穿越精细胞膜分布于胞质中,减少脂质过氧化和维持精子结构完整性;褪黑素也可以直接结合膜上的褪黑素受体,调节内源性抗氧化或抗凋亡途径以增强精子功能,尤其是褪黑素与其受体MT1偶联,有效降低精细胞内ROS、MDA浓度,促进维持精子质膜稳定[46]。3)清除自由基。褪黑素可以以电子转移及氢转移模式直接清除自由基(O2-、1O2、OH-、H2O2、HOCl、ONOO-等),刺激内源性抗氧化酶,同时,增强其他抗氧化剂(如SOD、GSH、GPx)活性,减少氧化应激胁迫损伤。当冷冻引起的精子线粒体功能异常时,OXPHOS途径中的O2还原不完全致使ROS过量积累,而ROS诱导的损伤包括脂质过氧化、电离、DNA断裂等,引起蛋白分子失活[47-48];精细胞膜流动性异常引起ΔΨ变化以及ROS(H2O2、NO、O2-等)释放。这些过量的ROS具有毒性,促进氧化应激胁迫,增强脂质过氧化,使精子质量包括活力参数、膜完整性、线粒体活性、存活率等下降,凋亡增强[3]。在降低或者清除这些自由基的过程中,褪黑素可以转化成为具抗氧化特性的代谢物环状3-羟基褪黑素(C3OHM)、AFMK)和AMK)[49]。4)保护线粒体完整及活性。外源性褪黑素借助PETP1/2和Glut/SLC2A进入精子线粒体,增加呼吸链复合体I与IV(OXPHOS)活性,促进ATP合成,抑制线粒体超氧化物产生[50];同时,增强线粒体ΔΨ和细胞色素C浓度,可能通过PI3K-Akt-GSK 3β途径与MT1偶联,从而抑制mPTP开放[51-52]。
3.3.2 褪黑素抗冷冻精子氧化具有剂量依赖性 不同物种动物精子膜的冷冻耐受性及其内源性抗氧化剂活性强弱等差异,导致精子对褪黑素的剂量依赖效应具有差异性。就人的精液冷冻保存研究而言,2017年,Deng等[53]发现,0.1 mmol·L-1褪黑素能显着提高人冻精的活率和质膜完整性,降低精细胞内ROS产生及脂质过氧化损伤;同时,褪黑素能通过受体MT1介导抗冷冻蛋白HSP90翻译并提高ATP水平。另外发现,当用3 mmol·L-1褪黑素预处理和冷冻人精子后,可以显着降低精细胞内ROS水平、caspase-3活性和细胞死亡比例,增强精子活力和AKT磷酸化状态,提示褪黑素可能通过PI3K/AKT信号通路保护冷冻精子的重要作用[54]。然而,在冷冻前的人精液中添加2.0 mmol·L-1褪黑素,同时,解冻后向其中补充2.0 mmol·L-1咖啡因,可以明显提高冷冻精子的运动能力、线粒体ΔΨ,减少DNA碎片化和ROS水平[55]。在家畜精液冷冻保存方面,研究人员发现,1.0 mmol·L-1褪黑素能提高沼泽水牛冷冻精子的活率[56],改善安格斯牛冷冻精子的质膜与线粒体ΔΨ,抑制精细胞内ROS产生[57]。此外,羊精液冷冻保存的研究结果显示,1.0 mmol·L-1褪黑素有效提高萨达奶绵羊冷冻精子的活率、精细胞内ATP浓度和DNA完整性;而且,该冻精体外受精后的总体卵裂率较对照组高[58]。10-7mol·L-1褪黑素则更有利于小尾寒羊冷冻精子的质膜完整性,防止mPTP开放而引起精子死亡[51]。在黄淮肉羊精子冷冻保存研究中,0.5 mmol·L-1褪黑素更有利于精子总抗氧化能力及相关抗氧化酶活性水平,使冻后精子活力提高至66.09%,提高精子相关抗氧化酶(主要是T-AOC、CAT、GSH-Px)及乙酰辅酶A水平,同时,降低脂质过氧化终产物MDA含量[59]。值得注意的是,研究人员开始尝试应用褪黑素结合其他抗氧化剂,研究它们对冷冻保存家畜精液的协同保护作用。例如,褪黑素与辅酶Q10协同应用于马的精液冷冻保存,能有效提高冷冻精子的前向运动能力及线粒体ΔΨ,降低脂质过氧化,预防膜脂分布紊乱[60]。褪黑素与肌醇协同作用时,能有效提高山羊冷冻精子的活力、质膜与顶体完整性,同时,显着降低精细胞内ROS产生、脂质过氧化和DNA损伤[61]。上述系列研究表明,褪黑素对不同哺乳动物的冷冻精子细胞具有积极效应,这为进一步细化褪黑素抗冷冻保护机制以及改进精子冷冻保存研究和服务于生产实践具有重要意义。
4 小结与展望
综上所述,鉴于冷冻-解冻过程对哺乳动物精子细胞结构和功能的不利影响,近年来研究显示褪黑素在不同物种包括人类的冷冻精子保护方面均显示出积极效应。褪黑素作为一种强大的抗氧化剂和自由基清除剂,可保护精子膜完整性与渗透性,减少膜中不饱和脂肪酸发生脂质过氧化,维持精子结构。另外,外源性褪黑素可跨膜进入精子线粒体内,直接清除自由基,降低ROS过剩引发的氧化应激;通过与其受体主要是MT1结合,激活多个信号通路,增强线粒体电子呼吸链复合物I和IV(OXPHOS)活性,从而保证超低温条件下精细胞正常的ATP生成,保持精子活力。目前的研究证明,在冷冻稀释液中添加褪黑素和冷冻精子,可以改善精子的冷冻保存效果,但是对于其冷冻保护作用的本质研究仍然局限于精子结构和功能的表观层面,因此,褪黑素保护动物尤其是家畜精子免受冷冻氧化损伤的作用机制仍需进一步研究。



