吕若一,司晓慧,孙志刚,史晓敏,2*,刘晓晔,2*
(1.北京农学院 兽医学(中医药)北京市重点实验室,北京 102206;2.北京农学院动物科学技术学院,北京 102206)
目前,由细菌引起的猪传染性疾病是我国养猪业面临的巨大挑战。其中,猪链球菌(Streptococcussuis,S.suis)感染会引起猪败血症、淋巴结脓肿、关节炎等症状,此外,S.suis还是一种常见的人畜共患性细菌,感染S.suis的人会患肺炎、脑膜炎以及败血症,严重者并发心内膜炎、纤维炎、预后听力受损等[1-3]。1951年荷兰学者首次报道了S.suis,从那时起S.suis感染的报道逐渐常见于养猪企业以及规模化猪场。最初人们根据S.suis细胞壁荚膜多糖(capsular polysaccharide, CPS)对其进行血清型分型[4],至1987年,S.suis被划分为一个新菌种且已发现10种血清型[5];1998年,16S RNA方法被当作S.suis血清分型的主要方法[6],随后血清型20型、22型、26型、32型和34型因遗传学差异而从S.suis中独立出来[7],迄今为止S.suis已有超过390菌种[8]。
我国规模化猪场中普遍存在S.suis感染情况,目前多采用抗菌药物以及疫苗相结合的方式来进行治疗。但是随着亚致死剂量抗菌药物的不合理使用,对四环素类、大环内酯类、氨基糖苷类等药物耐受的S.suis也逐渐开始流行[9-10];S.suis在抗菌药物存在的情况下会入侵宿主细胞内部,从而直接导致抗菌药物治疗失效,加重其感染与传播风险。目前针对耐药性S.suis的研究尚不透彻,新兴的抗菌药物仍在研发阶段,因此本文旨在归纳总结目前耐药性S.suis的流行情况和新兴的S.suis抗菌药物研究进展,以期对耐药性S.suis的流行进行监测,对下一代抗菌药物的研发提供新思路。
1 猪链球菌病流行情况分析
S.suis在全球规模化猪场中普遍流行。根据近年的数据报道显示,印度[11]、泰国[12]、印度尼西亚[13]、中国[14]、韩国[15]等亚洲国家均有报道S.suis流行,且检出率在20%~50%甚至更高;欧洲各国家猪场中也有报道S.suis流行的情况,瑞典[16]、捷克[17-18]、西班牙[19]等国家猪场中均检出S.suis且部分国家感染率超过90%;美洲国家中,加拿大[20]和美国[21-22]一直以来均有S.suis感染报道(表1),但是南美地区则仅有巴西报道过S.suis的流行情况[23],这说明猪链球菌感染普遍存在于世界各地,但是各个地区的血清流行性并不相同,这与不同地区养殖场的种类、管理以及生物种类都有很大的关系。
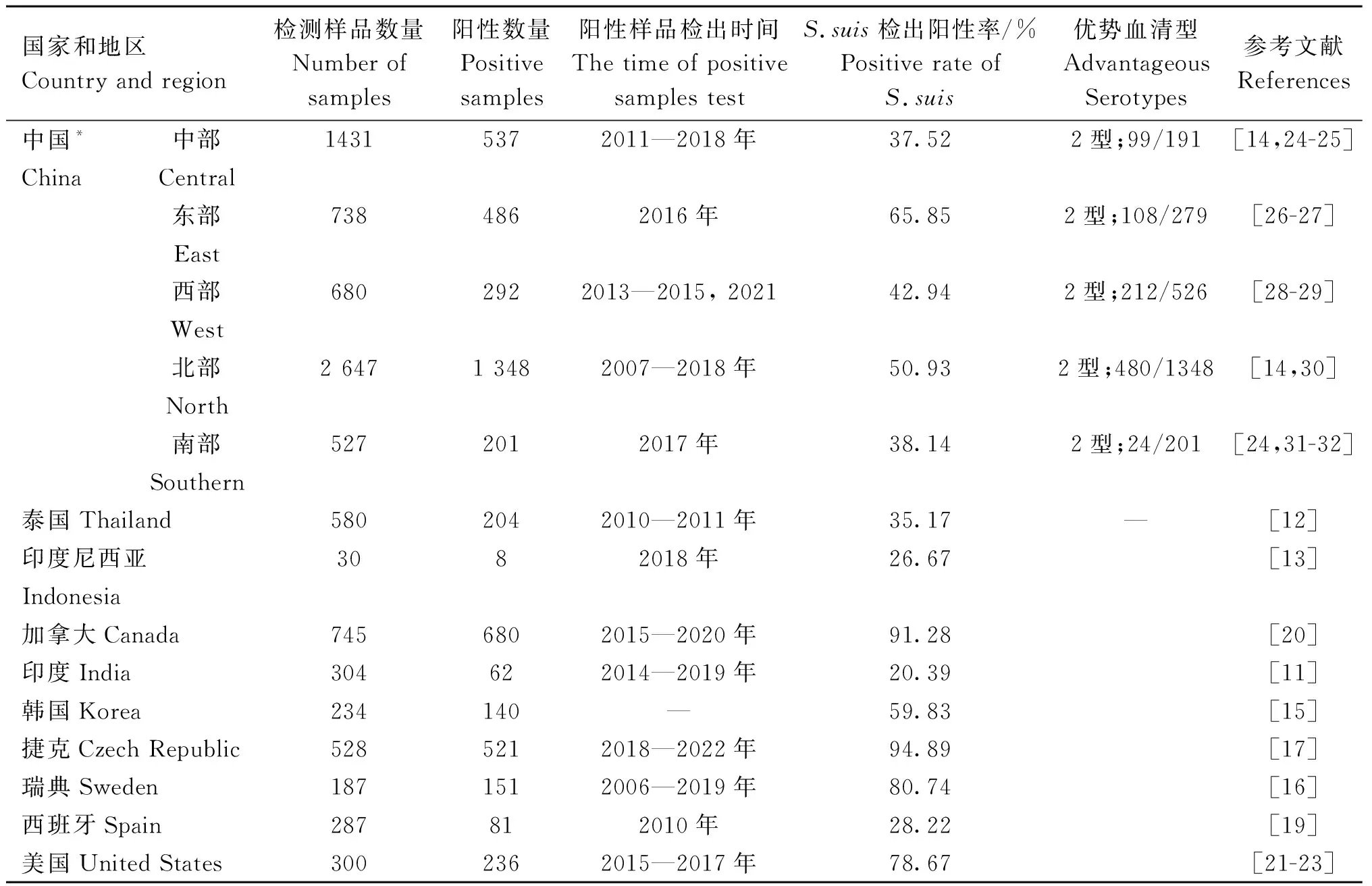
表1 全球部分地区报道的规模化猪场中S. suis感染情况Table 1 The infection of S. suis in the world
我国各地均有感染S.suis的报道,其中东部地区感染率最高,但是我国的普遍流行的菌株类型均为血清2型[14,24-32](表1)。这说明同一国家中流行的菌株类型相似,同一国家之间的猪产品运输以及用药习惯都使得流行性菌株的种类更为相似。
自1998年和2005年我国江苏、四川两省分别暴发了集中性的人感染S.suis的病例以来,我国各地均有散发的人感染S.suis的报道:2007—2018年仍有报道广西感染S.suis的患者[33],在我国的山东省[34-35]、江苏省[36-38]、浙江省[39]、上海市[40]、河北省[41]、广西省[31,42-43]、贵州省[44]均有零星感染S.suis的病例出现,这些病例的共同特点是患病人员均在接触生猪时有伤口接触或是接触生猪后免疫力下降的情况。医院则均采用抗菌药物对患者进行治疗,但是也有患者对于抗菌药物不敏感的报道,这很可能是患者感染了耐药性S.suis所致,所以对耐药性S.suis进行调查研究不仅可以控制养殖场中耐药菌株的流行情况,还可以保障人用抗菌药物的有效性。
2 猪链球菌耐药现状及耐药机制分析
2.1 耐药性猪链球菌全球流行情况
耐药性S.suis的流行发生在世界各地[45],
2010—2019年,西班牙的加泰罗尼亚地区S.suis均对3代头孢菌素、万古霉素和利福平敏感,对青霉素和氟喹诺酮类药物敏感率分别为88.9%和71.4%,并且大多数菌株对红霉素和克林霉素耐药[46];2016—2020年,奥地利猪群的553份猪呼吸道上皮的样品显示S.suis阳性,并且对四环素(66%)、克林霉素(62%)和红霉素(58%)耐药(图1A)[47];2011—2018年,澳大利亚对当地规模化猪场S.suis病原分离物检测发现,菌株普遍存在四环素和红霉素耐药[48];瑞典在2020年对当地规模化猪场病原分离物检测发现,多数S.suis对四环素耐药,少部分菌株对恩诺沙星呈耐药性[49](表2)。S.suis耐药性的产生同不规范使用抗生素有关,丹麦地区首次分离出耐药性S.suis的时间在其批准畜牧业使用抗生素之后[45],巴西[50]、泰国[51]、中国[14]等地区耐药性S.suis的出现也同其使用抗生素作为促生长剂有关。通过对于来自不同国家的耐药性S.suis分析发现,其同源性可以追溯到1830年,且很可能首先出现在西欧地区[52]。
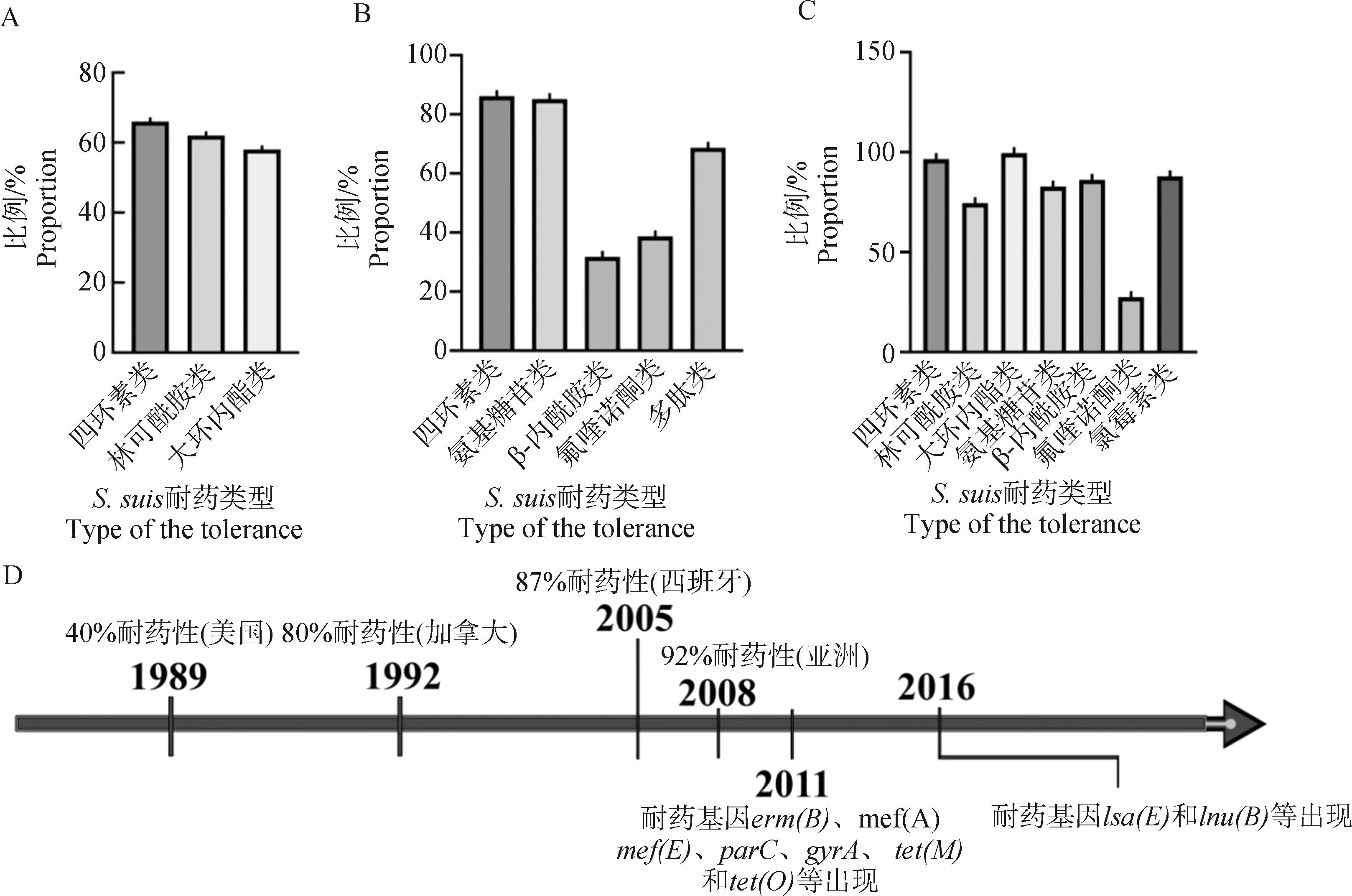
A. 2016—2020年间奥地利猪场的553份样品中各耐药性S. suis比例;B. 2013—2017年间中国16个养猪省份猪场病原分离物中耐药性S. suis耐药种类以及比例;C. 2011—2019年间中国20个省份中分离到的耐药性S. suis耐药种类以及比例; D. 检出S. suis耐药性以及相关耐药基因的菌株遗传进化时间轴[41,57]A. Proportion of each resistant S. suis in 553 samples from Austrian pig farms during 2016-2020; B. Proportion of resistant S. suis in pathogenic isolates from pig farms in 16 pig provinces in China during 2013-2017; C. Proportion of resistant S. suis isolated from 20 provinces in China during 2011-2019[41,57]图1 规模化猪场S. suis耐药性现状以及耐药基因进化轴Fig.1 Resistance of S. suis’s pathogenic isolates from large-scale pig farms
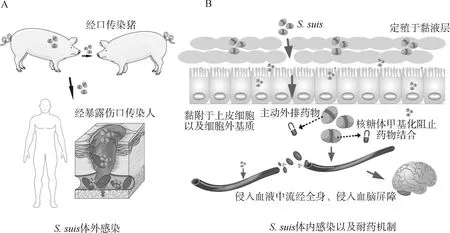
S. suis体外传播时主要通过带病猪经口传播,但也会以气溶胶的形态在空气中生存[42],多数集中在母猪以及保育仔猪阶段[43]。S. suis在感染人的过程中主要通过伤口暴露传播:大多数感染人员有生猪接触[44],但是也存在没有接触史的S. suis感染患者[57]When S. suis is transmitted in vitro, it is mainly transmitted orally through sick pigs, but it can also survive in the air in the form of aerosols[42], most of these are concentrated in sows and nursery piglets[43]. S. suis is mainly transmitted through wound exposure in the process of infecting people: most infected people have contact with pigs[44], but there are also S. suis infected patients without a history of contact[57]图2 S. suis耐药机制以及感染过程示意图Fig.2 The process of S. suis’s insistence and infection

表2 耐药性S. suis的种类情况Table 2 Type of tolerance S. suis
2.2 我国猪链球菌耐药现状及耐药机制
我国规模化猪场中普遍存在S.suis耐药情况。从我国16个主要养猪省采集的样品中分离出19 673个感染S.suis的病原分离物,这些病料均对8种常用抗生素(β-内酰胺类、氨基糖苷类、大环内酯类、林可霉素类、四环素类、喹诺酮类、多黏菌素类和磺胺类)表现出非常高的抗生素耐药率(图1B)[53]。江西猪场的猪鼻拭子样本显示S.suis的阳性分离率为34.08%,80%以上的分离样本对万古霉素、青霉素、米诺环素和氯霉素敏感[54]。黑龙江猪场中的采集样品则对红霉素、四环素、氯霉素等抗生素耐药率高达80%以上[55]。
近年来多数研究表明,S.suis的耐药性同其耐药基因有关[58],2011—2019年,中国的20个省中收集到的436个S.suis分离物中发现了介导大环内酯类耐药的erm(B)基因和介导四环素类耐药的tet(O)抗性基因(图1C)[14];2016—2018年,从中国6个省份猪场的鼻腔样本中分离出的S.suis染色体上和质粒上有对恶唑烷酮类和酚类抗生素抗性的optrA基因[59];2022年,我国广东地区规模化猪场中收集到的150个分离菌株中四环素耐药基因tet(M)的检测率最高,其次是四环素介导的tet(O)基因[60],34株S.suis对四环素的耐药率高达100%,其次为米诺环素82.4%、多西环素47.1%,其中3重耐药菌株占比44.1%、2重耐药菌株占比41.1%。tet(A)、tet(C)、tet(D)、tet(M)、tet(O)和tet(X)等耐药基因均有检出[61]。通过对从我国分离的366株临床S.suis进行人类相关进化枝分析发现,中国特有的ST7型猪链球菌含有许多抗生素抗性基因,包括tet(O)、mef(A)、erm(B)、msr(D)和aph(3’)-Ⅲ等,这些抗生素抗性基因也显示出很强的可移动遗传元件相关性,说明这些基因可以在不同菌株之间传播[52]。表3中归纳了6个国家耐药菌株的发生发展和携带的耐药基因情况。
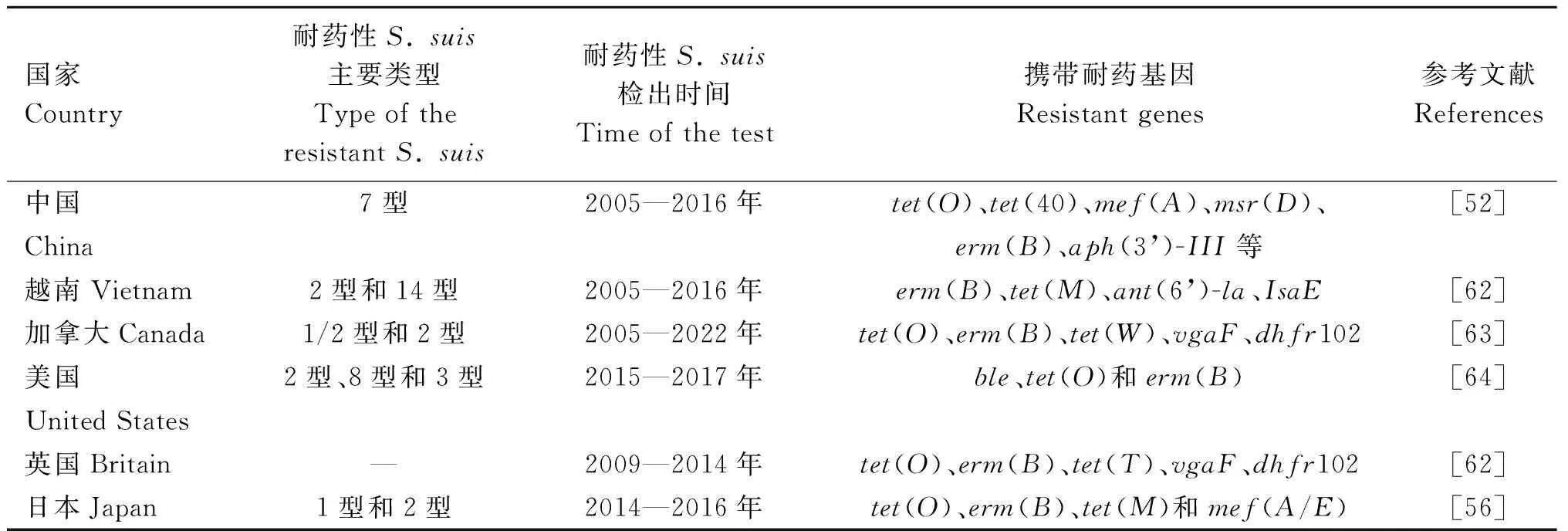
表3 6国耐药性S. suis的发生发展Table 3 Development of drug-resistant S. suis in six countries
2.3 耐药性S. suis主要传播方式以及感染定殖
S.suis中获得耐药性菌株的耐药基因如erm(B)和tet(O)在质粒或转座子介导下传播[65]。在猪感染S.suis的过程中,菌株借助生物被膜(bacterial biofilm,BF)定殖于呼吸道上皮细胞分泌的黏液层[57],穿透黏液层后,黏附素(adhesin)协助S.suis黏附到呼吸道上皮细胞和细胞外基质中[66],随后S.suis会侵入宿主上皮细胞,进入宿主血液流经全身并引起宿主败血症[67],或是穿过血脑屏障进入中枢系统进而引起脑膜炎[68-69];在S.suis感染宿主的过程中,耐药机制使菌株带有耐药性,例如其主动外排、钝化酶的产生以及药物作用靶点改变等方式(图1B、C)。
在S.suis相关疾病暴发初期,水平传播是其主要传染方式。目前,研究人员普遍认为S.suis感染人的方式为开放性伤口的接触以及误食生猪肉[70];我国作为生猪养殖大国,仍有大量潜在S.suis感染的高危人群,更需要加强对S.suis感染的监测。
3 耐药性猪链球菌病的防治措施
3.1 精确检测防控耐药菌株传播
我国规模化猪场在诊断S.suis时多采用生化试验、凝集试验、免疫印迹试验、多重PCR等快速检测方法。我国对于S.suis快速检测技术的研究已较为成熟,这可以更准确地帮助兽医进行临床诊断[71-79](表4)。通过这些精准检测方式,可以在第一时间得知病原体的基因水平信息,有助于人们对病原体分类甄别。对于耐药性猪链球菌,也可以采用耐药基因作为靶点基因进行检测,这对了解和控制耐药性猪链球菌的传播有很大作用。

表4 S. suis的快速检测方法Table 4 The rapid detection methods of S. suis
3.2 猪链球菌疫苗用于预防细菌流行和耐药性出现
我国目前已研制出多种用于预防S.suis的灭活苗。新型疫苗例如针对S.suis的免疫性膜相关蛋白的重组亚单位疫苗[80]、基因缺失疫苗[81]等都具有很强的抗原特异性(表5)。

表5 我国应用的S. suis疫苗*Table 5 The vaccine application of S. suis in China
除过传统的疫苗接种方式,也有研究发现茶多酚(green tea polyphenols , GTP)可以影响S.suis的重要代谢途径,例如嘧啶代谢、蛋白质消化和吸收[82];双黄酮类化合物可以降低S.suis毒力因子(virulence factor, SLY)的活性、减少了炎症因子的产生和细胞自噬[83]。穿心莲内酯亚抑菌浓度的干预可抑制S.suis生物被膜的形成,并且可致毒力基因表达水平差异[84]。这些新兴的中药治疗方法为预防和控制耐药性S.suis的感染提供了新的见解。
3.3 耐药性猪链球菌病的治疗措施
抗菌药物一直被认为是治疗细菌感染的特效药,然而抗菌药物的亚致死剂量使用会促使S.suis的耐药性发生。目前开发出高效的新型抗菌药物仍然是治疗耐药性S.suis感染的最有效策略。
一方面,可以采用联合用药、穿梭用药等经典手段来抑制耐药性的进一步发展,例如常规抗菌剂 (anti-microbiology bacterial, AMB)与精油(essential oil, EO)的组合比单独使用AMBs对抑制S.suis效果更佳[85-86];利用体外杀伤曲线和体内处理试验联合得出氨苄青霉素+安普霉素和替莫林+大观霉素的联合治疗方案对S.suis有较单一抗生素使用更为有效的治疗效果[87-89];我国传统的中药有效成分例如黄酮类化合物黄酮类化合物在抗细菌共感染方面具有明显效果[90],实验室前期研究成果已经显示黄酮类中药具有良好的抗S.suis溶血素作用[91],该类中药主要通过抑制溶血素基因编码、基因转录等途径抑制其活性[92],这也为今后中药治疗S.suis感染提供参考。
另一方面,虽然抗菌药物一直以来被认为是细菌感染的特效药,但是随着抗菌药物的不合理和大规模使用,抗菌药物的耐药性大大提高。受到宿主因素影响的细菌药物耐受行为直接导致抗菌药物治疗策略失效[93]。S.suis作为革兰阳性菌可以侵入宿主的上皮细胞并在其中存活,这使得S.suis对多种抗生素均有耐受性产生[85]。通过依从S.suis的主要毒力因子例如自溶素(autolysins, Atl)、猪溶血素(suilysin, SLY)介导的侵入方式[87,90],研发靶向细菌毒力因子的抗菌药物,降低细菌黏附、避免病原菌入侵细胞[94];S.suis的中和性抗体也可以作为阻断细菌入侵的候选因子;通过设计作用于宿主的抗菌化合物(host-acting antibacterial compounds, HACs)也可以用于抗S.suis[95]:模拟甘露糖受体C型1型(mannose receptor C-1, MRC-1)的多肽作用于肺炎链球菌的溶血素可以抑制链球菌内化[96];砷酸盐、异霉素和过氧化氢等可以通过重塑宿主膜来调节酸性鞘蛋白酶,从而减少细菌黏附[93];25-羟基胆固醇通过靶向膜重塑,来改变膜的胆固醇从而减少细菌内化[97]。总之,阻断病原体的黏附或内化是开发新HACs和消除细菌感染的一种高效策略[86,88,95,98]。
4 小结与展望
S.suis作为规模化猪场中常见的细菌,其菌株血清型类型众多,在感染中常出现不同血清型混合感染的情况[83];近年来随着饲养过程中大量不规范使用抗生素,使得S.suis耐药性也逐年增加,多数规模化猪场中分离的S.suis菌株对于四环素类、大环内酯类、氨基糖苷类抗生素耐药性已达80%以上,所以进行S.suis耐药性分析是目前防控的重中之重。S.suis自1951年初次报道后,在全球范围内广泛流行,菌株也在不断发生基因重组、基因整合等过程,这些都会对菌株的耐药性以及感染能力等带来改变:我国猪场中一直以来广泛流行2型S.suis菌株,7型S.suis菌株虽然同2型的毒力基因差异较大,但是其实际的毒力不容小觑,且其中不乏新兴的耐药基因出现[88],这对防控耐药性猪链球菌提出了新的挑战,因此在防控过程中,归纳分析菌株之间的耐药基因差异十分重要。S.suis感染宿主过程中的机制蛋白在协助其免疫逃避中发挥着重要作用,影响着宿主的免疫能力:蛋白质内肽酶O(S.suisprotein endopeptidase O, SsPepO)是新型纤连蛋白结合蛋白,它可以协助S.suis逃避宿主免疫[99];胞壁质酶释放蛋白(muramidase-released protein, MRP)是新型纤维蛋白原结合蛋白,它可增强S.suis在宿主血液中的存活率,从而使得其脑膜炎加重[100];细胞外基质(extracellular matrix, ECM)蛋白作为S.suis和宿主之间连接的桥梁,已经被证明可以同S.suis相互作用、促进机体感染菌株[101]。所以,在预防S.suis感染的过程中,要注意猪场的环境卫生、通风情况,这些都会对猪群的免疫能力造成影响。
除了宿主免疫能力方面,按时对猪群进行免疫接种从而预防S.suis感染的方式在我国已经发展较为成熟:研究人员在疫苗开发过程中采用ECM蛋白、与宿主体内纤维蛋白或浆膜蛋白相互作用的S.suis蛋白作为潜在目标蛋白制备亚单位疫苗来进行防控,根据此设计靶向中和SsPepO蛋白的治疗S.suis方法、制备亚单位疫苗已经被证实具有可行性[102]。
目前为止,广泛应用广谱类抗生素的治疗方法在不合理用药情况下易引发耐药性S.suis的大流行[98,100],新兴的抗菌药物研发迫在眉睫,研发通过靶向针对S.suis毒力因子[91-92]、中和性抗体和宿主作用的抗菌药物来阻断S.suis的黏附和入侵[93-95,97]都是可行的方法。本文通过总结国内外已报道的部分规模化猪场的S.suis感染情况以及菌株的耐药性情况,一方面,定期对猪场病原分离物进行血清型鉴定和流行病学调查能及时了解S.suis的流行情况和基因组变化,有助于预防S.suis相关疾病;另一方面对S.suis病原分离物进行耐药性分析可以对规模化猪场中的用药情况、药品使用情况有一定的了解,进而指导兽医临床用药,来控制耐药性菌株的进一步发展,同时也能为抗菌化合物的研发提供一定的参考。



