宋科林,闫尊强,王鹏飞,程文昊,李 杰,白雅琴,孙国虎,滚双宝,2*
(1.甘肃农业大学动物科学技术学院,兰州 730070;2.甘肃省现代养猪工程技术研究中心,兰州 730070;3.甘肃省畜牧技术推广总站,兰州 730030)
畜禽遗传资源是畜牧业的“芯片”,也是培育畜禽优良品种的基础,作为国家重要的战略资源,具有不可再生性[1]。我国是生猪养殖大国,生猪出栏量和存栏量均居于世界领先地位,也拥有非常丰富的猪种资源,现有猪品种共102个,其中本地品种83个、培育品种13个、引入品种6个,本地品种占总品种的81.37%[2]。根据地理环境和气候条件的不同,我国地方猪可分为6大类,包括华北型、华南型、华中型、西南型、高原型和江海型,这些猪种具有肉质好、抗病力强等优良特性[3]。随着市场经济的发展,生长周期长的地方猪种难以满足养殖户的需求,很多优良地方猪种被国外猪种杂交,导致我国部分地方猪品种血缘混杂、遗传多样性降低。因此,加强畜禽遗传资源的保护,对未来我国畜牧业的可持续发展、促进畜牧业转型升级和打赢种业翻身仗具有重要意义。
在第三次全国畜禽遗传资源普查时,甘肃省发现了徽县青泥黑猪群体,其原产地为甘肃省陇南市徽县,主要生长在当地青泥岭附近的山林、荒坡中,喜欢在青泥中觅食、打滚,当地人将其称为“青泥黑猪”。过去由于信息闭塞,散养在大山深处的青泥黑猪无人问津。近年来,当地政府依托青泥黑猪这一产业,组建了青泥黑猪生态养殖专业合作社,有力提升了青泥黑猪的知名度,青泥黑猪的养殖规模不断扩大。该猪种体型外貌有别于其他地方猪种,具有繁殖性能高、肉质口感佳等特点,很可能是新遗传资源。为了进一步挖掘和丰富我国猪遗传资源,有必要对其进行基因组鉴定。
随着生物技术的不断发展,很多分子技术,如线粒体DNA标记[4-5]、微卫星标记[6-7]、简化基因组测序[8-10]、全基因组重测序[11-12]等被广泛应用于生物遗传多样性评判及新品种鉴定。单核苷酸多态性(single nucleotide polymorphism,SNP)是DNA序列中某个位点上单个核苷酸发生变异引起DNA序列多态性,包括转换、颠换、插入和缺失。SNP作为第三代分子标记,具有遗传稳定性高、多态性位点丰富、易实现自动化检测等特点[13],将数百万个DNA标记序列排列并固定在特殊硅片上,形成的SNP探针微阵列就是SNP芯片[14]。SNP芯片已广泛应用于畜禽种质特性、遗传多样性和新品种鉴定等方面研究。王小鹏等[15]使用60K SNP芯片对35个中外地方猪种共986个个体进行扫描,筛选出了莱芜猪品种特异位点,并结合PCA分析和进化树分析相互验证,品种鉴别准确率达到100%。刘晨曦等[16]对45个欧亚猪种1 228头猪的芯片数据进行遗传距离、邻接系统发育树及遗传分化系数等分析,证实了红灯笼猪的品种独立性。Ma等[17]利用高密度SNP芯片揭示了华西牛独特的遗传特征和系统发育关系,为其重要经济性状的遗传机制解析提供了依据。Diao等[18]基于SNP芯片数据研究了我国南方地区猪的遗传多样性、种群结构和连锁不平衡程度(LD),发现部分地方猪的遗传多样性丧失,且存在西方商品猪的渗入。目前,关于徽县青泥黑猪遗传结构及遗传多样性的研究鲜有报道,因此,本研究利用“中芯一号”50K SNP芯片对3个不同猪种68头猪进行全基因组范围内SNP检测,进一步了解徽县青泥黑猪遗传资源特性,为其作为新资源申报、保护和利用提供参考。
1 材料与方法
1.1 试验材料
选用甘肃已知地方猪种(八眉猪、合作猪各20头)和待鉴定新猪种(徽县青泥黑猪28头)共计68头猪,各群体数目及样本信息来源见表1。用剪耳钳沿耳朵下边缘剪取约0.5 g耳组织,置于2 mL冻存管中,带回实验室-20 ℃保存。
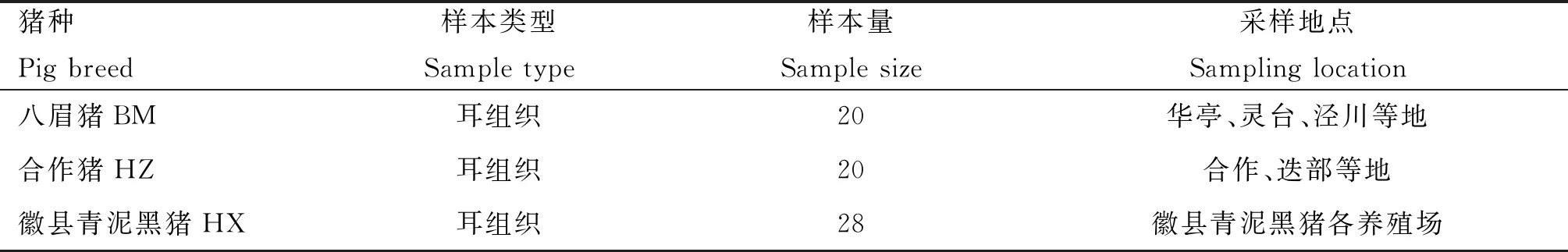
表1 3个猪种数目及样本信息来源
1.2 试验方法
1.2.1 基因组DNA提取与质量检测 按照康为世纪的CWE9600 Blood Spots DNA Kit试剂盒说明书提取基因组DNA,NanoDrop 2000和Qubit 2.0测定DNA纯度和浓度,0.8%琼脂糖凝胶电泳(170 V,25 min)检测DNA完整性。
1.2.2 SNP分型与数据质控 质检合格的DNA样品使用“中芯一号”50K SNP芯片(康普森农业科技有限公司,北京)进行SNP分型,利用Plink(v1.90)软件进行数据质控[19],质控标准为:常染色体上SNP检出率(call rate)大于等于90%、个体检出率大于等于90%、MAF大于等于0.01。
1.2.3 群体遗传多样性分析 采用Plink(v1.90)软件计算期望杂合度(He)、观察杂合度(Ho)、多态标记比例(PN),VCFtools(v0.1.17)软件计算核苷酸多样性(Pi),SNeP(v1.1)软件[20]计算有效群体含量(Ne),PopLDdecay(v1.90)计算连锁不平衡(linkage disequilibrium,LD)情况,通常用r2表示连锁不平衡程度。
1.2.4 群体遗传结构分析 利用GCTA(v1.94)软件进行主成分分析(principle component analysis,PCA)[21],基于IBS遗传距离,利用Mega X(v10.0)软件[22]构建进化树,利用Admixture(v1.3)软件分析群体结构。
1.2.5 群体分化指数分析Fst用于衡量种群分化程度[23],Fst取值范围在0~1之间,当Fst取值为1时,表示两个群体完全隔离,完全分化;取值为0时,群体间随机交配,没有分化。本研究使用VCFtools(v0.1.17)软件进行Fst分析。
1.2.6 亲缘关系分析 利用Plink(v1.90)软件计算徽县青泥黑猪IBS遗传距离,并构建状态同源(identity by state,IBS)矩阵,分析徽县青泥黑猪个体之间的遗传距离;利用Gmatrix(v2)软件构建G矩阵[24],分析徽县青泥黑猪个体间的亲缘关系,并使用R语言对分析结果进行可视化。
2 结 果
2.1 基因组DNA提取与检测
对所有组织样品进行DNA提取,经紫外分光光度计(Nanodrop2000)检测其OD260 nm/OD280 nm值在1.7~2.1之间,表明提取的DNA纯度较高,0.8%的琼脂糖凝胶电泳检测其完整性,结果显示DNA条带清晰,无拖尾现象(图1),表明提取的DNA完整性较好,可用于后续试验。

M. DNA相对分子质量标准;1~10. 基因组DNA样品M. The DNA reference marker;1-10. The genomic DNA samples
2.2 SNP位点的质控
共检测到55 156个SNPs标记分型结果,MAF<0.01的标记有811,SNP检出率<0.90的标记有808个,X染色体上的标记有4 252个,插入/缺失标记6个,通过质控的标记为49 279个(表2)。根据SNP在染色体上的分布,绘制SNPs在染色体上的分布图(图2)。
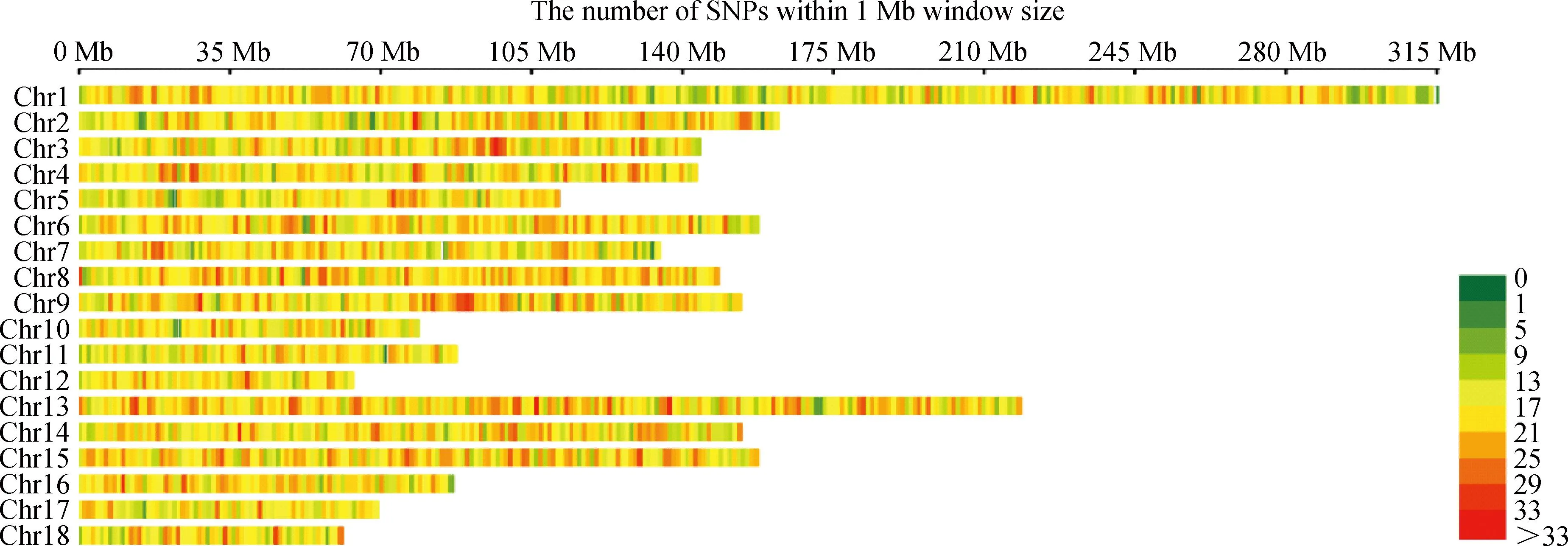
图2 SNPs在染色体上的分布图Fig.2 Distribution of SNPs on chromosomes

表2 SNP质量控制统计结果
2.3 群体遗传多样性分析
3个品种的观察杂合度(Ho)均高于期望杂合度,且HX群体的观察杂合度和期望杂合度最高,分别为0.386 4、0.370 7,HZ群体的观察杂合度和期望杂合度最低,分别为0.352 4、0.324 0;同样,HX群体的有效群体含量、多态标记比例和核苷酸多样性均高于HZ和BM群体,分别为2.2、0.915 7、0.378 6(表3)。
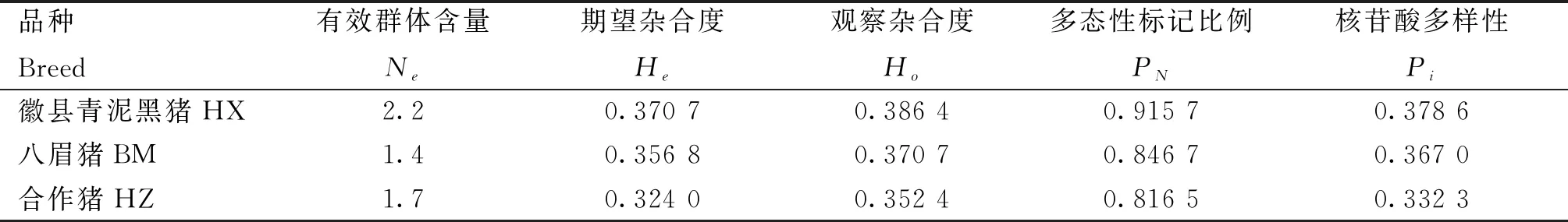
表3 3个猪种的遗传多样性指标
LD分析表明,3个品种的LD系数r2随着位点距离的增加均降低,LD系数(r2)由高到低依次为BM、HZ、HX,衰减速度由快到慢依次为HX、HZ、BM(图3)。
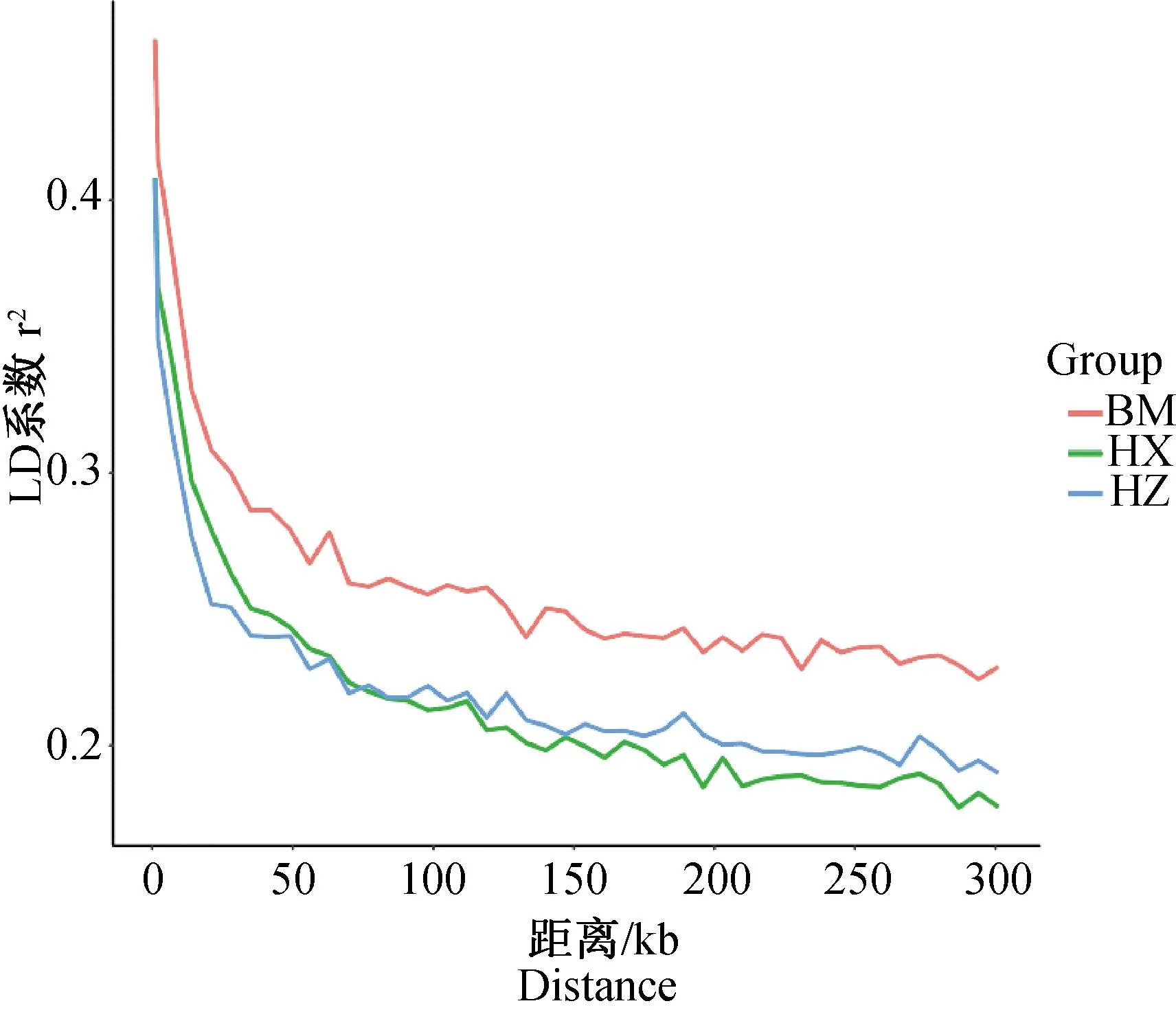
图3 LD衰减图Fig.3 LD decay
2.4 群体遗传结构分析
PCA分析显示,PC1、PC2的贡献率分别为12.83%和6.83%,3个群体分别聚类,HX群体相对聚集,根据PC1(PC1>0)可将HX群体和HZ、BM群体区分开(图4)。进化树分析结果发现,HX群体独自聚为一支,BM群体和HZ群体同属于另一大分支,随后BM和HZ分离出来(图5)。根据研究群体,取多个K值,一般CV值越小所对应的K值越佳,以此确定最佳分群数,K=3为最优分群数(图6)。由群体结构可知,K=2时,可将HZ群体与HX、BM区分开,3个群体含有共同血缘,K=3时,可分为3个亚群,与分析群体数量一致,HX开始显现出与HZ、BM不同的进化路线,但HX包含多种祖先成分,K= 4时,3个群体也能很好的进行区分,但血统都更加复杂(图7)。
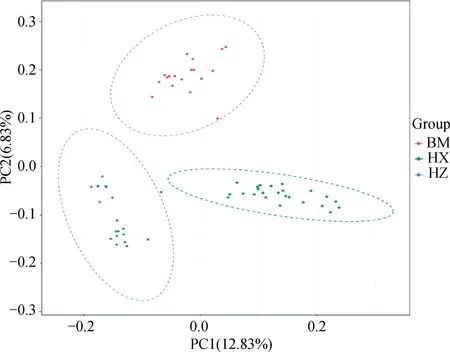
图4 3个猪种的主成分分析Fig.4 Principal component analysis of 3 pig breeds
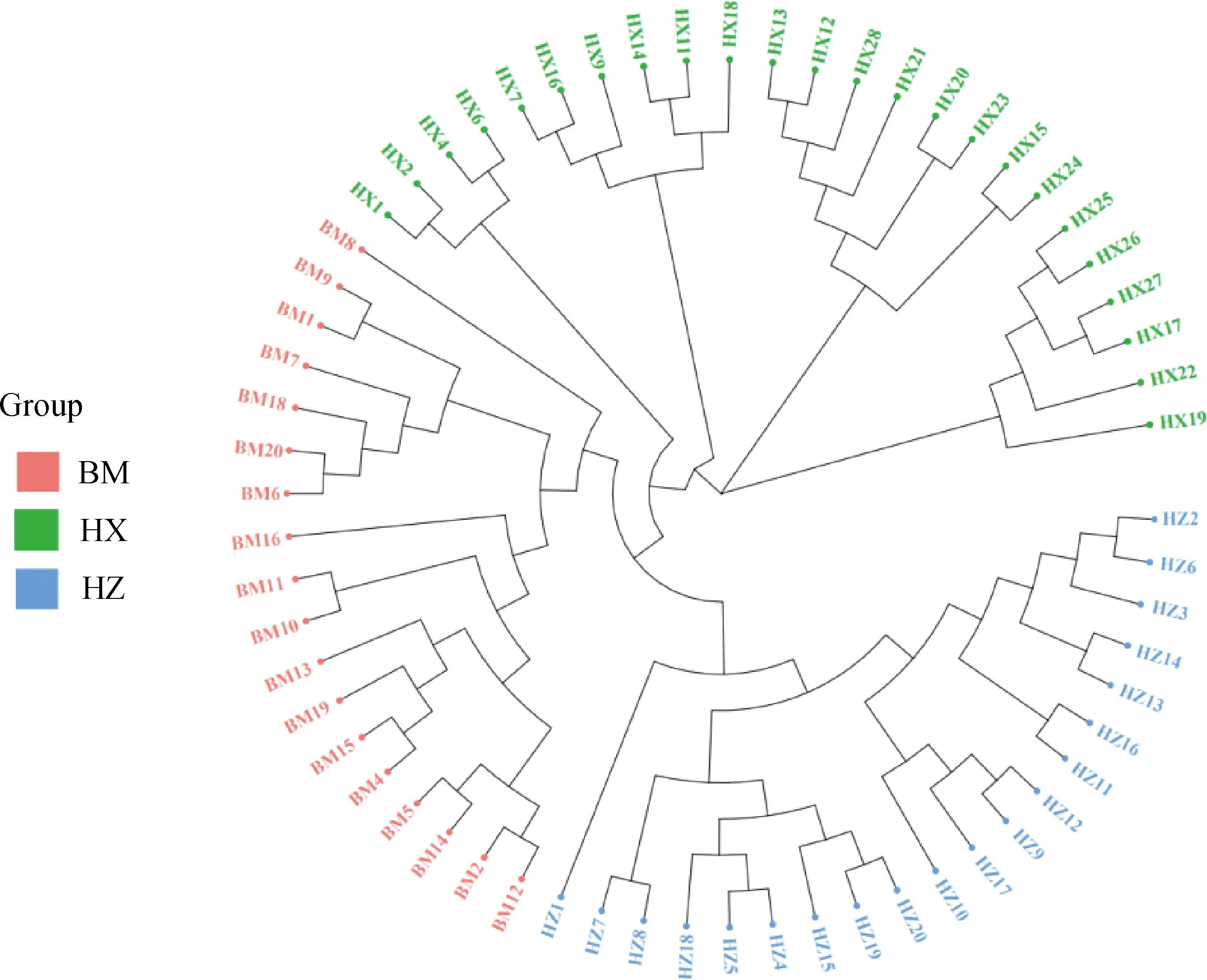
图5 3个猪种的进化树Fig.5 Evolutionary tree of 3 pig breeds
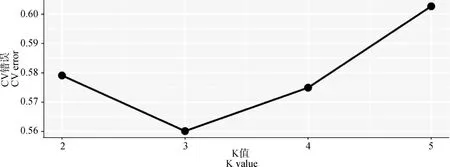
图6 交叉验证错误率Fig.6 Cross validation error rate
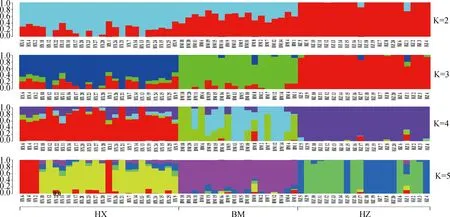
每一列表示一个个体,不同颜色片段的长度表示该个体基因组中某个祖先所占的比例,横坐标代表群体名称Each column represents an individual, where the length of the different colored segments indicate the proportion of a particular ancestor in that individual’s genome, and the horizontal coordinates represent the name of population
2.5 群体分化指数分析
为了量化HX群体和BM、HZ群体之间的遗传关系,计算了3个群体之间的分化指数(Fst),HX群体与BM群体的分化指数为0.123 6,与HZ群体的分化指数为0.159 8,BM与HZ群体的分化指数为0.134 5,表明HX和BM、HZ之间存在一定程度的遗传分化(表4)。
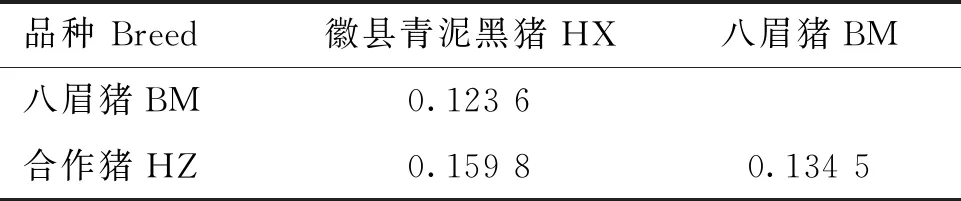
表4 3个猪种之间的分化指数
2.6 徽县青泥黑猪IBS距离矩阵分析
HX的平均IBS遗传距离为0.294 8±0.001 1,表明HX个体间存在较远的遗传距离。IBS矩阵分析显示,大部分HX个体间遗传距离较远,亲缘关系亦较远,少数个体之间遗传距离较近,亲缘关系亦较近,表明HX群体内部存在近交风险(图8)。
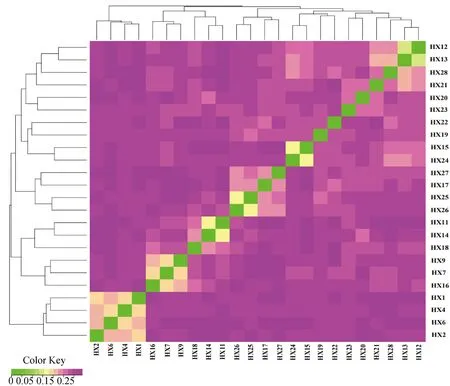
IBS距离矩阵中每一个小方格代表第一个到最后一个样本两两之间的遗传距离值,该值越大越接近紫色,即两个个体的遗传距离越大,反之亦然Each small square in IBS distance matrix represents the value of genetic distance between two pairs from the first sample to the last sample, the larger the value, the closer it is to purple, that is, the larger the genetic distance between two individuals, and vice versa
2.7 徽县青泥黑猪G矩阵分析
HX群体基因组亲缘关系系数为0.036 1±0.009 5,G矩阵分析结果显示,HX大部分个体之间亲缘关系较远,少数个体亲缘关系较近(图9),与IBS距离矩阵分析结果一致,表明HX群体有近交趋势,需强化保种措施,避免近交衰退。
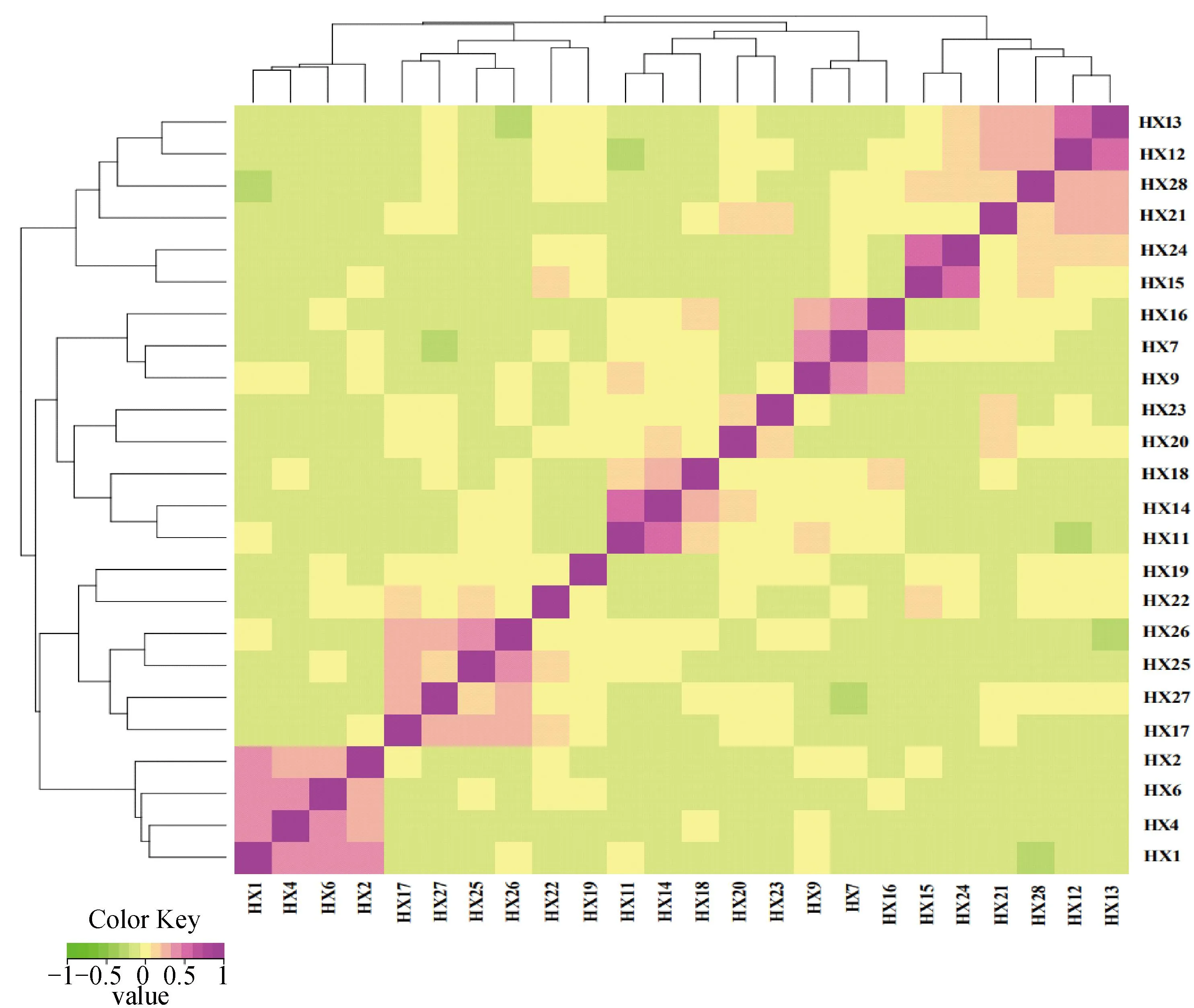
G矩阵结果中,每一个小方格代表第一个到最后一个样本两两之间的亲缘关系值,该值越大越接近紫色,即两个体亲缘关系越近In the G matrix results, each small square represents the value of the relationship between two pairs from the first sample to the last sample, the larger the value, the closer it is to purple, that is, the closer relationship between two individuals
3 讨 论
遗传多样性是地球上生物所携带的全部遗传信息的总合,包括种内群体间和群体内个体间的遗传变异,生物体遗传多样性越高,遗传变异越丰富,对环境适应力就越强,不容易遭受灭绝[25-26]。畜禽遗传多样性与人类生产生活紧密相关,保护畜禽遗传多样性就是保护人类所拥有的全部可遗传变异材料,有助于人类挖掘畜禽优良基因,实现畜牧业可持续发展,加速人类文明进展,促进国家经济发展[27]。Jiang等[28]利用27个微卫星标记研究了莱芜猪的遗传多样性,发现莱芜猪的遗传多样性非常低,表明莱芜猪品种存在一定程度的近交。Leng等[29]基于“中芯一号”芯片分析了荣昌猪群体特征,发现荣昌猪遗传多样性较低。观察杂合度是指群体内某一位点是杂合子的个体数占总个体数的比率,期望杂合度指的是群体内任一个体的任一位点发生杂合的概率[30]。本研究发现,HX的平均观察杂合度为0.386 4,高于HZ(0.352 4)和BM(0.370 7),也高于其他一些地方猪种如盆周山地猪(0.294 7)[31]、杭猪(0.359 0)[32]、蓝塘猪(0.351 0)[18]、梅花猪(0.360 0)[18]、里岔黑猪(0.351 2)[33]等,HX的平均期望杂合度为0.370 7,高于HZ(0.324 0)和BM(0.356 8),也高于青峪猪(0.329 3)[34]、撒坝猪(0.263 0)[35],但低于梅山猪(0.382 0)[36]、米猪(0.382 0)[37]、金华猪(0.570 0)[37]等地方猪种,且HX的观察杂合度高于期望杂合度,说明HX群体可能引入了其他品种的血缘,导致品种不纯。有效群体含量是指与实际群体具有相同的基因频率方差或相同杂合度衰减的理想群体含量[20]。本研究发现,3个猪种中,HX的有效群体含量最高,为2.2,低于里岔黑猪(8.7)[33]、青峪猪(12)[34]、通城猪(102)[38],可能是HX群体保种规模有限,且群体内发生了近交而导致有效群体含量降低。多态标记比例是指群体中表现为多态的位点所占的比例,核苷酸多样性是指两个序列间每个位点上核苷酸差异的平均值,两者都能反映群体多态性水平。本研究发现,HX群体多态标记比例为0.915 7,高于HZ(0.816 5)、BM(0.846 7),也高于伍隍猪(0.641 9)[39]、里岔黑猪(0.827 0)[33]、丫杈猪(0.875 0)[40]和荣昌猪(0.515 0)[29],表明HX群体中有91.57%的位点具有多态性。HX群体的核苷酸多样性为0.378 6,高于合作猪(0.332 3)、八眉猪(0.367 0),表明HX群体具有更高的多态性水平。以上分析均表明HX遗传多样性高于HZ和BM群体。LD描述了不同基因座上等位基因的非随机线性关联,且这种关联是由迁移、选择及遗传漂变产生[41]。LD分析可以揭示不同群体在进化过程中受到选择的强度及遗传物质多态性的高低,提供种群进化信息[37],在LD分析中,LD衰减越慢,受选择强度越大,可推断各种群的受选择强度的差异。本研究发现,3个猪种中BM和HX群体的LD系数较高,HX衰减速度最快,由此推断该群体受选择程度较弱,BM衰减速度最慢,推断该群体受选择程度较强。
研究品种之间的遗传距离和遗传结构对于了解猪种的形成和分类有重要意义[37]。Li等[42]利用26个微卫星标记,对10个中国地方猪种和3个引进猪种的遗传多样性和亲缘关系进行分析,发现中国地方猪种的遗传多样性高于引进猪种,10个地方猪种群聚类与地理分布基本一致。黄树文等[43]研究了广东省5个地方猪种遗传距离和遗传结构,发现地方猪种与亚洲野猪遗传距离较近,与西方猪种遗传距离较远,梅花猪和粤东黑猪均混入了西方猪种的血液。本研究中,PCA和进化树分析发现HX群体相对聚集,与HZ群体遗传距离较远,且HX群体独自聚为一支,BM和HZ属于同一分支,后逐渐分离。群体结构分析显示,当K=3时,HX群体显现出与HZ、BM群体不同的进化路线,但HX群体中有多个祖先成分,可能是祖先本身多态性或者近期发生了杂交导入了其他祖先基因所造成。因此,要对血缘纯正的HX群体加强保种,防止其血缘更为混杂。群体分化指数的解释标准为:0~0.05很小分化程度;0.05~0.15中等程度分化;0.15~0.25高度分化;高于0.25极度分化[44]。本研究发现,HX群体与HZ群体之间分化指数为0.159 8,HX群体与BM群体之间分化指数为0.123 6,HZ与BM群体之间的分化指数为0.134 5,表明3个猪种之间均存在一定程度的遗传分化。
当前,我国地方猪种保种多采用闭锁繁育的方式,导致群体的遗传结构和亲缘关系容易受到选择的影响。因此,了解保种群的亲缘关系对于群体的保种显得至关重要[45]。本研究计算了HX群体基因组亲缘关系系数为0.036 1±0.009 5,G矩阵可视化,表明HX群体中大部分个体之间亲缘关系较远,少数个体之间亲缘关系较近。同时本研究计算了HX群体遗传距离为0.295 0±0.001 1,低于刘彬等[34]报道的青峪猪(0.260 4±0.025 2)、刘晨龙等[32]报道的杭猪(0.178 3±0.025 5)、Liu等[46]报道的凉山猪(0.282 3±0.025 9),表明HX群体内遗传距离相对较远。基于遗传距离构建IBS距离矩阵,IBS距离矩阵显示HX群体中大部分个体之间遗传距离较远,少数个体较近。G矩阵和IBS距离矩阵都表明,HX群体中部分个体之间亲缘关系较近,推测群体内可能存在一定程度的近交,需要加强保种,避免近交衰退。以上分析均揭示了HX群体独特的遗传背景,为其作为新品种资源的申报提供了理论依据。
4 结 论
本研究基于“中芯一号”50K SNP芯片数据,分析了徽县青泥黑猪的遗传多样性及遗传结构,发现徽县青泥黑猪遗传多样性高于合作猪和八眉猪,与八眉猪、合作猪群体相对独立,存在一定程度的遗传分化,证实徽县青泥黑猪很可能是一个甘肃地方新猪种。徽县青泥黑猪部分个体间存在近交,需要加强保种,避免近交衰退。本研究为进一步挖掘徽县青泥黑猪新遗传资源和合理保种开发利用提供了理论依据。



