虎巧燕,翟相钦,李一丹,韩家乐,雷初朝,党瑞华
(西北农林科技大学动物科技学院,杨凌 712100)
成熟精子由精原干细胞(spermatogonial stem cells,SSC)进行自我更新和分化产生,于睾丸内的精细管中进行,精细管中主要包含支持细胞和生殖细胞[1]。支持细胞(sertoli cell,SC)是不规则的圆锥形细胞,核仁突出,是曲精细管内维持细胞生存微环境的组成部分,具有多种生物学功能[2-3],主要通过为生殖细胞提供生理和营养支持来调节精子发生,使精子能够持续产生,在精子发生过程中起着核心作用[4-5]。支持细胞是微环境中最重要的体细胞类型,是唯一与精子各阶段直接相交的体细胞,在精子发生中支持和引导雄性生殖细胞的发育,是决定精子产生质量与数量的关键因素[6]。由于只有未成熟支持细胞才能进行增殖,因此成年牛睾丸组织中支持细胞的数量以及支持细胞对生殖细胞的支持能力是固定的,这就意味着性成熟前公牛睾丸支持细胞的增殖能力对其性成熟后的繁殖性能有着重要影响[7]。
miRNA是小的内源性非编码RNA,约有22~27个核苷酸,广泛存在于各种生物中,具有高度的保守性,可以调控与机体生长发育相关的多种过程[8-10]。每个miRNA有多个mRNA作为靶点,与此同时,每个mRNA也受到多个miRNA的调控,这也使得蛋白质的表达调控更具复杂性[11-12]。诸多研究表明,miRNA可以通过对雄性睾丸支持细胞的增殖、凋亡、分泌以及血睾屏障的形成等过程进行调控,从而影响雄性动物的生殖能力[13-15]。Gao等[16]发现,miR-146b在牛睾丸组织中高表达,用miR-146b的mimics对生殖细胞进行处理后发现miR-146b会抑制生殖细胞的增殖,并促进其凋亡。2020年Sellem等[17]通过深度测序鉴定出了20余种在公牛睾丸组织中高表达的miRNA。Wu等[18]发现,miR-19b、miR-133a、miR-2285b、miR-2405、miR-759、miR-2284z、miR-34b、miR-2334、miR-2285e、miR-302a在青年公牛精液中的表达存在显着差异,这些miRNA的靶点与着床前胚胎的代谢和发育通路如TGF-β、PI3K/AKT以及氧化磷酸化和线粒体功能障碍有关。因此,miRNA在雄性动物精子发生、支持细胞形成的过程中发挥着重要作用。
目前,关于miR-101的研究主要聚焦于对肿瘤及癌细胞的研究[19-20]。Dong等[21]发现,miR-101-3p通过抑制KPNA2促进细胞凋亡,从而抑制肺鳞状细胞癌的活力、侵袭和迁移。在肝癌细胞中,Xu等[22]发现miR-101-3p靶向ARHGAP1抑制肝癌细胞集落的形成和侵袭。然而关于miR-101在生殖细胞方面,尤其是与支持细胞相关的研究相对较少。Luo等[23]研究了miR-101对猪卵母细胞的影响,发现miR-101通过靶向猪卵丘细胞中的HAS2来调控卵母细胞的成熟。程鹏等[24]研究发现,在隐睾小鼠个体中miR-101的表达量升高,说明miR-101与精子发生有着密切关系。实验室前期转录组测序结果显示,bta-miR-101在牛睾丸组织初生期和成年期的表达水平存在显着性差异,初生期bta-miR-101的表达量高于成年期,因此推测miR-101可能对公牛的睾丸发育、精子发生以及繁殖性能有重要影响。本试验以miR-101为研究对象,初步探索其对牛睾丸支持细胞增殖、分泌与凋亡的影响,为进一步研究miR-101对牛睾丸发育的调控机制奠定基础。
1 材料与方法
1.1 试验主要试剂
DMEM/F12培养基、胎牛血清FBS(Cellmax,美国)、细胞裂解液(Solarbio,中国)、全蛋白提取试剂盒(索莱宝,北京)、ECL显色液(索莱宝,北京)、PrimeScriptTM RT Master Mix、MiR-XTM miRNA FirstStrand Synthesis(TaKaRa,中国)、CCK-8、RNAiso(TaKaRa,中国)。miR-101 mimics、miR-101 inhibitor、mimics NC、inhibitor NC由上海吉玛制药技术有限公司合成。
1.2 支持细胞采集与细胞培养及转染
采集初生期(3日龄,n=3)和性成熟期(13月龄,n=3)安格斯牛新鲜的睾丸组织(采自于陕西秦宝牧业有限公司)及其小肠、肝、肾脏、肌肉、心脏、脂肪、肺等组织,用无菌的剪刀剪下组织放到做好标记相应的无菌冻存管中。快速置于液氮中,运回实验室-80 ℃保存。试验所用牛睾丸原代支持细胞由本实验室分离纯化。提交bta-miR-101成熟序列UACAGUACUGUGAUAACUGAA于上海吉玛制药技术有限公司合成miR-101 mimics、miR-101 mimics NC、miR-101 inhibitor、miR-101 inhibitor NC。SC培养于DMEM/F12培养基中,补充10%胎牛血清,置于细胞培养箱中37 ℃、5% CO2的条件培养。将miR-101 mimics、miR-101 mimics NC、miR-101 inhibitor、miR-101 inhibitor NC(序列见表1)分别转染至SC中,每组3个重复,细胞转染根据制造商说明书:5 μL miR-101 mimics/NC、inhibitor/NC(100 nmol·L-1)或EndoFectinTMMax转染试剂用Opti-DMEM分别稀释至150 μL,室温静置5 min。将稀释的miR-101 mimics/NC或inhibitor/NC溶液以及EndoFectinTMMax溶液轻柔混合,室温静置20 min,向6孔板中逐滴添加RNA-EndoFectinTM复合物,在CO2培养箱中37 ℃孵育24~48 h。

表1 RT-qPCR引物序列
1.3 bta-miR-101的生物信息学分析
通过NCBI(https://www.ncbi.nlm.nih.gov/)及miRBase(http://www.mirbase.org/)数据库查找各物种miR-101的成熟序列。利用在线工具TargetScan(http://www.targetscan.org/vert_72/)、miRDB(http://www.mirdb.org/index.html)、miRWalk(http://mirwalk.umm.uni-heidelberg.de/.)和miRTarBase(http://mirtarbase.cuhk.edu.cn/php/index.php)分别对miR-101进行靶基因预测,将数据进行分析整理,利用在线工具KOBAS 3.0(http://kobas.cbi.pku.edu.cn/kobas3/?t=1)对靶基因进行Gene Ontology(GO)和KyotoEncyclopedia of Genes and Genomes(KEGG)分析。
1.4 CCK-8检测
利用CCK-8检测细胞活性,将SC培养于96孔板中并进行转染(1×104个·孔-1),转染后置于CO2培养箱中培养48 h,设置6个重复。每孔加入10 μL的CCK-8试剂,置于CO2细胞培养箱中继续孵育2 h。随后使用酶标仪检测混合物在450 nm处的吸光度,计算细胞增殖活力。
1.5 RT-qPCR检测基因表达
利用RNAiso试剂处理SC并从中提取总RNA,使用Nanodrop1000测定RNA的纯度和浓度。使用去基因组反转录试剂盒(TaKaRa,大连)在无RNA酶的条件下进行反转录合成cDNA。根据DiNing公司的2×Fast qPCR Master Mixture(Green)试剂盒进行PCR检测,反应体系为:2×ChamQ SYBR qPCR Master Mix 5 μL,Forward Primer 0.2 μL,Reverse Primer 0.2 μL,cDNA 1.0 μL,ddH2O 3.6 μL。反应条件:预变性:95 ℃ 30 s;40个循环:95 ℃ 10 s,60 ℃ 30 s;熔解曲线:95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。相对表达量计算方法为2-ΔΔCT,其中分别以U6和β-actin做内参。RT-qPCR均为4个重复,所用引物序列见表1。
1.6 Western Blotting检测蛋白水平
细胞转染后36 h,利用全蛋白提取试剂盒(索莱宝,北京)提取细胞总蛋白。利用12% SDS PAGE凝胶将总蛋白提取液进行分离,并印迹在硝化纤维素膜上。将膜用5%脱脂奶粉封闭液室温封闭2 h,结束后将膜与一抗4 ℃过夜孵育,随后二抗孵育2 h,将膜置于显色板并滴上ECL显色液(索莱宝,北京),利用ChemiDoc XRS+system(Bio-Rad,Hercules,USA)成像仪显影。Image J软件分析蛋白灰度。
1.7 统计分析
试验结果通过数据分析软件GraphPad Prism 9.0做柱状图分析。结果表示方式为“平均值±标准差(SD)”,每个试验至少设置3个生物学重复。结果采用SPSS 19.0(SPSS Inc.,Chicago,IL,USA)进行分析,对于两组结果的分析,使用独立样本t检验分析试验结果的显着性;对于两组以上结果的比较,使用单因素方差分析Turkey检验进行显着性分析,*表示P<0.05即差异显着,**表示P<0.01即差异极显着。
2 结 果
2.1 miR-101生物信息学分析
在NCBI和miRBases数据库中查找miR-101的种子序列为GUACUGU,发现miR-101的成熟序列在哺乳动物中具有高度的保守性(图1A)。利用4种在线软件TargetScan、miRDB、miRWalk和miRTarBase分别预测到896、1 063、2 096、357个miR-101的靶基因,并使用Venny2.1(https://bioinfogp.cnb.csic.es/tools/venny)对预测结果进行交互绘制,共筛选出26个共同靶基因,如图1B。对共同靶基因进行GO和KEGG富集分析,结果显示这些靶基因主要富集在核质、蛋白质结合、JAK-STAT的受体信号通路上(图1C),这些信号通路与细胞分化、细胞周期、细胞凋亡等生物过程有着密切联系。
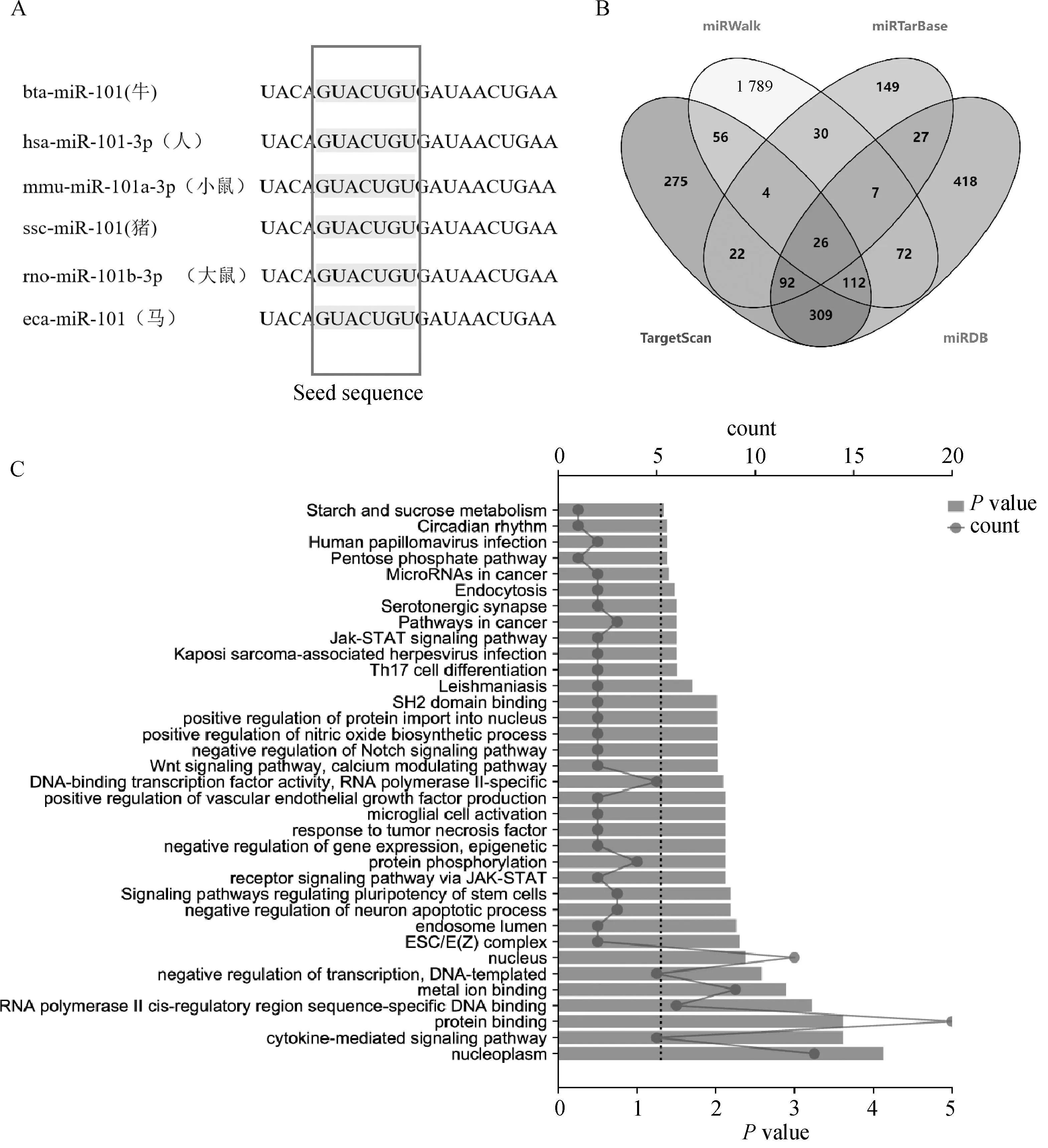
A.不同物种miR-101成熟序列;B.miRNA预测靶基因的韦恩图;C.GO和KEGG富集分析A.Mature sequences of miR-101 in different species;B. Venn diagram of predicted target genes of miRNA;C. GO and KEGG enrichment analysis
2.2 bta-miR-101在牛不同时期不同组织中的表达分析及转染效率验证
为了研究miR-101在安格斯牛不同时期各种组织(心、肝、肺、肾、小肠、肌肉和睾丸)中的表达特征,提取了各组织中的RNA,利用RT-qPCR检测bta-miR-101在各组织中的表达量,分析数据显示,miR-101主要在肾脏组织中表达量较高(图2A、2B)。在睾丸组织中,miR-101在初生期的表达量显着高于性成熟期(P<0.01),与前期转录组测序结果一致[16],说明miR-101在牛睾丸组织中的表达具有阶段特异性(图2C)。将bta-miR-101的模拟物和抑制物转染至牛未成熟睾丸支持细胞中,利用RT-qPCR检测转染后miR-101的表达量。结果显示,与NC组相比较,用miR-101 mimics处理细胞后miR-101的表达量显着上升(P<0.01),用miR-101 inhibitor处理细胞后miR-101表达量显着下降(P<0.05),说明具有较高的转染效率,可用于后续试验(图2D)。
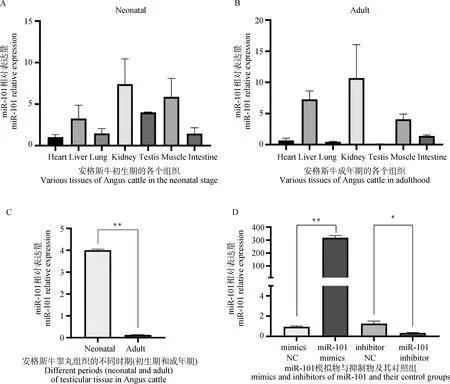
A.bta-miR-101在牛初生期不同组织中的相对表达水平;B. bta-miR-101在牛性成熟期不同组织中的相对表达水平;C. bta-miR-101在犊牛和成年牛睾丸组织中的相对表达水平;D. bta-miR-101模拟物与抑制物转染效率检测。*.P<0.05;**.P<0.01;ns.P>0.05,下同A.The relative expression levels of bta-miR-101 in different tissues of neonatal cattle;B. The relative expression levels of bta-miR-101 in different tissues of adult cattle;C. Relative expression levels of bta-miR-101 in testicular tissue in calves and adult cattle;D. Transfection efficiency detection of bta-miR-101 mimics and inhibitor. *.P<0.05; **.P<0.01;ns.P>0.05,the same as below
2.3 bta-miR-101对SC增殖的影响
为探究bta-miR-101对SC增殖的影响,提取转染了mimics NC、miR-101 mimics和inhibitor NC、miR-101 inhibitor的牛睾丸支持细胞的总RNA以及蛋白质,利用RT-qPCR检测与增殖相关基因的表达量,利用Western Blotting试验检测增殖相关基因蛋白水平的表达量。对结果进行分析显示,在mRNA水平,miR-101 mimics可以显着增加增殖标记基因PCNA和CyclinD1的表达量,并显着抑制p21的表达量(图3A,P<0.05),而miR-101 inhibitor则可以显着抑制CDK2、PCNA、CyclinD1基因的表达并显着促进p21基因的表达(图3B,P<0.05)。在蛋白水平,miR-101 mimics极显着增加CDK2、PCNA的表达(P<0.01),而miR-101 inhibitor则降低CDK2、PCNA蛋白表达水平(图3 D,3E,3F)。采用CCK-8试剂盒检测细胞增殖情况,结果分析显示,过表达miR-101可以显着升高支持细胞的增殖系数(P<0.05),而抑制miR-101的表达可以极显着降低细胞增殖系数(图3C,P<0.01)。综上所述,bta-miR-101可以促进牛未成熟支持细胞的增殖。
2.4 bta-miR-101对SC凋亡的影响
为进一步研究bta-miR-101对牛睾丸支持细胞凋亡的影响,同样利用RT-qPCR检测与凋亡相关基因的表达量。试验结果显示,与NC组相比,miR-101 mimics可以显着抑制凋亡标志基因Caspase3、Caspase9并显着提高B淋巴细胞瘤-2基因(Bcl2)的表达,而miR-101 inhibitor则与之相反(图4A,4B,P<0.05)。Western Blotting试验结果显示过表达miR-101可以极显着抑制Caspase9蛋白水平的表达量,而干扰miR-101可以促进Caspase9在蛋白水平的表达(图4C,4 D,P<0.01)。以上结果说明bta-miR-101对牛睾丸支持细胞的凋亡具有抑制作用。
2.5 bta-miR-101对SC分泌的影响
合成并分泌可以调节精原细胞自我更新与分化的必须生长因子是睾丸支持细胞的重要功能之一。为了研究bta-miR-101对睾丸支持细胞分泌功能的影响,利用RT-qPCR检测了与细胞分泌相关的标志基因的表达量,分析结果显示过表达miR-101可以显着促进GDNF、BMP4基因的表达,干扰miR-101则可以极显着抑制以上基因的表达(图5A,5B,P<0.05)。利用Western Blotting检测由睾丸支持细胞合成并分泌的雄激素结合蛋白(ABP)的表达,结果显示过表达或干扰miR-101对ABP的表达并无明显作用(图5C,5 D),说明bta-miR-101对睾丸支持细胞分泌标志基因的转录具有一定的促进作用,但对雄激素结合蛋白的分泌无显着影响。
3 讨 论
睾丸支持细胞是唯一与生殖细胞各阶段直接接触的体细胞,是微环境的组成部分,具有多种生物学功能,主要通过调节生殖细胞生理和营养支持来调节精子的发生。通过对初生期(3日龄)和性成熟期(13月龄)安格斯牛的睾丸组织进行转录组测序,鉴定出在这两个时期差异表达的miR-101,并且与初生期安格斯牛睾丸组织中miR-101的表达量相比,性成熟期miR-101的表达量显着下降,说明miR-101与牛睾丸组织的发育密切相关。本研究对初生期和性成熟期的安格斯牛构建了组织表达谱,对转录组测序结果进行了验证,分析结果表明miR-101在牛初生期睾丸组织中的表达量处于较高的水平,在性成熟后显着下调。除此之外还对miR-101的靶基因进行了预测以及GO和KEGG富集分析,结果显示这些靶基因主要富集在核质、蛋白质结合、JAK-STAT的受体信号通路上。这些信号通路与细胞分化、细胞周期、细胞凋亡等生物过程有着密切联系。因此,本试验针对miR-101对牛睾丸支持细胞增殖、凋亡和分泌的影响进行了探究。
雄性动物中,在青春期前,睾丸支持细胞会分泌一种可以分解视黄酸的酶来抑制精原干细胞分化成为精子,从青春期开始,睾丸支持细胞便不再增殖发育[25],而是通过旁分泌的方式分泌调节因子调控精子的发生过程[26]。支持细胞的数量对可以分化成精子的生殖细胞有着决定作用,在一定程度上,青春期前形成的支持细胞数量与后期所能生成精子的数量成正比[27-28]。本研究结果显示,miR-101对牛睾丸未成熟支持细胞的增殖具有促进作用,对其凋亡具有抑制作用。过表达或干扰miR-101会对与细胞增殖和凋亡相关基因在转录水平的表达造成显着性影响(P<0.05)。在大多数真核生物中,细胞周期是一个受到多种基因调控的复杂动态过程,包含了多个协同事件[29-30]。其中有两个最为重要的阶段,即G1/S期和G2/M期,这两个阶段细胞内分子水平的变化活跃而复杂,非常容易受到环境的影响[31],而G1/S这一转化期受到CDK2、PCNA、CyclinD1、p21等基因的密切调控[32-33],说明miR-101主要通过影响与细胞周期相关基因的表达来促进未成熟支持细胞的增殖。细胞凋亡是受到Bcl2家族、Caspase家族、癌基因与抑癌基因等多基因严格控制的过程。本研究结果显示,miR-101可同时作用于Bcl2、Bax、Caspase9、Caspase3基因,引起其表达量发生变化,其中Caspase和Bcl2家族介导的两个关于细胞凋亡的重要信号通路分别是死亡受体介导的外在信号通路与线粒体和内质网相关内在信号通路[34]。因此miR-101可能综合作用于两种凋亡途径来调控牛未成熟睾丸支持细胞的凋亡。高振[35]研究发现,miR-432可能通过下调其靶基因REM1的表达,从而促进牛睾丸支持细胞的增殖和分泌功能,抑制其凋亡。经统计研究发现,miR-10b[36]、miR-3584-5p[37]、miR-1285[38]、miR-762[39]、miR-196a[40]、miR-133b[41]和miR-301b-3p[37]等可以促进支持细胞的增殖而抑制其凋亡,与本研究结果一致。综上所述,miR-101在牛初生期高表达并促进牛未成熟睾丸支持细胞的增殖,抑制其凋亡,与睾丸支持细胞的发育规律相吻合,进一步印证了miR-101对睾丸支持细胞增殖、凋亡及分泌的调控作用。关于miR-101具体如何调控未成熟支持细胞增殖、凋亡、分泌等过程的途径还需进一步的研究。
值得注意的是,目前关于miR-101的研究大部分集中于肿瘤细胞上,被认为是一种肿瘤抑制因子,已经被证实与多种癌症的发生有着重要联系,由此也说明miR-101在细胞的增殖、凋亡过程中确实发挥着重要作用[42-43]。在肿瘤细胞中,多数研究表明miR-101对肿瘤细胞的增殖有明显的抑制作用。Zhang等[44]研究了miR-101对骨肉瘤的影响,发现其通过下调靶基因BCL6来抑制骨肉瘤细胞的增殖。Han等[45]发现,miR-101可以通过抑制IDH2的表达来升高α-KG浓度,并通过促进HIF1α羟基化降解下调其表达,从而抑制缺氧条件下的Warburg效应来减弱肺癌细胞的增殖。而本研究的结果显示,miR-101对未成熟睾丸支持细胞具有促进增殖的作用,与其在大多数肿瘤细胞中的研究结果有所不同。Qu等[46]研究了miR-101对山羊毛囊干细胞增殖与凋亡的影响,结果显示过表达miR-101可以显着降低毛囊干细胞的凋亡并促进其增殖(P<0.01),这与本研究结果相一致。因此推测,造成这种很差异的原因可能是由于恶性肿瘤细胞相比正常细胞其分化程度、生长速度、生长方式等都已经发生了异变,亦或可能是由于物种或组织之间的差异引起miR-101对两类细胞增殖、凋亡及分泌的影响有所不同,其具体机制还有待进一步探究。
4 结 论
本研究结果表明,miR-101上调增殖相关基因的表达促进牛未成熟支持细胞的增殖,并作用于两条细胞凋亡的信号通路来抑制牛未成熟睾丸支持细胞的凋亡,对雄激素结合蛋白的分泌无显着影响。表明miR-101在牛未成熟睾丸支持细胞的发育中具有重要的调控作用。



