田 睿,徐思翔,谢 烽,刘广锦,王 刚,李庆霞,代 蕾,谢国信,张琼文,陆亚警,王光文,王金秀*,张 炜*
(1.南京农业大学三亚研究院,三亚 572025;2.南京农业大学动物医学院,南京 210095;3.南京农业大学WOAH猪链球菌参考实验室,南京 210095;4.海南省动物疫病预防控制中心,海口 571100;5.昌江黎族自治县畜牧兽医技术服务中心,昌江 572799)
产气荚膜梭菌(Clostridiumperfringens)是梭菌属的一种革兰阳性厌氧菌,由William H. Welch于1891年首次分离[1]。产气荚膜梭菌是引起人类和动物食源性胃肠道疾病的重要厌氧病原菌[2],主要引起动物坏死性肠炎、肠毒血症以及人类的食物中毒和气性坏疽。产气荚膜梭菌由于其产芽胞的特性,对环境具有极强的适应能力,广泛存在于土壤、污水、饲料和粪便中,并在环境中水平传播[3]。据美国疾病控制与预防中心(2019)报告的数据,产气荚膜梭菌是美国最常引起食源性疾病的五种病原体之一;在澳大利亚,产气荚膜梭菌在已确定的肠道食源性病原菌中排名第二[4]。食源性传播是产气荚膜梭菌的主要传播途径之一,牛肉、鸡肉以及其他肉制品是其最重要的传播载体[5],具有重要的公共卫生意义。
产气荚膜梭菌主要通过产生毒素造成畜禽和人类患病,它可产生23种外毒素,是目前已知的产生毒素最多的病原体[6]。根据其主要毒素α(cpa)、β(cpb)、ε(etx)、ι(itx)、cpe和NetB产生能力的差异,分为7种毒素型(A~G)[7]。其中A、B、D型的产气荚膜梭菌均能对牛、羊等反刍动物致病,病畜临床表现为腹部臌气胀大,肝、肾等实质性器官出血,猝死和急性出血性肠炎等症状[8]。由于发病急且病程短,给规模化养殖带来巨大经济损失。其中A型是我国产气荚膜梭菌的主要流行毒素型[9],分布最为广泛且分离率最高,近年来在我国多地出现因感染A型产气荚膜梭菌而导致牛猝死的病例。
海南黄牛是我国优良的地方瘤牛品种,也是中国南方最有代表性品种之一[10]。据记载,海南黄牛的繁育历史已经超过2 000多年。经过长期的选育工作,海南黄牛具有耐粗饲、耐高温、适应性强、繁殖率高、酮体品质好的特点[11],已成为海南省的地方特色品种。本研究对采集自猝死海南黄牛的组织器官进行了产气荚膜梭菌分离鉴定,并对分离到的2株A型产气荚膜梭菌进行了全基因组测序与生物信息学分析。本研究系我国首次对分离自海南黄牛的产气荚膜梭菌基因组进行研究,对海南黄牛产气荚膜梭菌疾病的防控及产气荚膜梭菌基因组的研究具有重要参考价值。
1 材料与方法
1.1 材料
1.1.1 样品来源 样品于2023年3月采集自海南省昌江县某黄牛养殖场中2只急性猝死黄牛,病牛精神沉郁,发病时突然狂叫倒地并四肢划动,于数分钟内死亡,病程极短,表现为最急性型产气荚膜梭菌病的临床症状。死亡黄牛肺部明显充血和实变,其肝部、胸膜、心、心包、胃、小肠、盲肠、肾均有充血与淤血症状。采集肝、肺、肾等具有出血性病变的组织器官置于运输培养基,低温运送至南京农业大学猪链球菌WOAH参考实验室进行细菌厌氧分离鉴定。
1.1.2 主要试剂 细菌基因组DNA提取试剂盒购自天根生化科技有限公司;2×TaqMaster Mix购自南京诺唯赞生物科技有限公司;脱纤维绵羊血购自索莱宝生物科技有限公司;胰胨-亚硫酸盐-环丝氨酸固体培养基(TSC)、液体硫乙醇酸盐培养基(FTG)、D-环丝氨酸溶液均购自青岛海博生物技术有限公司。
1.2 方法
1.2.1 产气荚膜梭菌分离鉴定 参考国标GB 4789.13—2012进行样品处理和产气荚膜梭菌分离。称取适量病料进行组织匀浆,吸取匀浆液加入到灭菌液体硫乙醇酸盐培养基(FTG)中,放置于厌氧环境(85% N2、5% H2、15% CO2),42 ℃厌氧培养12 h。将前增菌培养物低速离心,取上清适度于胰胨-亚硫酸盐-环丝氨酸固体培养基(TSC)进行平板划线,42 ℃厌氧培养12~24 h。挑取黑色圆形菌落于5%绵羊血平板培养基进行二次分离纯化,挑取β溶血环的单菌落,进行革兰染色镜检,产气荚膜梭菌镜检为革兰染色阳性、直短杆状。将疑似菌落在FTG培养基中进行液体增菌,提取细菌基因组并进行毒素的多重PCR检测与鉴定分型,将鉴定纯化后的产气荚膜梭菌分离株冻存于-80 ℃。
1.2.2 分离株毒素分型 产气荚膜梭菌毒素基因cpa、cpb、cpb2、etx、itx、cpe的多重PCR引物见表1[12],由南京擎科生物技术有限责任公司合成。细菌基因组DNA提取参考天根(DP302)说明书进行。多重PCR采用25 μL体系:12.5 μL 2×TaqMix预混液,各毒素上下游引物混合液各1 μL,DNA模板2 μL,双蒸水补至25 μL。反应程序:94 ℃预变性5 min;94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min。
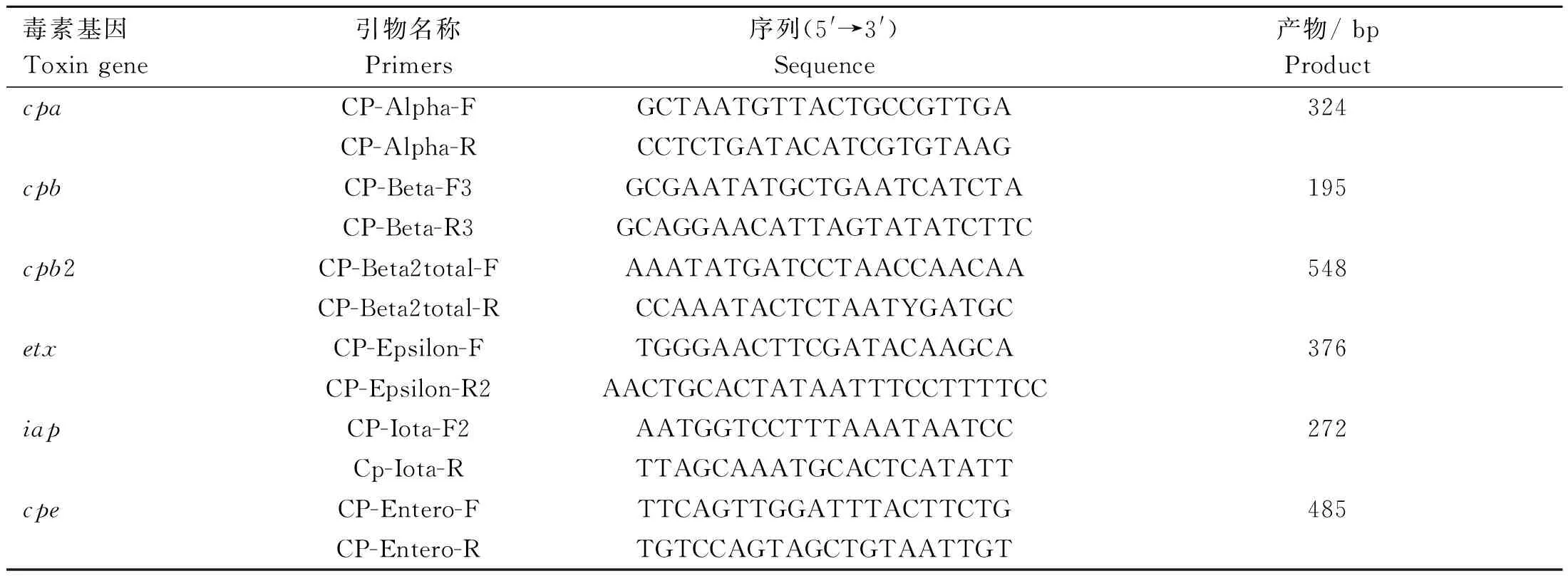
表1 产气荚膜梭菌多重PCR引物Table 1 Multiplex PCR primers for C. perfringens
1.2.3 分离菌株基因组提取与测序 将待测序分离株接种于FTG培养基中过夜厌氧培养10 mL,参考天根细菌DNA提取试剂盒(DP302)说明书方法提取分离菌株基因组,并送至北京诺禾致源科技股份有限公司进行全基因组测序,下机数据使用Unicycler (v0.4.8)进行组装[13]。
1.2.4 基因组注释与分型 使用Prokka (v1.14)和RAST 2.0 (https://rast.nmpdr.org/)对产气荚膜梭菌分离株的基因组进行注释[14],将注释后的产气荚膜梭菌基因组序列上传GenBank数据库。通过CGView Server (http://cgview.ca/)绘制基因图谱,并使用FastMLST (v0.0.15)对分离株进行多位点序列分型。
1.2.5 毒力因子和耐药基因检测 从NCBI数据库中获取27株牛源产气荚膜梭菌基因组,并与本研究中2株分离株的基因组在毒力因子数据库(VFDB, http://www.mgc.ac.cn/VFs/)和耐药基因数据库(CARD, https://card. mcmaster.ca/)中对以上基因组的毒力因子和耐药基因进行检索分析。
1.2.6 泛基因组与系统进化分析 将本研究分离株与NCBI数据库中共计29株牛源产气荚膜梭菌基因组通过Roary (v3.13)进行泛基因组分析[15],对核心基因组和α毒素中plc基因首先通过Seqkit(v0.15)进行目标基因的提取整理,再通过MEGA7使用Clustalw进行系统发育进化树的构建。
2 结 果
2.1 细菌分离鉴定及毒素分型
本研究从猝死黄牛的肝和肺部中分离到2株产气荚膜梭菌,分离株在42 ℃厌氧条件下培养24 h后,在TSC平板上呈黑色圆形菌落且边缘伴有半透明菌环,在5%绵羊血平板呈具有β溶血环的半透明光滑圆形菌落,革兰染色镜检为革兰染色阳性、直短杆状,经毒素分型鉴定均为A型,且均具有cpa、cpb2毒素基因(图1)。
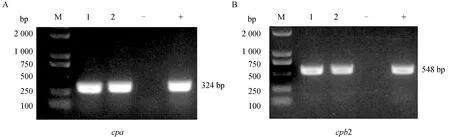
M. Trans2K DNA相对分子质量标准;1. ZWCP209;2. ZWCP210;-. 阴性对照;+. 阳性对照M. Trans2K DNA marker; 1. ZWCP209; 2. ZWCP210; -. Negative control; +. Positive control图1 产气荚膜梭菌毒素分型电泳图Fig.1 Electrophoresis pattern of C. perfringens toxin typing
2.2 分离菌株基因组信息
将2株牛源产气荚膜梭菌进行全基因测序,基因组序列已上传至NCBI数据库(表2)。分离菌株的基因组大小在3.4~3.5 Mb之间,平均每个基因组中含有89个tRNA以及3 215个基因编码区(CDS),具体信息如基因图谱所示(图2)。多位点序列分析(MLST)显示,菌株属于同种的ST型,且该ST型尚未被报道(表3)。
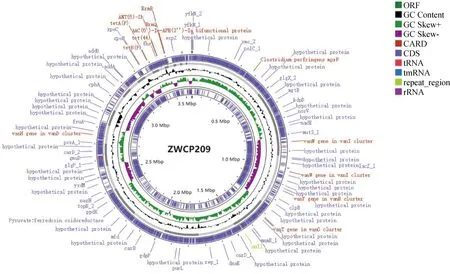
图2 产气荚膜梭菌分离株ZWCP209基因图谱Fig.2 Genetic profile of Clostridium perfringens isolate ZWCP209

表2 产气荚膜梭菌分离株基因组信息Table 2 Genomic information of C. perfringens isolates

表3 产气荚膜梭菌分离株多位点等位基因信息Table 3 Multilocus allele information of C. perfringens isolates
2.3 分离株毒力因子与耐药基因分析
在本研究分离株和NCBI数据库共29株的牛源菌株基因组中,共检测到13种毒力因子,其中12种毒力因子在本研究的2株分离株中均被检测到(图3A)。仅1株检测到毒力因子etx,所有菌株中均未检测到食源性毒素cpe。其中nagH、nagI、nagJ、nagK、nagL是透明质酸酶相关的毒力因子,可以促进透明质酸和硫酸软骨素等多糖的降解[16],降低结缔组织内基质的黏度,使病原菌扩散到更深的组织中,在产气荚膜梭菌定植肠黏膜的过程中起到重要作用。
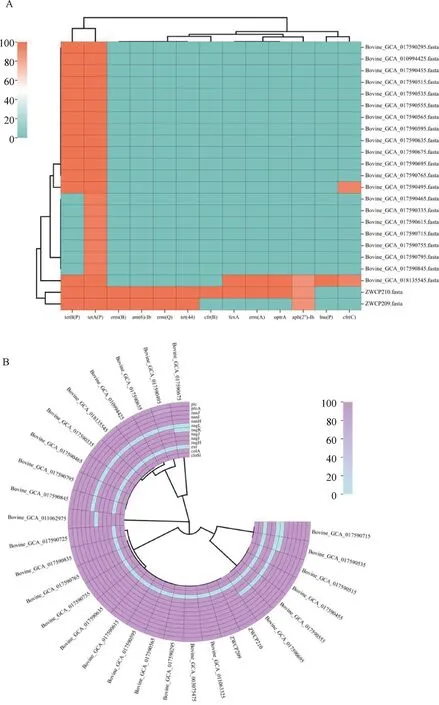
A.29株牛源产气荚膜梭菌耐药基因图谱;B.29株牛源产气荚膜梭菌毒力因子图谱A. Drug resistance gene profiles of 29 strains of C. perfringens isolated from cattle; B. Virulence factor profile of 29 strains of C. perfringens isolated from cattle图3 牛源产气荚膜梭菌耐药基因及毒力因子检测Fig.3 Detection of drug resistance genes and virulence factors of C. perfringens isolated from cattle
在以上菌株的基因组中共检测到13种耐药基因,其中四环素类耐药基因tetA(P)和tetB(P)的携带率最高(79.3%),而来自数据库中的6株产气荚膜梭菌并未检测到耐药基因。值得关注的是,分离株ZWCP209和ZWCP210均携带了7种以上耐药基因(图3B),包括氨基糖苷类耐药基因ant(6)-Ib、aph(2″)-Ih,利奈唑胺耐药基因cfr(B),大环内酯类耐药基因erm(A)、erm(Q)、erm(B),氟苯尼考耐药基因fexA,唑烷酮耐药基因optrA以及四环素类耐药基因tet、tetA(P)、tetB(P)。
2.4 泛基因组与系统进化分析
将本研究分离株与NCBI数据库共29株牛源产气荚膜梭菌进行泛基因组分析,结果显示以上菌株的基因组中共含有7 345个基因,包括1 424个壳基因和3 951个云基因,其中核心基因数量为1 685,占比22.94% (图4A)。将泛基因组中较为保守的核心基因组部分构建系统发育进化树,结果显示,分离株ZWCP209和ZWCP210处于同一分支,具有较近的进化关系(图4B)。
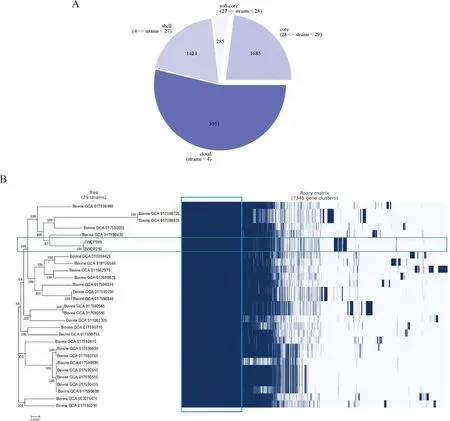
A.牛源产气荚膜梭菌泛基因组基因数量分布图;B.核心基因组系统发育进化树A. Pan-genome gene distribution map of bovine C. perfringens; B. Phylogenetic tree of the core genome图4 牛源产气荚膜梭菌泛基因组与核心基因组系统进化分析Fig.4 Phylogenetic analysis of the pan-genome and core genome of C. perfringens from cattle
所有毒素型的产气荚膜梭菌均能产生α毒素,其中plc基因负责编码磷脂酶C是组织溶血感染中最重要的毒力因子,是影响菌株酶活性与毒力的关键基因[17-18]。本研究对以上29株产气荚膜梭菌的plc基因建立系统发育树,并计算不同基因组间plc基因的遗传距离。结果显示plc基因在不同的产气荚膜梭菌中具有高度保守性(图5),plc基因的系统发育进化树显示,分离株ZWCP209和ZWCP210处于同一分支,与核心基因组进化关系相对应。
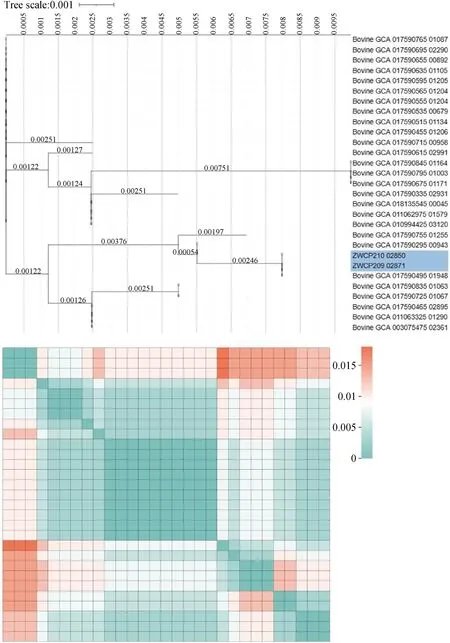
图5 牛源产气荚膜梭菌plc基因系统进化分析Fig.5 Phylogenetic analysis of plc genes of C. perfringens from cattle
3 讨 论
牛产气荚膜梭菌病自20世纪90年代以来日趋严重,发病规模和发病地区呈不断扩大,目前已广泛流行于全国各地,给养牛业造成了巨大的经济损失,严重危害中国畜牧业的发展[19]。产气荚膜梭菌能使各年龄、多品种的牛发病,且病程短,死亡率极高。同时其作为食源性病原,通过肉制品传播导致人类食物中毒,对公共卫生造成巨大威胁。
值得关注的是,在本研究中的菌株均分离自肝和肺等实质性器官。由于产气荚膜梭菌是肠道常在菌[20],其在肠道和粪便中的数量会明显高于其他部位。除典型病症和特殊毒素型外,难以区分肠道或粪便中所分离的产气荚膜梭菌是否为主要致病细菌。但在本研究中,作者从具有典型出血性病变的实质性器官中成功分离到产气荚膜梭菌,结合病畜的主要临床症状,可以判定产气荚膜梭菌是黄牛猝死的主要病原。产气荚膜梭菌是目前已知生长最快的微生物之一,繁殖速度是大肠杆菌的数倍[21],其芽胞对高温环境具有极强的适应能力。在夏季,畜禽从垫料、土壤或粪便等环境将产气荚膜梭菌孢子食入消化道,孢子在肠壁迅速定殖并产生大量毒素和有害气体,并快速扩散至其他器官,导致动物的急性死亡,因此在高温养殖环境中需格外注意环境中产气荚膜梭菌的消毒防控。
全基因组分析能够从基因水平阐述病原菌毒力和耐药性等表型特征,对细菌病原的精准防控和治疗具有重要意义[22]。目前产气荚膜梭菌主要依据产生毒素进行分型,但同种毒素型菌株之间的毒力和生物学特性仍存在一定差异。多位点序列分型(MLST)通过选取8个管家基因可以对已确定毒素型的产气荚膜梭菌进行了二次分型[23],对研究产气荚膜梭菌的分子流行病学研究具有重要意义。但目前对产气荚膜梭菌ST型的研究有限,本研究中分离株ZWCP209和ZWCP210均属于同一新ST型,尚未见报道,为PubMLST等数据库中牛源产气荚膜梭菌分型提供数据参考。在进化关系方面,两分离株在核心基因组和plc基因的系统进化树中均处于同一分支,具有极为相近的进化关系。
在耐药基因方面,大多数菌株(79.4%)只携带四环素耐药基因tetA(P)和tetB(P),且部分菌株没有耐药基因,这表明在开展饲料端禁抗以来,动物源产气荚膜梭菌的耐药情况得到了一定程度的控制。值得关注的是,尽管两分离株分离自同一养殖场,但其耐药基因却具有很大的差异,其中分离株ZWCP209只携带了四类抗生素的耐药基因,而分离株ZWCP210同时携带了氨基糖苷类耐药基因aph(2″)-Ih、利奈唑胺耐药基因cfr(C)、大环内酯类耐药基因erm(A)、氟苯尼考耐药基因fexA、林可霉素耐药基因lnu(P)、唑烷酮耐药基因optrA以及四环素类耐药基因tetA(P)、tetB(P)。其中唑烷酮是临床上治疗由耐甲氧西林金葡菌(MRSA)、耐万古霉素肠球菌(VRE)和耐青霉素肺炎球菌等具有多重耐药性的革兰阳性菌所引起感染的有效抗菌药物[24]。目前唑烷酮仍属于非兽用抗生素,其耐药基因在牛产气荚膜梭菌中出现一定程度表明耐药基因optrA在人和牛源的细菌之间出现了传播,这一现象曾在羊源和鸡源的产气荚膜梭菌中出现[25-26],在牛源产气荚膜梭菌中尚未出现报道。此类携带有多种耐药基因的产气荚膜梭菌会对养殖行业和公共卫生造成巨大的威胁[27],只有合理规范使用抗生素才能减缓病原菌的耐药情况并有效控制耐药基因在人与动物间的传播。
4 结 论
本研究从猝死海南黄牛的组织样品中分离到2株A型产气荚膜梭菌并进行全基因组测序,其基因组大小、tRNA和CDS数量稳定,属于同一新ST型。在对不同来源的29株牛源产气荚膜梭菌基因组进行生物信息学分析后发现:在以上基因组中共检测到13种毒力因子和13种耐药基因,其中海南黄牛分离株ZWCP210携带了包括唑烷酮optrA等11种耐药基因,且两海南黄牛分离株在核心基因组和plc基因的进化关系中均具有高度同源性。本研究为国内首次对海南黄牛A型产气荚膜梭菌进行全基因组序列测定与生物信息学分析,对牛产气荚膜梭菌病的防治与生物信息学研究提供参考。



