张 帅,陈奎蓉,许 迪,江 山,王梦影,张 坤,徐玉培,雷国凤,张志程,郭 猛,赵云翔,*,兰干球*,梁 晶*
(1.广西大学动物科学技术学院 广西畜禽繁育与疾病防控重点实验室,南宁 530004;2.广西扬翔股份有限公司,贵港 537100)
畜牧业是国家发展的重要基石,在西方发达国家农业经济中,畜牧业发展占总体70%左右。猪是人类最早驯化的家养动物,同时也是肉类产品的主要来源[1]。截止到2019年,全球猪肉消费量达到新高,占总肉类消费的33%,据推测,到2060年,全球人口将急剧增长,这也意味着人类对猪肉需求量会更高。如何快速提高猪肉生产,满足人类需求已经成为全世界亟待解决的问题[2]。
在整个养猪过程当中,饲料成本约占养猪成本的60%,猪的饲料利用效率在很大程度上影响着养殖生产和总体经济效益[3],因此提高饲料转化率是目前猪育种工作的一项重要任务。目前,衡量饲料利用效率的指标有两个:剩余采食量(residual feedintake,RFI)和饲料转化率(feed conversion rate,FCR)[4],RFI是实际采食量与预期采食量之间的差值[5];FCR在猪饲养中统称为“料肉比”,即平均日采食量与平均日增重的比值(ADFI/ADG)[6]。随着自动喂料系统的发展,猪饲料转化率记录更加准确,使得猪育种工作更加方便快捷[7]。
饲料转化率受多个因素影响。研究表明,猪饲料转化率受到肠道微生物活性和组成的影响[8],特别是肠道微生物能够利用宿主不能消化的碳水化合物。例如纤维素和抗性多糖,其先被微生物降解为单糖或二聚糖,再经过发酵形成短链脂肪酸(SCFAs)[9],这些代谢产物能被宿主吸收,并提供能量[10]。基于16S rRNA发现梭状杆菌(Cloacibacillus)、幽门螺杆菌(Helicobacter)和振荡杆菌(Oscillibacter)在低FCR的鸡中更为丰富[11],Tan等[12]研究发现,高FCR猪的普雷沃氏菌CAG:604在盲肠显着富集;McCormack等[13]研究发现,低RFI猪肠道微生物某些特定菌增加与健康和饲料效率有关。寻找到更多的与FCR相关的肠道微生物有助于揭示微生物功能与宿主的生理和代谢之间的关系,使得FCR表征更加全面。
目前仍然不清楚,肠道微生物如何影响猪饲料转化率。本研究通过微生物16S rRNA基因测序技术,对高、低饲料转化率猪粪便微生物的组成结构差异进行对比分析,旨在探究猪粪便中的微生物与猪饲料转化率之间可能存在的关联。这些微生物可能作为一种生物标记物,为在育种中应用微生物标记提高猪饲料转化率的实践提供一定的理论基础。
1 材料与方法
1.1 动物和试验设计
本研究中使用的猪均来自广西扬翔股份有限公司。选择健康状况良好、断奶批次相同、体重接近(23~27 kg)的三元杂交母猪384头,于断奶后转至同一栋大型猪舍中饲养,每栏饲养12~15头,饲喂不含抗生素或药物的标准玉米-豆粕型饲料,自由采食和饮水。利用自动喂料系统(HAMOER Technology Co.;Ltd., Tianjin)在猪进食时识别其电子耳标并测定猪的采食量和体重,计算90~165日龄期间的FCR值。将试验猪的FCR值从高到低进行排序,选择FCR极端高、低个体各10头,分别定义为HFCR组和LFCR组。为减少环境因素对肠道微生物测序结果的影响,试验猪达到170日龄时在测定栏位采集粪便,时间限定在上午8:00—10:30之间。为防止采样时猪产生应激情况,使用一次性PE手套接取肛门内的粪便样品,清理表面后置于冻存管内并放入液氮中保存,后转入实验室-80 ℃冰箱长期保存用于后续分析。
1.2 粪便微生物分析
1.2.1 微生物总DNA提取和PCR反应 使用QIAamp Fast DNA粪便提取试剂盒(51604;Qiagen,德国)从每头猪粪便样本中分离并收集总细菌DNA。提取完成后,用Qubit检测DNA浓度,用1%琼脂糖凝胶电泳检测抽提DNA的完整度。利用带有barcode的特异引物341F(5′-CCTACGGG-NGGCWGCAG-3′)和806R(5′-GGACTACHVGG-GTWTCTAAT-3′)进行PCR扩增得到16S V3-V4扩增子区域。PCR条件为:95 ℃预变性3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 15 s,从第二步开始25个循环;72 ℃延伸5 min,4 ℃保存。PCR扩增完成后,用磁珠对产物进行纯化,用Qubit检测产物浓度, 并用1.5%琼脂糖凝胶电泳检测PCR产物大小是否与预期相符,PCR产物目的条带大小正确,浓度≥2 ng·μL-1,可进行后续试验。
1.2.2 文库构建和数据预处理 对上述PCR产物进行混样建库,加上测序接头,进行PCR扩增后用磁珠分选去掉引物二聚体等小片段,并记录文库index信息。反应条件:98 ℃预变性45 s;98 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,8个循环;72 ℃延伸10 min,4 ℃保存。使用Qubit对文库浓度进行定量并计算浓度,文库浓度≥4 nmol·L-1,可正常上机。文库检测合格后,按照有效浓度要求将不同文库 pooling后上机测序,扩增子测序平台为Illumina Miseq(MiSeq;Illumina Inc.,美国),测序策略为PE250。测序数据Q30(%)>85%满足下机要求,下机数据根据双端barcode拆分数据,并切除barcode信息,切除双端引物后的测序序列进行扩增子流程分析。
1.2.3 扩增子流程分析 扩增子生物信息学采用EasyAmplicon v 1.0进行分析[14]。原始的Illumina fastq文件经过质控(错误率小于1%)后,使用VSEARCH去冗余设置参数为min_unique_size 为59,采用Usearch对AVSs进行100%相似度比较,然后去掉其中的质体和非细菌,设置参数为:sintax_cutoff 0.1。用Vegan包过滤低丰度ASVs后将所有样本以最小序列条数抽平获得ASVs丰度表。根据SILVA数据库(https://www.arb-silva.de/)进行物种注释,物种注释结果用于扩增子分析[15]。
α多样性指数计算采用Vegan包,使用抽平后的数据得出Richness、Chao1、ACE、Shannon、Simpson和Invsimpson指数。基于bray_curtis距离绘制主坐标分析(PCoA)图。用柱状图展示top 5门水平高丰度菌、top 11科水平高丰度菌。使用LEfSe(Linear discriminant analysis Effect Size,线性判别分析)分析筛选LDA>3的属作为两组差异菌属进行讨论。使用PICRUSt对两组粪便微生物菌群功能进行预测[16],STAMP软件展示两组微生物功能有何差异。
1.3 统计分析
采用SPSS(version 26.0; SPSS Inc., USA)分析20头猪表型差异,结果均用“平均数±标准差(mean±SD)”方式表示。采用T-test检验计算P值,P<0.05表示差异显着,P<0.01表示差异极显着。使用SPSS软件中的Spearman相关检验计算表型与差异菌群之间相关性。
2 结 果
2.1 高、低饲料转化率猪表型差异
高、低饲料转化率猪生长性状见表1。与HFCR组相比,LFCR组的ADG显着提高(P<0.01),而ADFI和FCR都显着低于HFCR组(P<0.01)。
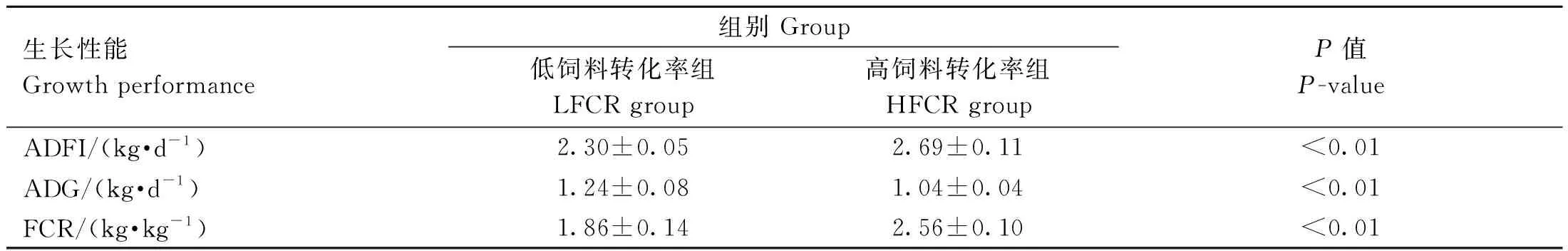
表1 高、低饲料转化率猪的生长性能Table 1 Growth performance of pigs with high and low feed conversion rates
2.2 高、低饲料转化率猪粪便微生物α多样性分析
α多样性主要用于表示物种丰富度和均匀度的指标,结果表明(表2),LFCR组的Richness、Chao1和ACE指数都显着高于HFCR组(P<0.01)。而LFCR组的Shannon指数高于HFCR组,但没有达到显着性差异。
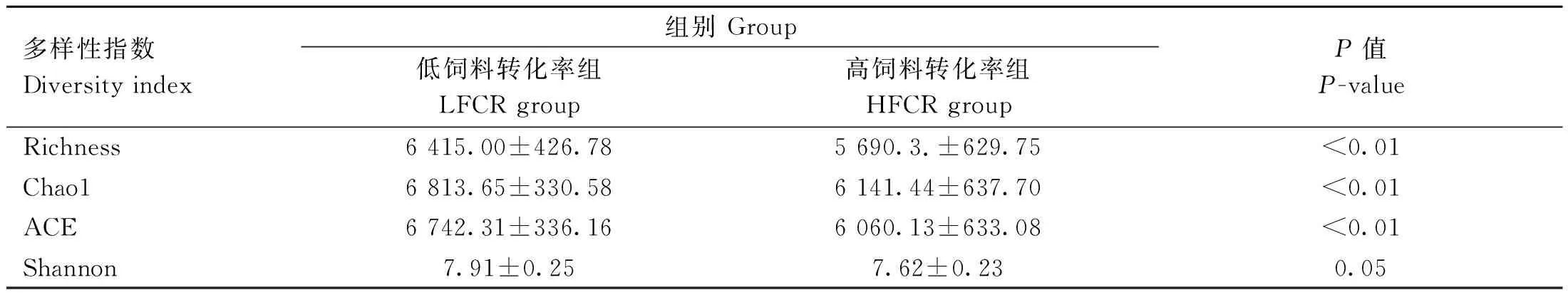
表2 高、低饲料转化率猪的粪便微生物α多样性指数Table 2 Feces microbial α-diversity index of pig with high and low feed conversion rates
2.3 高、低饲料转化率猪粪便微生物β多样性分析
基于Bray_Curtis距离计算出高低饲料转化率猪粪便微生物的结构相似性情况。PCo1的解释率为28.48%,PCo2的解释率为18.38%,高、低饲料转化率猪粪便微生物分布呈现左右分离状态,且解释率之和大于40%,表明高低饲料转化率分组间粪便微生物的整体组成结构差异较大(图1)。
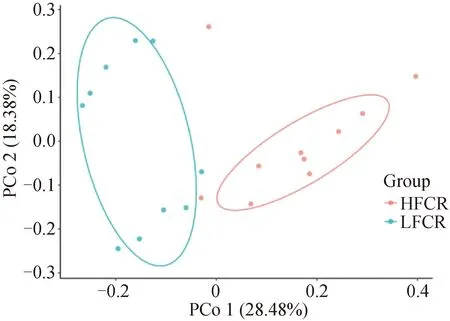
图1 高、低饲料转化率猪的粪便微生物β多样性分析Fig.1 Feces microbial β diversity analysis of pig with high and low feed conversion rates
2.4 高、低饲料转化率猪粪便微生物物种组成分析
物种堆叠图主要用于展示不同组之间物种组成的差异。在门水平上(图2)平均相对丰度排名前5的分别是:厚壁菌门(Firmicutes),各组相对丰度为:LFCR=45.36%,HFCR=60.65%;拟杆菌门(Bacteroideta),各组相对丰度为:LFCR=30.09%,HFCR=20.34%;广古菌门(Euryarchaeota),各组相对丰度:LFCR=10.55%,HFCR=9.31%;螺旋体菌门(Spirochaetae),各组相对丰度为:LFCR=5.38%,HFCR=2.80%;放线菌门(Actinobacteria),各组相对丰度为:LFCR=1.86%,HFCR=2.49%。
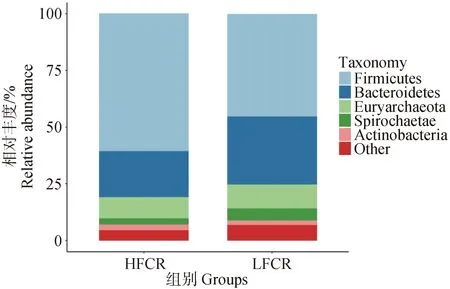
图2 高、低饲料转化率猪粪便微生物的门水平物种组成Fig.2 Phylum level species composition of microorganisms in feces of pigs with high and low feed conversion rates
在科水平上(图3),平均相对丰度前11的菌群主要为以下几种,瘤胃球菌科(Ruminococcaceae),各组相对丰度为:LFCR=14.96%,HFCR=12.67%。拟杆菌_S24-7(Bacteroidales_S24-7),各组相对丰度为:LFCR=11.91%,HFCR=12.64%。链球菌科(Streptococcaceae),各组相对丰度:LFCR=7.32%,HFCR=13.21%。甲烷杆菌科(Methanobacteriaceae),各组相对丰度:LFCR=10.54%,HFCR=9.31%。毛螺菌科(Lachnospiraceae),各组相对丰度:LFCR=7.74%,HFCR=11.38%。普氏菌科(Prevotellaceae),各组相对丰度:LFCR=13.88%,HFCR=4.22%。乳酸杆菌科(Lactobacillaceae),各组相对丰度:LFCR=5.16%,HFCR=8.12%。螺旋体科(Spirochaetaceae),各组相对丰度:LFCR=5.38%,HFCR=2.80%。丹毒丝菌科(Erysipelotrichaceae),各组相对丰度:LFCR=1.86%,HFCR=5.26%。氨基酸球菌科(Acidaminococcaceae),各组相对丰度:LFCR=2.82%,HFCR=3.33%。理研菌科(Rikenellaceae),各组相对丰度:LFCR=2.40%,HFCR=2.28%。
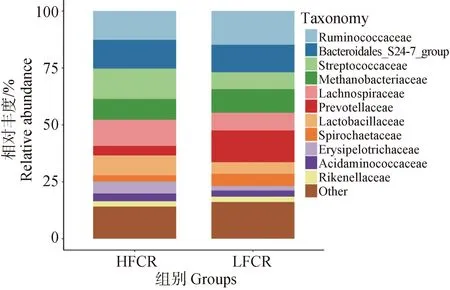
图3 高、低饲料转化率猪粪便微生物的科水平物种组成Fig.3 Family level species composition of microorganisms in feces of pigs with high and low feed conversion rates
2.5 LEfSe分析筛选高、低饲料转化率猪粪便微生物属水平差异
LEfSe分析主要可以对两组或多组进行比较,从而找出组间在丰度上具有显着差异的物种。在属水平上,筛选平均相对丰度大于0.5%的属进行LEfSe分析,结果如图所示(图4)。在LFCR组LDA值大于3的属有:Prevotella_1、Treponema_2、Prevotellaceae_NK3B31_group、Eubacterium_coprostanoligenes_group、p-1088-a5_gut_group、Prevotella_9、阿克曼菌属、Prevotellaceae_UCG_003、Ruminococcaceae_UCG-014、Ruminococcaceae_NK4A214_group。在HFCR组LDA值大于3的属有:巨球藻属、小类杆菌属、链型杆菌属、假丁酸弧菌属、柯林斯氏菌、Solobacterium、罕见小球菌属、链球菌属。
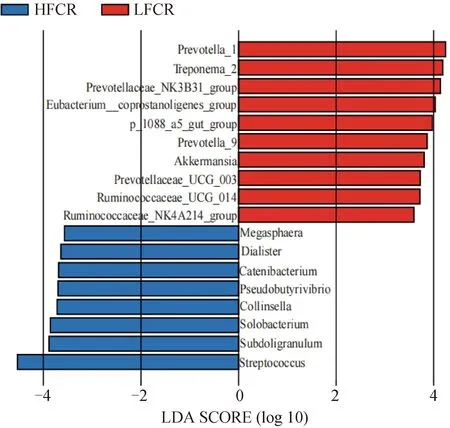
图4 利用LEfSe分析筛选高、低饲料转化率猪粪便中的差异微生物属Fig.4 Using LEfSe analysis to screen differential microbial genera in feces of pigs with high and low feed conversion rates
2.6 PICRUSt预测高、低饲料转化率猪粪便微生物功能差异
PICRUSt可以用于细菌功能预测。在LFCR组的铁载体组非核糖体肽的生物合成、氮素代谢、脂质生物合成蛋白、转录机制、PPAR信号通路、蛋白质消化吸收、鞭毛组装、细菌运动蛋白、乙苯基降解、苯丙氨酸代谢、萜、哌啶和吡啶生物碱的生物合成、叶酸合成、霍乱弧菌致病周期、维生素B6代谢、谷氨酸能突触、脂多糖生物合成蛋白、脂多糖生物合成和叶绿醇降解17个功能较强。而HFCR组的硫胺素代谢、磷酸转移酶系统、糖酵解/异生、原发性免疫缺陷4个功能较强(图5)。
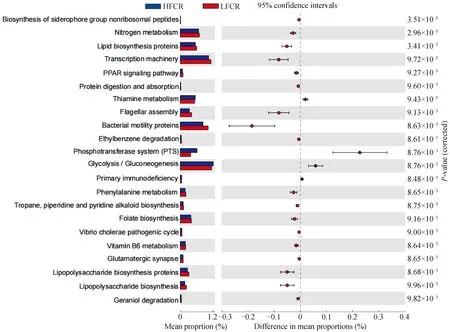
图5 利用PICRUSt预测高、低饲料转化率猪粪便微生物的功能差异Fig.5 Using PICRUSt to predict microbial functional differences in feces of pigs with high and low feed conversion rates
2.7 高、低饲料转化率猪粪便微生物差异菌属与生长性状关联分析
将两组猪生长性状和差异微生物进行Spearman相关性分析用于寻找影响饲料转化率的微生物(图6)。与FCR值呈显着负相关的微生物有:Prevotella_1(r=-0.789,P<0.001)、Treponema_2(r=-0.548,P=0.012)、Prevotellaceae_NK3B31_group(r=-0.681,P<0.001)、Eubacterium_coprostanoligenes_group(r=-0.848,P<0.001)、p-1088-a5_gut_group(r=-0.54,P=0.014)、Prevotella_9(r=-0.503,P=0.024)、阿克曼菌属(r=-0.561,P=0.015)、Prevotellaceae_UCG_003(r=0.685,P<0.001)、Ruminococcaceae_UCG-014(r=-0.55,P=0.012)、Ruminococcaceae_NK4A214_group(r=-0.59,P<0.01)。与FCR值呈显着正相关的微生物有:巨球藻属(r=0.52,P=0.019)、柯林斯氏菌(r=0.74,P<0.001)、Solobacterium(r=0.728,P<0.001)、罕见小球菌属(r=0.5,P=0.025)、链球菌属(r=0.628,P<0.01)。
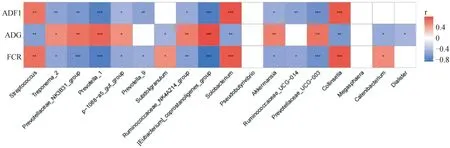
红色代表正相关,蓝色代表负相关。*代表P<0.05,**代表P<0.01,***代表P<0.001Red represents positive correlation,while blue represents negative correlation。* Represents P<0.05,** represents P<0.01, and*** represents P<0.001图6 粪便微生物与生长表型的相关性分析Fig.6 Correlation analysis between fecal microorganisms and growth phenotype
3 讨 论
LFCR组猪的日采食量较低而日增重较高,通俗讲为“吃的少,长得快”的猪。这类猪不仅对饲料的需求少同时生长速率较快。因为这类猪有利于降低企业生产成本增加效率,故常在猪育种中被留种。探究影响猪饲料转化率的潜在因素,是目前猪育种工作关注的重心。
3.1 粪便微生物多样性与猪饲料转化率的关系
微生物α多样性指数用于反映微生物群落的丰富度和均匀性。有研究表明,微生物多样性与猪生长性能存在联系[17]。Tan等[18]研究表明,LFCR猪的肠道微生物α多样性比HFCR猪更为丰富,这与本研究一致。Metzler-Zebeli等[19]发现,低RFI猪的盲肠微生物多样性也高于高RFI猪。本研究中,LFCR组的Richness、Chao1和ACE指数显着高于HFCR组。这表明LFCR组的粪便中存在更为多样化的微生物群落和有益菌,可能促进了猪的健康状态或提高了代谢水平,从而有助于提高饲料转化率。
3.2 LEfSe分析揭示高、低饲料转化率猪粪便微生物的组成及潜在功能差异
本研究通过LEfSe分析了高、低饲料转化率猪粪便微生物组成差异。Eubacterium_coprostanogenes_group属于真菌属,有研究表明,其可以产生短链脂肪酸作为肠上皮中的特殊营养物质和能量成分,保护肠黏膜屏障,降低人体炎症水平,增强胃肠动力[20]。Prevotella_1、Prevotella_9、Prevotelaceae_NK3B31_group和Prevotellaceae_UCG-003属于普雷沃氏菌科,是猪肠中纤维降解菌的主要类型之一,参与果胶和蛋白质的代谢[21]。Prevotella_1可以降解半纤维素或木聚糖,为身体提供能量[22]。Prevotellaceae_UCG-003具有调节肠道功能的潜力,可降解纤维多糖产生短链脂肪酸[21]。然而,Xue等[23]发现,高RFI组绵羊瘤胃中Prevotella_1和Prevotellacea-UCG-003的相对丰度较高,这与本试验结果相反。可能的原因是Prevotell_1在反刍动物和单胃动物中发挥作用不同所导致。Jiang等[24]发现Prevotelaceae_NK3B31_group在断奶仔猪粪便中的丰度较高,并且与乙酸、丙酸和总SCFAs的浓度呈正相关,表明Prevotelaceae_NK3B31_group可以产生SCFAs。
Ruminococcaceae_UCG-014和Ruminococcaceae_NK4A214属于瘤胃球菌科。瘤胃球菌科成员具有纤维素降解和半纤维素降解活性,可产生乙酸盐、丁酸盐、甲酸盐和氢气。在一项研究中发现,Ruminococcaceae_UCG-014在低RFI牛瘤胃中丰度较高,这与本研究结果相似[21]。有研究证实,Ruminococcaceae_UCG-014可以产生丁酸[25]。阿克曼菌属已被确定为与体重增加相关的重要粪便生物标志物[26]。在绝经后妇女中,阿克曼菌属与胰岛素抵抗和血脂异常呈负相关[27]。肥胖个体的粪便中阿克曼菌属显着减少[28]。也有研究表明,阿克曼菌属可以降解黏蛋白,也是短链脂肪酸的生产者[29]。这些真菌属、普雷沃氏菌和瘤胃球菌在LFCR组粪便中大量存在,可能是它们可以产生大量短链脂肪酸为机体供给能量所以提高了猪的饲料转化率。
在人类研究中发现,柯林斯氏菌与肥胖和动脉粥样硬化有关[30]。同样,在高胆固醇血症患者的粪便中也发现了较多的柯林斯氏菌[31]。Lahti等[32]研究表明柯林斯氏菌和甘油三酯之间存在显着的正相关性。Solobacterium属于丹毒丝菌科,研究表明丹毒科在肥胖患者和炎症性肠病患者中发挥着重要作用[33];另外一项研究揭示,Solobacterium是结直肠癌癌症的标志性微生物群,在结直肠癌癌症患者的粪便中具有更高的丰度。链球菌是猪的常见病原体,不仅被认为是人类的人畜共患病原体,也是抗生素耐药性的主要宿主,可以将耐药性基因传递给其他致病性链球菌物种[34]。研究指出,罕见小球菌属与抑郁症患病概率之间存在显着的正相关[35]。这些菌在HFCR组显着富集,提示HFCR组可能存在大量致病菌,这些致病菌破坏了机体健康所以造成了饲料转化率低。假丁酸弧菌属在大肠后部显着富集,并与短链脂肪酸含量呈正相关[36]。在一项研究中,发现HFCR长白猪盲肠中的假丁酸弧菌属和巨球藻属显着富集,因为它们可以代谢乳酸产生游离脂肪酸[37],令人感兴趣的是,为什么这些产短链脂肪酸的细菌会在HFCR组显着富集。
3.3 与猪饲料转化率相关的粪便微生物及其在育种中的应用前景
Eubacterium_coprostanogenes_group、Prevotella_1、Prevotella_9、Prevotelaceae_NK3B31_group、普Prevotellaceae_UCG-003、Ruminococcaceae-UCG-014、Ruminococcaceae_NK4A214和阿克曼菌属,这些菌都具有产短链脂肪酸的能力与FCR值呈显着负相关,可能产生的短链脂肪酸供给机体所以LFCR饲料转化率高。而柯林斯氏菌、Solobacterium、罕见小球菌属和链球菌都与疾病发生有关且与FCR值呈显着正相关,可能是因为这些致病菌在肠道大量存在,破坏了肠道内环境,损坏机体健康因此降低了饲料转化率。有研究表明,肠道微生物和粪便微生物具有显着差异[38],肠道菌群更能反映宿主的系统发生关系,而粪便微生物只能反映宿主的饮食代谢情况。肠道菌群能够影响的不仅有营养物的消化吸收,还会影响大脑活动。肠道菌群失衡会破坏人体的诸多系统,还会导致肥胖、营养不良甚至癌症[39]。因此,用粪便微生物与生长表型进行相关性分析,也只能说明两者之间存在显着相关性,不能直接说明其存在因果关系。本研究筛选到的粪便微生物如何调控饲料转化率,仍需要进一步的试验探究。而粪便微生物有望作为一种易于检测的分子标志物,为动物育种时辅助筛选优良性状个体提供一定参考。
4 结 论
本研究通过采集20头高、低饲料转化率的三元杂交母猪的粪便样品,利用16S rRNA测序技术分析两组间粪便微生物的组成与结构差异。结果显示,低饲料转化率组的粪便微生物α多样性显着高于高饲料转化率组。进一步分析发现,低饲料转化率组富集了大量产生短链脂肪酸的微生物,而这些微生物与饲料转化率值呈显着负相关。相反,高饲料转化率组的粪便中富集了大量的致病菌,这些菌与饲料转化率值呈显着正相关。最终,本研究鉴定了一些与饲料转化率相关的粪便微生物,这些微生物有望成为分子标记物,为促进猪育种进展、改善猪饲料转化率提供一定的理论基础。



