王家丽,杨 帆,邵文华,黄梦瑶,曹伟军,蒲秀瑛, 张 伟*,郑海学,3*
(1.中国农业科学院 兰州兽医研究所 兰州大学动物医学与生物安全学院 动物疫病防控全国重点实验室国家口蹄疫参考实验室,兰州 730000;2.兰州理工大学 生命科学与工程学院,兰州 730050;3.甘肃省病原生物学基础学科研究中心,兰州 730046)
Toll相互作用蛋白(Tollip)是Toll样受体(TLR)相关信号蛋白,在TLR信号通路中作为内源性调节因子[1],也在一系列信号通路中充当重要的负调节因子,是一种模块化蛋白,具有Myb1(Tom1)N端靶标结合结构域(TBD)、中央保守2(C2)结构域和泛素与内质网降解(CUE)结构域的C端偶联。Tollip是先天性白细胞中的一种稳态调节因子,负责协调巨噬细胞极化以减轻炎症[2]。
有研究表明,Tollip通过促进自噬实现其稳态功能[3]。通过减少表达或改变细胞定位来参与自噬、细胞应激和炎症的破坏[4]。Tollip基因的遗传多态性与多种细菌和原生动物疾病有关[5]。此外Tollip在肠黏膜炎症、α-疱疹病毒、冠状病毒、甲型流感病毒、登革热病毒、HIV病毒、非洲猪瘟病毒等方面有广泛的研究, 然而,它在口蹄疫中的作用尚不清楚,相关研究甚少,为此,作者在PK-15细胞上构建Tollip缺失细胞系,研究Tollip的缺失对FMDV复制的影响,为后续Tollip功能研究及抗病毒机制研究提供理论依据。
口蹄疫病毒(foot-and-mouth disease virus,FMDV)是单股正链RNA病毒,属于小RNA病毒科口蹄疫病毒属。FMDV与其他小RNA病毒相比,具有广泛的宿主嗜性,可以感染家养和野生的偶蹄动物[6]。FMDV的快速和广泛传播对动物健康和肉食品安全产生重大影响,并给全球畜牧业带来重大经济损失[7]。FMDV 基因组 ORF 编码一个多聚蛋白,经逐级降解,产生多个中间蛋白和约 12 个成熟蛋白。中间和成熟病毒蛋白都在病毒生命周期中发挥功能[8],但这些蛋白不足以完成FMDV的生命周期,因而必须借助宿主细胞蛋白,宿主细胞蛋白种类繁多,功能多样,其中,一些蛋白质功能的发挥有利于病毒生长,另一些蛋白质功能的发挥威胁病毒生存[9]。病毒要成功感染宿主细胞,一方面要通过一定的机制利用宿主细胞蛋白表达病毒蛋白、复制病毒基因组和组装子代病毒粒子,另一方面病毒需要通过某种方式避免其被宿主清除,包括逃避免疫监视、抑制免疫相关基因表达、诱导凋亡等。
本研究发现宿主蛋白Tollip在调控FMDV复制中有重要作用,采用CRISPR/Cas9基因编辑技术,在PK-15细胞上成功构建了Tollip敲除细胞系,该细胞系为研究宿主蛋白Tollip在调控FMDV生活史复制中的作用提供良好的细胞模型。通过实时荧光定量PCR、Western blot和病毒滴度测定试验,评价Tollip对FMDV感染的PK-15细胞的作用,为进一步阐明Tollip抑制FMDV复制及调控FMDV复制机制提供理论依据。
1 材料与方法
1.1 载体、细胞及病毒
CRISPR/Cas9 载体质粒pX459-puro-MCS 、PK-15细胞、BHK-21 细胞、FMDV(O/BY/CHA/2010)来源于中国农业科学院兰州兽医研究所口蹄疫与新发病流行病学团队与国家口蹄疫参考实验室。
1.2 试剂及抗体
DMEM细胞培养基及0. 25% EDTA胰酶购自Gibco公司;大肠杆菌DH5α感受态、T4 DNA连接酶购自宝生物公司;胎牛血清(FBS)购自Biological Industries(BI)公司;蛋白预染Marker、Trizol试剂等均购自 Invitrogen公司;Western-抗体稀释液购自碧云天生物技术有限公司;10×PCR Buffer购自康为世纪生物科技有限公司;Prime Script TMRT reagent Kit with gDNA Eraser反转录试剂盒、qPCR用SYBR Green qPCR Super Mix购自南京诺唯赞生物科技股份有限公司;胶回收试剂盒、质粒提取试剂盒购自OMEGA公司;Polyplus jetPRIME转染试剂购自Polyplus Transfection公司。蛋白检测显色试剂盒(Pierce TM ECL Western Blotting Substrate)购自Thermo公司;限制性核酸内切酶BbsⅠ购自 NEB公司。Tollip抗体购自Proteintech公司。兔抗FMDV多克隆抗体由本实验室保存;β-actin抗体购自Santa Cruz公司;辣根过氧化物酶(HRP)标记的山羊抗兔 IgG抗体、HRP标记的山羊抗鼠IgG抗体、Alex Fluor 594 Goat Anti-Rabbit IgG(H+L)购自Sigma-Aldrich (USA)公司。
1.3 sgRNA引物的设计及合成
自NCBI数据库查询Tollip基因序列(Transcript: ENSSSCT00000045167. 2),根据CRISPR/Cas9设计原则,基于张峰实验室网站(http://crispr. mit. edu/)的推荐,在Tollip基因的外显子区域设计两条sgRNA序列,具体如表1所示。
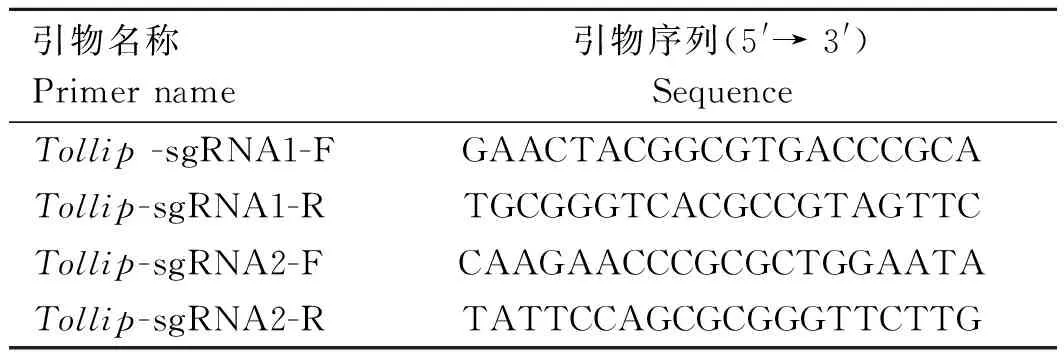
表1 Tollip-sgRNA序列Table 1 Tollip-sgRNA sequences
1.4 重组质粒pX459-Tollip-sgRNA的构建
将上述sgRNA上下游引物进行退火处理,以形成双链DNA。利用BbsI内切酶酶切pX459载体,胶回收酶切片段。将胶回收获取的线性化酶切产物与gRNA序列在T4连接酶作用下进行连接,然后转化到DH5α感受态细胞,涂布于氨苄抗性的固体LB平板中,37 ℃倒置培养过夜,挑取单克隆培养,通过菌液PCR鉴定筛选阳性克隆,并提取质粒,送西安擎科生物科技有限公司测序。
1.5 细胞的转染与筛选
复苏PK-15细胞于T25细胞培养瓶中,放置37 ℃,5%CO2温箱中培养,传代细胞1~2次,细胞状态稳定后铺板继续培养,细胞生长密度至70%~80%后,根据Polyplus 的标准转染程序,将CRISPR重组质粒转染PK-15细胞系,转染24 h后,加入终浓度3 μg·mL-1的嘌呤霉素筛选3 d后,剔除大量 sgRNA 阴性细胞,利用有限稀释法进行亚克隆,接种于 96 孔板中,每孔 0.1 mL,即每孔中有 1 个细胞,筛选一周。单个细胞克隆形成后转移至48孔板,扩大培养,待细胞长满,选取细胞状态良好的孔进行传代并鉴定。
1.6 Sanger 测序鉴定
取野生型细胞与待鉴定单克隆细胞株,使用细胞微量 DNA 提取试剂盒提取 DNA,用Tollip鉴定引物扩增含有 sgRNA 靶向位点的片段后,使用 1%琼脂糖凝胶对质粒大小进行初步鉴定 ,扩增产物胶回收后,用测序引物进行测序,引物序列如下:5′-TTTCCGGAAATGTTTTTTCCGTA-3′(F);5′-GATCTCAACACGAGTCCTACA-3′(R)。
1.7 细胞活力检测
将WT型PK-15细胞、Tollip-KO-1和Tollip-KO-2消化,细胞消化后计数,调整细胞悬液浓度,每孔100 μL接种至96孔板,置细胞培养箱正常培养一定时间;向板的每个孔加入 10 μL CCK-8 溶液,注意不要向孔中引入气泡。置于细胞培养箱继续培养 1~4 h,用酶标仪测定每孔在450 nm波长处的OD值,分析数据。
1.8 Western-blot 分析病毒蛋白的表达
为了研究敲除Tollip之后对FMDV蛋白水平的影响,将Tollip基因敲除PK-15细胞系Tollip-KO-1和Tollip-KO-2和野生型PK-15细胞(WT)分别接种6孔板,待细胞长满后感染FMDV,收取细胞样品。蛋白样品经SDS-PAGE电泳后转NC膜,冰浴中100V恒压转膜1.5 h。用TBST配置5%脱脂奶粉封闭1~2 h。β-actin抗体1∶1 000倍稀释,兔抗FMDV多克隆抗体1∶1 000倍稀释,孵育一抗4 ℃慢摇过夜,用TBST洗NC膜3遍,每次5 min。辣根过氧化物酶(HRP)标记的相应二抗1∶5 000倍稀释,二抗室温孵育1~2 h,用TBST洗NC膜3遍,每次5 min。蛋白检测用Thermo公司的显色试剂盒(PierceTMECL Western Blotting Substrate),1∶1配制,将NC膜浸润在显色液中,使用 Image Lab 4.1(BIO-RAD)扫描成像。
1.9 间接免疫荧光试验
将 PK-15-Tollip-KO 和 PK-15-Tollip-WT 细胞接种至共聚焦培养皿中,待细胞融合度约为 70%时,进行病毒感染,培养 8 h,弃去上清,用 PBS 清洗细胞 3 次;加入 4%多聚甲醛,4 ℃固定过夜;用 PBS 清洗细胞 3 次,每次 5 min;加入 0.3%的 Triton X-100 室温通透 30 min;用 PBS 清洗细胞3次,加入 5% BSA 4 ℃封闭 4 h;加入用 PBS 溶液1∶500 倍稀释的兔抗FMDV抗体作为一抗,4 ℃孵育过夜;PBST 清洗细胞 3 次,每次 10 min;加入用 PBS 溶液 1∶500 倍稀释 的 Alex Fluor 594 Goat Anti-Rabbit IgG(H+L)作为二抗,4 ℃避光孵育过夜;PBST 清洗细胞 3 次,每次 10 min,再加入 0.5 mL DAPI 染核 15 min 后,用激光共聚焦显微镜观察荧光并拍照分析。
1.10 RT-qPCR检测
分别将Tollip基因敲除PK-15细胞系Tollip-KO-1和Tollip-KO-2和野生型PK-15细胞(WT)铺于6孔板中,待细胞长满后感染FMDV,于0、4、12 h分别收取细胞,用Trizol裂解法提取细胞总RNA,测定浓度后,利用Prime Script TMRT reagent Kit with gDNA Eraser反转录试剂盒进行反转录,qPCR用SYBR Green qPCR Super Mix试剂完成。GAPDH作为内参基因,对FMDV的相对表达水平进行定量。
1.11 病毒滴度
在Tollip基因敲除PK-15细胞系Tollip-KO-1、Tollip-KO-2和WT细胞中分别比较了病毒滴度的差异,将FMDV分别感染Tollip基因敲除PK-15细胞系Tollip-KO-1、Tollip-KO-2和WT细胞,不同时间点收取细胞样品。反复冻融3次后,用无血清的DMEM将获得细胞样品进行10-2倍~10-8倍梯度稀释,用各稀释度毒液分别接种96孔细胞培养板中长满单层的BHK-21细胞,每个稀释度接种8个孔,每个孔100 μL。置于37 ℃、5% CO2恒温培养箱中培养并观察4 d,每隔12 h观察并记录细胞病变(CPE)情况,根据Reed-Muench法计算扩增病毒的病毒滴度。
1.12 统计学分析
试验数据使用 Graph pad Prism 8. 01 软件进行统计学方法数据分析并作图。*.P<0.05,**.P<0.01,***.P< 0.001。
2 结 果
2.1 pX459-Tollip-sgRNA重组质粒的构建
根据CRISPR/Cas9设计原则,利用CRISPR软件在Tollip基因第3外显子区域设计了2条sgRNA序列,结果如图1A所示。分别构建至载体 pX459 中,提取质粒送测序。使用BLAST软件对测序结果与目的基因序列进行对比,成功构建具有靶向Tollip基因不同外显子的sgRNA重组质粒,重组质粒分别命名为pX459-Tollip-sgRNA-1、pX459-Tollip-sgRNA-2。
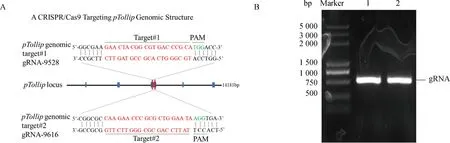
A. 靶向猪Tollip基因组序列的sgRNA示意图;B .全基因组中扩增含有gRNA-1和gRNA-2的目的基因A. Schematic diagram of sgRNA targeting the porcine Tollip genome sequence;B. Whole genome amplification of target genes containing gRNA-1 and gRNA-2图1 猪Tollip敲除重组质粒的构建与鉴定Fig.1 Construction and identification of porcine Tollip knockout recombinant plasmid
2.2 Tollip-gRNA打靶效率的检测
将构建的两个重组质粒pX459-Tollip-sgRNA分别转染 PK-15 细胞,转染24 h后加入嘌呤霉素筛选,取适量筛选后的多克隆细胞株,使用细胞微量 DNA 提取试剂盒提取 DNA,用Tollip鉴定引物扩增含有 sgRNA 靶向位点的片段后,使用 1%琼脂糖凝胶对扩增片段大小进行初步鉴定 (图1B),扩增产物含有sgRNA靶向位点的目的片段,与预期大小相符。目的片段扩增产物胶回收后,进行Sanger测序。嘌呤霉素筛选之后的多克隆细胞株在相应的gRNA附近有明显的打靶(图2),可以进行下一步单克隆细胞株的筛选。
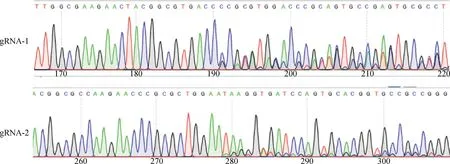
图2 Tollip-gRNA打靶细胞目的基因的测序结果Fig.2 Sequencing results of target genes in Tollip gRNA targeting cells
2.3 不同单克隆细胞株蛋白水平的鉴定
将嘌呤霉素加压筛选后的已打靶的多克隆细胞株用有限稀释法进行亚克隆,一周后,待单个细胞克隆形成,将单克隆细胞扩大培养,并收集不同细胞克隆在蛋白水平进行鉴定,利用Western blot检测Tollip的蛋白水平表达。结果如图3A所示,#1、#2、#3、#4和#9号单克隆细胞株中Tollip基因完全敲除。
A. Western blot检测Tollip-gRNA单克隆细胞系的敲除情况;B. Tollip基因功能缺失细胞系Tollip-KOs细胞活力检测;C.Western blot检测敲除Tollip细胞系对FMDV复制的影响;D.Tollip敲除细胞系感染FMDV的间接免疫荧光试验;E. 实时荧光定量检测Tollip-KO-1和Tollip-KO-2敲除细胞系对病毒复制的影响;F. FMDV在Tollip-KO-1和Tollip-KO-2敲除细胞系中病毒滴度检测结果A. Western blot detects knockout of Tollip-gRNA monoclonal cell lines;B. The viability assay of Tollip gene loss-of-function cell line Tollip-KOs cell;C. Western blot detects the effect of knockout Tollip cell lines on FMDV replication;D. Indirect immunofluorescence assay for FMDV infection in Tollip knockout cell lines;E. Real-time real-time quantitative detects the effects of Tollip-KO-1 and Tollip-KO-2 knockout cell lines on viral replication;F. The results of FMDV viral titer in Tollip-KO-1 and Tollip-KO-2 knockout cell lines图3 敲除细胞的筛选及对FMDV复制的影响Fig.3 Screening of knockout cells and effect on FMDV replication
2.4 敲除 Tollip基因的 PK-15 细胞系的测序鉴定
同时取上述已扩大培养的单克隆细胞株,使用细胞微量 DNA 提取试剂盒提取 DNA,使用Tollip鉴定引物扩增含有 sgRNA 靶向位点的片段,扩增产物送测序,使用 MegAlign 软件对测序结果进行比对分析,结果显示,Tollip-KO-1在Cas9外显子3的9528预定切割位置处[距离PAM基序(TGG)第3和4个碱基之间切割]有1个碱基的缺失,Tollip-KO-2在外显子3的9616预定切割位置处[距离PAM基序(AGG)第1和2个碱基之间切割]有1个碱基的插入。总之,测序结果显示,成功构建了敲除Tollip基因的PK-15细胞系。
2.5 细胞活力检测
WT型PK-15细胞、Tollip-KO-1和Tollip-KO-2细胞铺96孔板,加CCK-8 溶液后,放细胞培养箱继续培养 1~4 h,用酶标仪测定每孔在450 nm处的OD值分析数据。结果如图3B显示,Tollip基因敲除PK-15细胞系Tollip-KO-1和Tollip-KO-2与野生型PK-15细胞的细胞活力相同,表明Tollip基因的敲除并不影响宿主细胞的正常生长。
2.6 敲除 Tollip基因对 FMDV 复制的影响
为了研究Tollip基因在猪源细胞中对 FMDV 复制的潜在作用,分别在 PK-15-Tollip-KO 细胞和 PK-15-Tollip-WT 细胞上感染相同剂量的 FMDV,收集样品,利用Western blot、间接免疫荧光试验、RT-qPCR 和 TCID50方法综合评价内源性Tollip对 FMDV 复制的影响。
2.6.1 Western blot 分析 将Tollip基因敲除PK-15细胞系Tollip-KO-1和Tollip-KO-2与野生型PK-15细胞(WT)感染FMDV,对FMDV的相对表达水平进行分析。结果如图3C所示,敲除Tollip基因之后显着促进FMDV复制。
2.6.2 细胞病变分析 将Tollip基因敲除PK-15细胞系Tollip-KO-1和Tollip-KO-2与野生型PK-15细胞感染FMDV,8 h后在显微镜下观察细胞形态变化,与野生型细胞相比,敲除细胞形态发生变化,细胞变圆,脱落等。
2.6.3 间接免疫荧光试验 分别用 FMDV 感染 PK-15-Tollip-KO 细胞和 PK-15-Tollip-WT 细胞,感染后第8 小时,用 FMDV 兔多抗为一抗,Alex Fluor 594 Goat Anti-Rabbit IgG(H+L)作为二抗进行间接免疫荧光试验,分析Tollip对 FMDV 复制的影响,结果显示, PK-15-Tollip-KO 细胞中出现大量红色荧光,且明显多于 PK-15-Tollip-WT 细胞,说明在 PK-15-Tollip-KO 细胞中 FMDV 复制量较野生型细胞高(图3D)。
2.6.4 实时荧光定量检测分析 PK-15-Tollip-KO 细胞和 PK-15-Tollip-WT 细胞分别感染 FMDV,分别于感染后第0、4、12 小时收取样品并提取总 RNA 进行反转录,以GAPDH作为内参基因,用 qPCR 方法对 FMDV 的相对 mRNA 水平进行定量。结果显示,感染 FMDV 后的不同时间点,PK-15-Tollip-KO 细胞中 FMDV 的 mRNA 表达水平均显着高于对照细胞 PK-15-Tollip-WT(图3E)。
2.6.5 敲除Tollip基因对病毒滴度的影响 将FMDV分别感染Tollip基因敲除PK-15细胞系Tollip-KO-1、Tollip-KO-2和WT细胞,不同时间点收取病毒液,反复冻融3次并离心后,测定病毒滴度。结果如图3F显示,在FMDV接毒后收取的样品中,Tollip基因敲除PK-15细胞系Tollip-KO-1和Tollip-KO-2中口蹄疫病毒的病毒滴度远高于野生型细胞,说明Tollip基因功能缺失单克隆细胞系能够显着促进FMDV的复制。
综上所述,敲除Tollip基因显着促进 FMDV 复制。
3 讨 论
本研究采用 CRISPR/Cas9 技术成功构建了Tollip基因敲除的 PK-15 细胞系。首先构建了重组质粒 pX459-Tollip-sgRNA,转染 PK-15 细胞后,使用嘌呤霉素加压筛选,剔除了大量 pX459-Tollip-sgRNA 阴性细胞,再经过有限稀释法获得单克隆细胞株,提高了候选细胞株敲除目的基因的效率。通过测序和蛋白表达水平鉴定,成功获得了Tollip基因敲除细胞系。对野生型细胞和敲除细胞进行细胞活性试验,结果表明,敲除细胞系细胞生长状态和生长速率与野生型细胞相比无差异,以保证后续相关试验的有效性,也为在Tollip基因敲除细胞系中进行病毒感染机制的深入研究奠定了一定的基础。同时,作者利用 CRISPR/Cas9 基因编辑技术实现了靶基因的高效编辑,可进一步推论并扩展到对其他动物细胞中Tollip基因敲除,构建具有提升FMDV抗原表达的基因敲除细胞系。
CRISPR/Cas9系统对基因的定向识别和剪切是由sgRNA和Cas9实现的,sgRNA决定了Cas9的靶向性,也决定了Cas9的切割活性[10]。本研究旨在应用CRISPR/Cas9基因编辑技术,通过体内外筛选针对Tollip基因的sgRNA序列,实现Tollip基因的准确、高效地敲除,获得一种能够促进FMDV抗原表达的Tollip基因敲除单克隆细胞系,从而为FMDV疫苗的生产提供新的策略。利用CRISPR/Cas9基因编辑技术,通过靶向Tollip基因的sgRNA引导Cas9蛋白结合到Tollip基因特定序列位置对DNA双链进行切割,造成基因双链断裂[11],在细胞自身修复机制作用下,产生随机突变,核苷酸的缺失或插入等突变会造成基因的读码框发生改变而出现终止密码子[12],最终达到基因编码蛋白功能丧失的目的,获得基因编码蛋白功能丧失细胞系。本试验中Tollip敲除细胞系,与野生型 PK-15细胞相比,在感染FMDV后,不同时间点均能显着提高病毒 mRNA 转录、蛋白表达及病毒滴度,从而促进不同感染浓度的FMDV复制,表明Tollip对 FMDV的复制具有重要的调控作用。
TLR在先天免疫反应和适应性免疫反应中都发挥着重要作用[13]。可在免疫细胞、巨噬细胞和心血管细胞等多种细胞类型中表达。先前的研究表明,TLR在调节生物过程中发挥着至关重要的作用,如先天免疫反应、诱导适应性免疫反应、调节炎症、流感病毒、冠状病毒复制及致癌等[14]。有人提出,巨噬细胞中的Tollip通过与TLR/MyD88/IL-1受体活化激酶(IRAK)复合物结合,抑制细菌脂多糖刺激的IRAK磷酸化,降低NF-κB的转录,从而抑制炎症反应,进一步减少肠黏膜损伤,促进肠黏膜修复和黏膜屏障重建,有效地缓解肠黏膜炎症。已有文献报道Tollip基因敲除能够抑制疱疹病毒中UL21蛋白诱导的环状GMP-AMP合成酶(cGAS)降解,进而抑制疱疹病毒的复制。Tollip介导的选择性自噬抑制ACE2 SUMO化可以有效地对抗严重急性呼吸系统综合征冠状病毒2型(SARS-CoV-2)感染[15]。舒尼替尼诱导的非适应性自噬通过Tollip介导的体内相关途径选择性地降解心肌细胞生存介质细胞通信网络因子2(CCN2),并通过腺相关病毒血清型9 (AAV9)在体内模拟舒尼替尼诱导的心功能障碍,表明Tollip参与的CCN2的自噬降解是舒尼替尼诱导心肌细胞心毒性和死亡的原因之一[16]。Tollip还通过促进 sST2 的产生和抑制 IRAK2 活化,在鼻病毒(RV)感染期间限制Ⅰ型细胞因子暴露的人气道中过量产生 IL-2。可能是减轻哮喘中过度中性粒细胞气道炎症的治疗靶点,尤其是在右心室感染期间[17],此外,已知Tollip基因变异通过抑制促炎细胞因子,特别是IL-6、TNF-α和IL-10来调节人类TLR信号通路[18],例如,Tollip表达抑制NF-κB依赖性HIV-1长末端重复(LTR)驱动的转录,从而抑制HIV-1感染[19]。在非洲猪瘟病毒研究方面,病毒蛋白MGF300-2R通过募集Tollip促进IKKα和IKKβ的自噬降解,与病毒致病性有关[20]。越来越多的证据表明,TLR的刺激导致多种信号通路的激活,包括NF-κB、MAPK、Jun-N末端激酶、P38和细胞外信号调节激酶,以及几种干扰素调节因子[21]。本研究发现,抑制宿主细胞中Tollip基因的表达能促进小RNA病毒病毒的复制,尤其是FMDV的复制;此外,本研究提供了一种特异性靶向Tollip基因的sgRNA,所述的sgRNA能够特异性靶向Tollip基因,结合CRISPR-Cas9技术实现了Tollip基因的敲除,获得的单克隆细胞系,提高小RNA病毒疫苗的生产量和抗原表达量。然而,Tollip基因的表达如何抑制口蹄疫病毒的复制,还有待进一步研究。人们将利用成功建立的Tollip基因敲除细胞系,深入开展Tollip调控 FMDV 复制的分子机制研究,挖掘Tollip蛋白的功能。
4 结 论
本研究基于CRISPR/Cas9基因编辑工具在PK-15细胞中敲除Tollip基因,成功构建了Tollip基因敲除细胞系,并通过RT-qPCR、蛋白质印迹和间接免疫荧光试验评估了Tollip基因敲除后对FMDV复制的影响。Tollip基因敲除细胞系的建立能为Tollip调控 FMDV复制的研究奠定基础,也能够为进一步开展Tollip调控其他病毒复制的机制研究提供思路。可作为小RNA病毒疫苗的生产细胞系,具有广阔的应用前景。



