倪南珍,王 敏,林 茂,谢朝美,王春梅
(1. 珠海市金湾区妇幼保健院,广东 珠海 519040;2. 遵义医学院 珠海校区,广东 珠海 519041)
白藜芦醇 (resveratrol,Res) 俗称芪三酚,是一种非黄酮类多酚类化合物。主要存在于葡萄、藜芦、虎杖等植物中。研究发现,Res具抗氧化、抗肿瘤、免疫调节等广泛的生物学活性[1-3]。目前,白藜芦醇的神经保护作用颇受关注,研究证实Res对阿尔茨海默病(Alzheimer’s disease, AD)小鼠认知功能具有一定保护作用,并能改善AD小鼠的抗氧化能力[4]。一氧化氮(nitric oxide, NO) 是一个分子量小、难溶于水的脂溶性气体分子,其具有广泛复杂的生理作用。机体内NO的合成依赖于一氧化氮合酶(nitric oxide synthase, NOS)。NOS大量激活,可以导致NO过量生成,继而引起神经毒性。研究发现,AD患者认知功能损害程度与体内NO水平密切相关[5]。本研究采用D -半乳糖和氯化铝联合的方法构建AD小鼠模型,观察Res对AD小鼠记忆能力及脑组织NOS和NO含量的影响,初步探讨Res防治AD的机制。
1 材料与方法
1.1 材料 50只健康昆明雌性小鼠,SPF级,体重(30±3)g,广州医学动物实验中心提供,许可证号:SCXK(粤)2003-0002。D-半乳糖购自Sigma公司,批号:106K0045。Res(纯度≥98%)购自湖南洪江华光生物有限责任公司,批号:080130。结晶氯化铝分析纯购自广州化学制剂厂,批号:20060501。NO测定试剂盒、NOS测定试剂盒均购自南京建成生物工程研究所。DAB显色试剂盒、兔抗鼠神经元型一氧化氮合酶(neuronal nitric oxide synthase, nNOS)多克隆抗体、SABC二抗试剂盒均购自武汉博士德生物工程有限公司。RT-1904C生化分析仪,深圳雷杜科技有限公司。STT-2小鼠跳台仪,北京医学科学院药物研究所。UV-7501紫外分光光度计,无锡科达仪器厂。
1.2 方法
1.2.1 模型构建及分组给药 50只SPF级健康雌性昆明小鼠,体重(30±3)g,适应性饲养1周后,随机分为5组:正常对照组、AD模型组、Res低剂量组、Res中剂量组和Res高剂量组,每组10只。除正常对照组外,其余各组小鼠每天灌胃三氯化铝10 mg/kg和腹腔注射D-半乳糖120 mg/kg,连续90d,构建AD模型。Res干预各组小鼠从第31天起,在上述基础上再每天分别给予22 mg/kg、44 mg/kg、88 mg/kg的Res灌胃,连续60 d。
1.2.2 跳台法测定小鼠记忆能力 末次给药结束2 h后,进行跳台实验测定小鼠记忆能力。跳台仪器为底面铺有铜栅的实验箱,铜栅上置1个圆柱形橡胶绝缘台作为回避电击的安全区。先让小鼠在实验箱内适应环境5 min,然后给铜栅通电,小鼠受到电击后,正常反应为跳上绝缘台来逃避电击,记录小鼠5 min内遭受的电击次数作为学习成绩。休息24 h后,将小鼠直接置于跳台上,记录其在跳台上的停留时间即潜伏期和5 min内双足同时接触铜栅触电的次数即错误次数。
1.2.3 脑组织中NOS和NO含量测定 跳台实验结束后,迅速断头取脑,清理血迹,称重,加入9倍4 ℃无菌的生理盐水,制成10%脑组织匀浆,2500 r/min离心10 min,取上清液。严格按照生化试剂盒说明操作,检测脑组织内总NOS,诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)和结构型一氧化氮合酶(constitutive nitric oxide synthase, cNOS)活力以及NO的含量。
1.2.4 免疫组化法测定大脑皮层nNOS的表达 在4%的多聚甲醛中固定鼠脑24 h,人字点前3 mm处冠状面取材,然后进行石蜡包埋、切片(4 μm/片)。常规脱蜡至水,微波修复抗原。采用SABC法免疫组化染色,DAB 显色,Mary’s苏木素复染。阴性对照片用PBS 代替一抗。在nNOS表达部位显示为和背景有差别的棕黄色颗粒,判定为阳性,并测定灰度值。
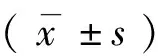
2 结果
2.1 各组小鼠记忆能力变化 各组小鼠跳台实验结果显示(见表1),与正常对照组相比较,AD模型组小鼠的学习成绩下降,潜伏期减短,错误次数增多(P<0.01)。与AD模型组相比较,不同剂量Res干预组小鼠学习成绩有所提高,潜伏期增长,错误次数减少(P<0.05)。
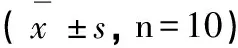
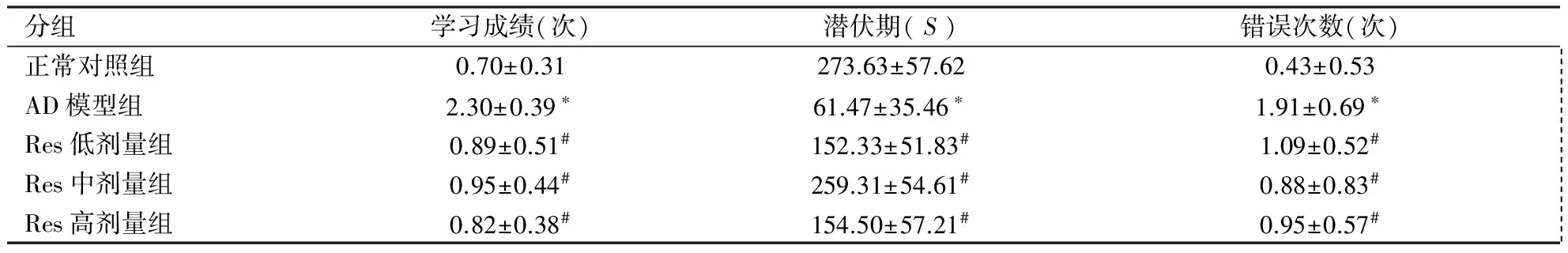
分组学习成绩(次)潜伏期(S)错误次数(次)正常对照组0.70±0.31273.63±57.620.43±0.53 AD模型组2.30±0.39∗61.47±35.46∗1.91±0.69∗ Res低剂量组0.89±0.51#152.33±51.83#1.09±0.52# Res中剂量组0.95±0.44#259.31±54.61#0.88±0.83# Res高剂量组0.82±0.38#154.50±57.21#0.95±0.57#
注:与正常对照组比较*P<0.01,与AD模型组比较#P<0.05。
2.2 各组小鼠脑组织中NO的含量变化 生化试剂盒检测的各组小鼠脑组织NO的含量变化(见表2)。与正常对照组相比较,AD模型组小鼠NO的含量增多(P<0.01)。与AD模型组比较,Res干预各剂量组NO含量下降,其中Res中、高剂量组小鼠脑组织中NO含量下降明显(P<0.05)。
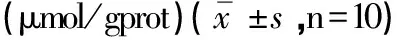
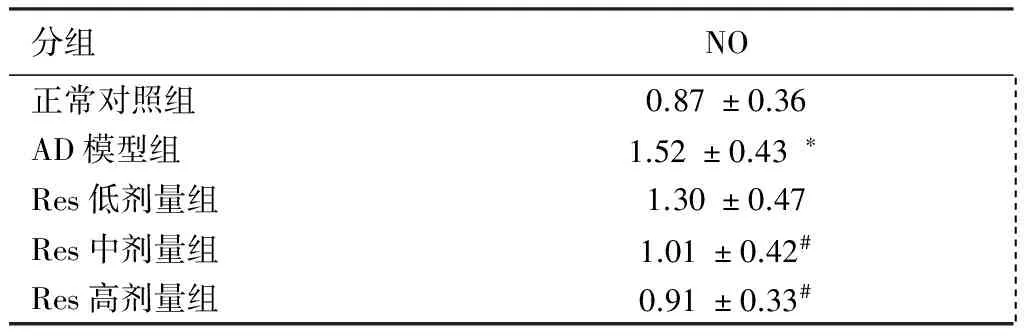
分组NO正常对照组0.87±0.36 AD模型组1.52±0.43∗ Res低剂量组1.30±0.47 Res中剂量组1.01±0.42# Res高剂量组0.91±0.33#
注:与正常对照组比较*P<0.01,与AD模型组比较#P<0.05。
2.3 脑组织中NOS活力变化 生化试剂盒检测到各组小鼠脑组织NOS活力变化(见表3)。与正常对照组相比较,AD模型组的小鼠总NOS和cNOS活力均有所升高(P<0.01)。与AD模型组比较,Res干预的各组小鼠脑总NOS和cNOS活性均有所下降,其中Res高剂量组cNOS活性下降明显,Res中、高剂量组总NOS下降明显(P<0.05)。而各组小鼠iNOS活力未见差异(P>0.05)。
2.4 大脑皮质中nNOS表达变化 免疫组化染色显示(见图1),nNOS在脑神经元胞浆内呈棕黄色强阳性着色,如“→”所示。正常对照组神经元胞浆内仅有少量的淡黄色阳性颗粒。AD模型组神经元胞浆染色呈棕黄色强阳性。Res低剂量组神经元胞浆染色较强,接近AD模型组,呈棕黄色。Res中剂量和高剂量组神经元胞浆内含有弱阳性的浅棕黄色颗粒。阴性对照片神经元胞核蓝染,胞浆内未发现有别于背景的阳性染色。灰度值分析显示(见表4),与正常对照组相比较,AD模型组小鼠大脑皮质nNOS表达增强(P<0.01)。与AD模型组比较,Res干预各组小鼠大脑皮质nNOS表达减弱,其中Res中、高剂量组下降明显(P<0.05)。
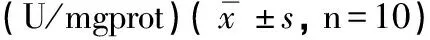
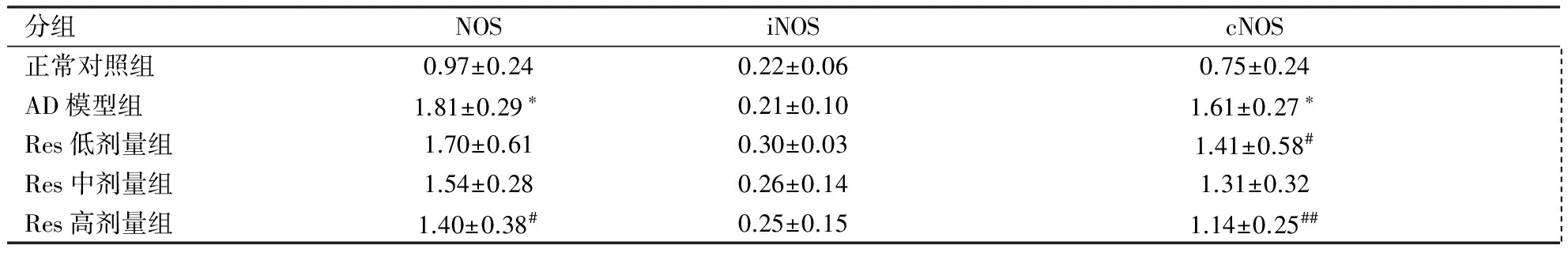
分组NOSiNOScNOS正常对照组0.97±0.240.22±0.060.75±0.24 AD模型组1.81±0.29∗0.21±0.101.61±0.27∗ Res低剂量组1.70±0.610.30±0.031.41±0.58# Res中剂量组1.54±0.280.26±0.141.31±0.32 Res高剂量组1.40±0.38#0.25±0.151.14±0.25##
注:与正常对照组比较*P<0.01,与AD模型组比较#P<0.05,##P<0.01。

注:A:阴性对照片;B:正常对照组;C:AD模型组;D:Res低剂量组;E:Res中剂量组、F:Res高剂量组。箭头所指为阳性染色颗粒。图1 各组小鼠大脑皮质nNOS表达(IHC×400)
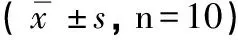
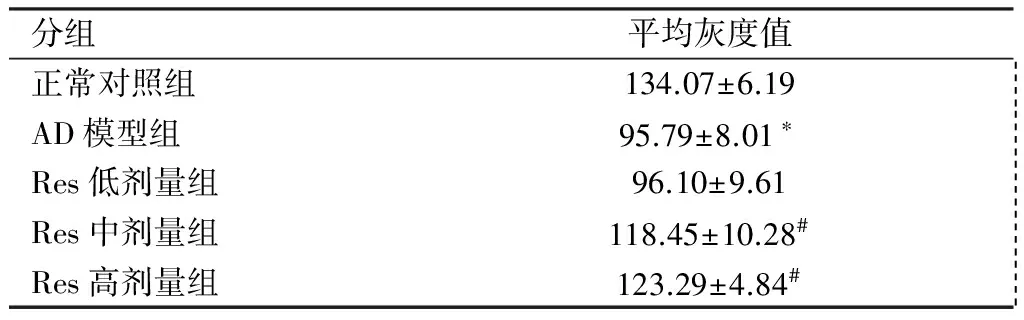
分组平均灰度值正常对照组134.07±6.19 AD模型组95.79±8.01∗ Res低剂量组96.10±9.61 Res中剂量组118.45±10.28# Res高剂量组123.29±4.84#
注:与正常对照组比较*P<0.01,与AD模型组比较#P<0.05。
3 讨论
AD是一种老年期以记忆和认知功能障碍为主要临床表现的进行性发展的神经退行性疾病。患者脑神经细胞外出现β-淀粉样蛋白(β-amyloid protein, Aβ)的沉积和机体内的氧化损伤构成了AD发病的复杂网络[6-7]。而NO作为与之相关的物质之一被密切关注[8]。研究发现,在AD患者体内NO与Aβ沉积和氧化应激正相关[8]。可见,改善NO含量可能成为治疗AD的一个切入点。本实验前期工作已经证实:Res可以改善AD小鼠的抗氧化能力,提高其记忆能力[4]。但是其对AD模型小鼠的作用机制是否与NO相关,还有待进一步深入研究。
NOS作为催化机体产生内源性NO的唯一酶类,其活力高低与体内NO表达正相关。NOS可分为iNOS、内皮型NOS(endothelial nitric oxide synthase, eNOS)和nNOS三种,其中eNOS和nNOS又可以合称cNOS[9]。本实验通过观察不同类型的NOS活力,综合分析Res干预NO生成的可能机制。
[参考文献]
[1] Kumar A, Negi G, Sharma S S. Neuroprotection by resveratrol in diabetic neuropathy: concepts and mechanisms[J]. Curr Med Chem, 2013,20(36):4640-4645.
[2] Wang B, Sun J, Li X, et al. Resveratrol prevents suppression of regulatory T-cell production, oxidative stress, and inflammation of mice prone or resistant to high-fat diet-induced obesity[J]. Nutr Res, 2013,33(11):971-981.
[3] Kim T H, Shin Y J, Won A J, et al. Resveratrol enhances chemosensitivity of doxorubicin in multidrug-resistant human breast cancer cells via increased cellular influx of doxorubicin[J]. Biochim Biophys Acta, 2013,1840(1):615-625.
[4] 林茂, 万章, 王春梅. 白藜芦醇对阿尔茨海默病小鼠记忆和抗氧化能力的影响[J]. 现代中西医结合杂志, 2009,18(5):484-486.
[5] 彭誉, 周华, 邱晨红, 等. 血浆NO在在阿尔茨海默病患者中的表达及意义[J]. 卒中与神经病, 2012,19(5):279-282.
[6] 赵虹, 骆庆和, 殷明, 等. 氧化应激与阿尔茨海默病[J]. 中国老年学杂志, 2013,33(16):4090-4093.
[7] Xie H, Guan J, Borrelli L A, et al. Mitochondrial alterations near amyloid plaques in an alzheimer’s disease mouse model[J]. J Neurosci, 2013,33(43):17042-17051.
[8] 吴晓强, 王小姗. 一氧化氮/一氧化氮合酶在阿尔茨海默病中的研究进展[J]. 医学综述, 2012,18(1):25-27.
[9] Aliev G, Palacios H H, Lipsitt A E, et al. Nitric oxide as an initiator of brain lesions during the development of Alzheimer disease[J]. Neurotox Res, 2009,16(3):293-305.



