张青峰,张芳婷,申慧芳,高书颖
(1.遵义医学院珠海校区 生物化学与分子生物学教研室, 广东 珠海 519041;2.北京大学深圳医院 中心实验室,广东 深圳 518036)
端粒 (telomere) 位于染色体末端,是由串联重复的短双链DNA序列和结合蛋白形成的复合体,在维持基因组完整性和功能稳定性方面有着重要作用。重复端粒DNA序列由端粒酶维护。人端粒酶由端粒酶逆转录酶 (human telomerase reverse transcriptase, hTERT)、端粒酶RNA (human telomerase RNA, hTR) 和端粒酶相关蛋白 (additional protein components) 组成,hTERT的转录调控是限制端粒酶活性的主要因素[1]。研究发现,hTERT在大多数正常人体细胞中呈低表达或不表达,而在胚胎发育期间、在一些干细胞和大多数肿瘤细胞中表现活性[2]。表达外源hTERT,可以使某些类型的细胞永生化,其中包括马科动物原代成纤维细胞[3]、人间充质基质细胞[4]、人口腔黏膜上皮细胞[5]、人肝细胞[6]等。
本研究拟构建携带hTERT基因的重组慢病毒表达载体,制备重组慢病毒,检测携带hTERT基因的重组慢病毒对HeLa细胞的感染能力,及其介导外源hTERT基因在被感染细胞中的染色体整合和mRNA表达水平,为进一步研究hTERT基因的功能及构建永生化细胞系奠定基础。
1 材料与方法
1.1 细胞株与质粒 人宫颈癌HeLa细胞购自中国科学院上海细胞库;大肠杆菌DH5α由本实验室保存;人胚肾293FT细胞、大肠杆菌Stbl3、质粒pENTR 221-hTERT、pLP1、pLP2、pLP/VSVG和pLenti6.3/V5-DEST等购自Invitrogen公司 (Carlsbad, CA, USA)。重组质粒pLenti6.3/V5-hTERT由本实验室构建,其结构示意图(见图1)。
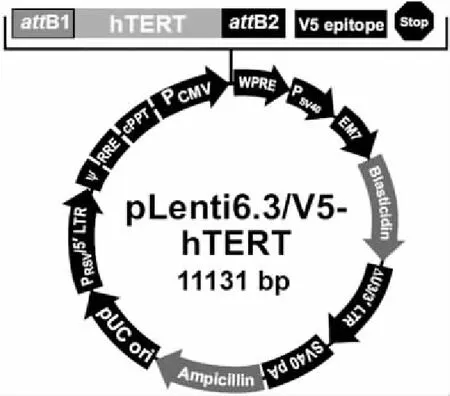
图1 重组质粒pLenti6.3/V5-hTERT的结构示意图
1.2 主要试剂 质粒提取试剂盒、质粒转染试剂LipofectamineTM2000、LR clonase II enzyme mix和杀稻瘟菌素 (BSD) 等购自Invitrogen公司 (Carlsbad, CA, USA);Taq DNA聚合酶EmeraldAmp PCR Master Mix、限制性内切酶BamHⅠ和PstⅠ购自Takara公司 (Dalian, China);慢病毒浓缩试剂盒PEG-it Virus Precipitation Solution购自System biosciences公司 (Mountain View, CA, USA);Polybrene购自Sigma公司 (St. Louis, MO, USA)。
1.3 重组慢病毒载体pLenti6.3/V5-hTERT的构建及酶切鉴定 将克隆载体pENTR221-hTERT、表达载体pLenti6.3/V5-DEST和LR Clonase II enzyme mix于室温下混合均匀,孵育1~2 h,然后加入Proteinase K溶液终止反应,于37 ℃孵育样品10 min。将上述反应混合物转化大肠杆菌Stbl3细胞,在含有Amp抗生素的LB固体培养基上筛选阳性克隆。提取质粒,用BamHⅠ和PstⅠ分别单酶切质粒,鉴定目的片段的大小和连接方向。
1.4 慢病毒的包装与浓缩 将293FT细胞接种至10 cm细胞培养皿,于37 ℃、5% CO2的培养箱中过夜培养。转染当天,293FT细胞密度为80%~95%时,依照转染试剂LipofectamineTM2000操作说明将pLP1、pLP2、pLP/VSVG和pLenti6.3/V5-hTERT四种质粒混合,共转染293FT细胞,转染第2天,除去293FT细胞培养基,更换为10 mL不含抗生素的DMEM完全培养基,于37 ℃、5% CO2培养箱孵育细胞48~72 h。将培养基上清转移到15 mL离心管中,4 ℃ 2000 ×g离心15 min,沉淀碎片,使用Millex-HV 0.45 μm PVDF滤器过滤上清,得到含有慢病毒的上清液。参照慢病毒浓缩试剂盒PEG-it Virus Precipitation Solution操作说明对慢病毒上清液进行浓缩,分装至1.5 mL离心管中,于-70℃冰箱保存备用。
1.5 重组慢病毒携带hTERT基因的PCR检测 取慢病毒浓缩液10 μL,沸水浴15 min,迅速冰浴15 min,提取病毒DNA,进行PCR扩增鉴定。扩增hTERT基因的上游引物为Primer1:5’-GGTGGATGATTTCTTGTTGGTG-3’,下游引物为Primer2:5’-ACCACTGTCTTCCGCAAGTTC-3’。 PCR反应条件为:94 ℃预变性2 min;98 ℃变性10 s,55 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃延伸5 min。实验设无菌水为阴性对照、质粒pENTR221-hTERT为阳性对照。采用1.5%琼脂糖凝胶电泳对扩增产物进行检测。
1.6 重组慢病毒感染能力的鉴定 将HeLa细胞接种至6孔细胞培养板,于37℃、5% CO2的培养箱中过夜培养,慢病毒感染当天细胞密度为40% ~ 50%。用DMEM完全培养基将慢病毒贮存液稀释100倍,滴加至HeLa细胞培养孔内,同时加入Polybrene至终浓度为6 μg/mL,继续培养过夜。次日,除去含慢病毒的培养基,更换为新鲜DMEM完全培养基继续培养。第3天,更换为含有10 μg/mL BSD的DMEM完全培养基继续培养。此后每3~4 d,更换新鲜的含有BSD的DMEM培养基继续培养,抗生素筛选10~12 d后,显微镜下观察细胞生长状况。
1.7 外源hTERT基因整合至HeLa细胞基因组的检测 提取感染重组慢病毒经BSD筛选培养的HeLa细胞和对照细胞基因组DNA,以此为模板进行PCR扩增,引物为Primer1和Primer2。PCR反应条件为:94 ℃预变性2 min;98 ℃变性10 s,55 ℃退火30 s,72℃延伸1 min,共35个循环;72 ℃延伸5 min。采用1.5%琼脂糖凝胶电泳对扩增产物进行检测。
1.8 HeLa细胞hTERT基因表达的RT-PCR检测 利用TRIzol试剂 (Invitrogen公司) 提取感染重组慢病毒经BSD筛选培养的HeLa细胞和对照细胞总RNA,经反转录得到cDNA,以此为模板进行PCR扩增。扩增hTERT基因的上下游引物为Primer1和Primer2,扩增片段长度预计为117 bp;内参照GAPDH基因的上游引物为Primer3:5’-GCACCGTCAAGGCTGAGAAC-3’,下游引物为Primer4:5’-TGGTGAAGACGCCAGTGGA-3’,扩增片段长度预计为138 bp。由于hTERT基因和GAPDH基因的扩增片段长度接近,这两种基因的PCR反应在不同体系中进行。PCR反应条件为:94 ℃预变性2 min;98 ℃变性10 s,55 ℃退火30 s,72 ℃延伸30 s,共30个循环;72 ℃延伸5min。采用1.5%琼脂糖凝胶电泳对扩增产物进行检测。
2 结果
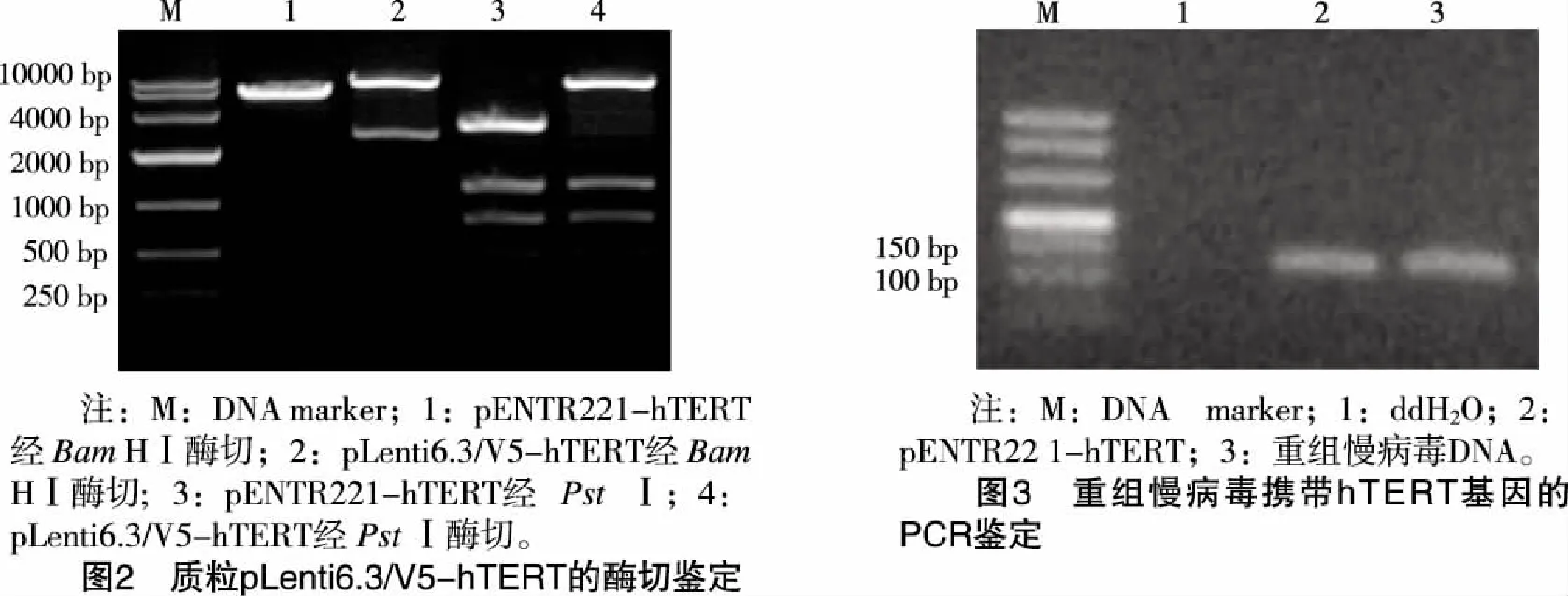
2.1 重组慢病毒载体pLenti6.3/V5-hTERT的构建 克隆载体pENTR 221-hTERT携带attL1和attL2位点,位于hTERT基因序列两端;慢病毒表达载体pLenti6.3/V5-DEST携带attR1和attR2位点,位于细胞死亡控制基因ccdB序列两端。在LR Clonase II enzyme的作用下,pLenti6.3/V5-DEST上的attR1和attR2序列与pENTR221-hTERT上的attL1和attL2序列发生同源重组,将反应混合物转化大肠杆菌Stbl3感受态细胞,经Amp抗生素筛选获得阳性克隆。提取质粒进行酶切鉴定,将重组质粒命名为pLenti6.3/V5-hTERT,其结构示意图(见图1)。重组质粒pLenti6.3/V5-hTERT全长11131 bp,酶切鉴定对照质粒pENTR221-hTERT全长5943 bp,两种质粒均含有BamHⅠ和PstⅠ酶切位点,单切酶后预计形成的DNA片段(见表1)。质粒的单酶切片段电泳结果(见图2),图中显示,重组质粒和对照质粒经BamHⅠ酶切形成的片段大小与预计值完全一致;经PstⅠ酶切形成的小片段亮度较弱,大片段与预计值一致。鉴定结果说明,hTERT基因已定向连接至慢病毒表达载体,载体pLenti6.3/V5-DEST上的细胞死亡控制基因ccdB被目的基因hTERT所取代,重组慢病毒载体pLenti6.3/V5-hTERT构建正确。
表1质粒pLenti6.3/V5-hTERT和pENTR221-hTERT经BamHⅠ和PstⅠ单酶切形成的DNA片段

限制性内切酶质粒 质粒酶切后形成的DNA片段 (bp)BamHⅠpENTR221-hTERT5943BamHⅠpLenti6.3/V5-hTERT8578, 2553PstⅠpENTR221-hTERT3147, 1260, 825, 496, 185, 30PstⅠpLenti6.3/V5-hTERT8046, 1260, 825, 496, 289, 185, 30
2.2 重组慢病毒携带hTERT基因的检测 采用脂质体转染法,将携带hTERT基因的重组慢病毒载体pLenti6.3/V5-hTERT与包装质粒混合物pLP1、pLP2和pLP/VSVG共转染至293FT细胞,收集含有慢病毒颗粒的细胞培养基上清,使用PEG-it Virus Precipitation Solution将培养基上清浓缩为原体积的1/50,提取慢病毒DNA,以Primer1和Primer2为引物PCR法检测重组慢病毒中是否含有hTERT基因。PCR扩增结果见图3,以无菌水为模板的阴性对照无扩增产物,以质粒pENTR221-hTERT为模板的阳性对照和以重组慢病毒DNA为模板的样品有特异性扩增片段,片段大小与预计值一致,可见本研究所包装、浓缩的重组慢病毒携带hTERT基因。
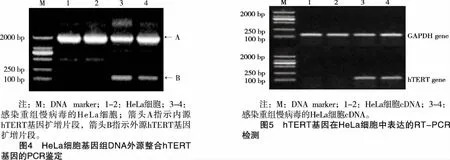
2.3 重组慢病毒介导hTERT基因整合至HeLa细胞染色体DNA 将重组慢病毒感染HeLa细胞,经BSD筛选培养,得到具有BSD抗性的细胞克隆,经传代培养,提取基因组DNA,PCR扩增鉴定是否含有外源hTERT基因。以Primer1和Primer2为引物扩增HeLa细胞基因组DNA内源hTERT基因得到的片段应为1988 bp,其中含有内含子序列1871 bp;扩增外源hTERT基因得到的片段应为117 bp,为克隆hTERT基因序列,不含有内含子。BSD抗性HeLa细胞和对照HeLa细胞基因组DNA鉴定结果见图4。由图4可见,未感染重组慢病毒的对照HeLa细胞,有1条特异性扩增条带 (泳道1、2中箭头A所指),片段大小与内源hTERT基因扩增片段预计值大小一致;感染重组慢病毒经BSD筛选的HeLa细胞,有2条特异性扩增条带,其中大片段 (泳道3、4中箭头A所指) 与内源hTERT基因扩增片段预计值大小一致,小片段 (泳道3、4中箭头B所指) 与外源hTERT基因扩增片段预计值大小一致。检测结果说明,携带hTERT基因的重组慢病毒感染HeLa细胞后,介导hTERT基因整合至HeLa细胞染色体DNA。
2.4 重组慢病毒感染对HeLa细胞hTERT基因转录水平的影响 采用半定量RT-PCR的方法检测BSD抗性HeLa细胞中hTERT基因的mRNA表达水平,确定重组慢病毒感染对HeLa细胞hTERT基因转录水平的影响,结果(见图5)。由图5可见,内参照GAPDH基因在感染重组慢病毒的HeLa细胞和未感染重组慢病毒的对照细胞中的表达量无明显差异;而hTERT基因在感染重组慢病毒的HeLa细胞中的表达量远高于对照细胞,说明通过重组慢病毒介导而整合至HeLa细胞染色体DNA的外源hTERT基因,能够在被感染细胞中得到高表达。
3 讨论
端粒酶与肿瘤发生和细胞衰老有关[2,7],利用分子生物学技术,将外源hTERT基因导入低表达或不表达hTERT的细胞中,提高细胞内hTERT的表达水平,可以使某些类型的细胞永生化。目前,hTERT基因已被广泛用于构建人和其它动物永生化细胞系[3-6,8]。慢病毒载体感染是动物细胞表达外源基因的常用方法。与逆转录病毒载体、腺病毒载体等其它病毒表达载体相比,慢病毒载体的最大优势是能够感染分裂和非分裂细胞,将外源基因有效地整合到宿主细胞染色体上,从而实现持久性表达[9]。
本研究所构建的重组慢病毒载体pLenti6.3/V5-hTERT携带hTERT基因,同时含有WPRE、cPPT元件和杀稻瘟菌素筛选基因Blasticidin,提供Ψ包装信号以及PRSV/5’LTR和ΔU3/3’LTR,能增强基因的表达、便于病毒包装、利于目的基因整合至宿主细胞染色体。病毒的包装采用四质粒系统,具有以反式方式提供病毒包装和慢病毒载体的自灭活功能,加强实验操作的安全性[10-11]。本研究通过构建携带hTERT基因的重组慢病毒载体、制备重组慢病毒,检测携带hTERT基因的慢病毒对HeLa细胞的感染能力,及其介导外源hTERT基因在被感染细胞中的染色体整合和mRNA表达水平,这些工作对于进一步研究hTERT基因的功能及构建永生化细胞系具有重要意义。
[参考文献]
[1] Osterhage J L, Friedman K L. Chromosome end maintenance by telomerase [J]. J Biol Chem, 2009,284(24):16061-16065.
[2]Shay J W, Wright W E. Telomerase therapeutics for cancer: challenges and new directions [J]. Nat Rev Drug Discov, 2006,5(7):577-584.
[3]Vidale P, Magnani E, Nergadze S G, et al. The catalytic and the RNA subunits of human telomerase are required to immortalize equid primary fibroblasts [J]. Chromosoma, 2012,121(5):475-488.
[4]Yao C L, Hwang S M. Immortalization of human mesenchymal stromal cells with telomerase and red fluorescence protein expression [J]. Methods Mol Biol, 2012,879:471-478.
[5]陈之锋, 吕标, 郑超群, 等. hTERT诱导永生化口腔黏膜上皮细胞株的建立 [J]. 中国口腔颌面外科杂志, 2013,11(2):91-96.
[6]杭化莲, 张磊, 施晓雷, 等. 永生化人肝细胞系的建立及其生物学特性 [J]. 江苏医药, 2011,37(22):2624-2627.
[7]Aubert G, Lansdorp P M. Telomeres and aging [J]. Physiol Rev, 2008,88(2):557-579.
[8]陈小云, 张敏, 王磊, 等. 端粒酶在细胞永生化中的应用[J]. 中国兽药杂志, 2013,47(4):53-57.
[9]Naldini L. Lentiviruses as gene transfer agents for delivery to non-dividing cells [J]. Curr Opin Biotechnol, 1998,9(5):457-463.
[10]Zufferey R, Dull T, Mandel R J, et al. Self-inactivating lentivirus vector for safe and efficientinvivogene delivery [J]. J Virol, 1998,72(12):9873-9880.
[11]Buchschacher G L Jr, Wong-Staal F. Development of lentiviral vectors for gene therapy for human diseases [J]. Blood, 2000,95(8):2499-2504.



