韩云竹,宋 鸿
(遵义医学院 微生物学教研室,贵州 遵义 563099)
肝癌是我国常见肿瘤之一,由于进展较快、预后较差,每年有数十万人死于肝癌[1]。目前对肝癌的生物学性状及药物敏感性研究多采用单层细胞培养法,但单层培养存在较多局限性,可导致癌细胞生物学性状的缺失或改变[2],有研究表明单层培养所揭示的细胞耐药机制也与体内耐药机制存在一定的差异性[3]。而三维培养通过构建细胞和材料的三维空间复合体,模拟细胞在体内形成的组织样结构、细胞间的相互联系、细胞与基质间的相互作用等特征[4],在一定程度上弥补了单层培养的不足,对肝癌细胞的体外研究将更为理想。近年来,从天然褐藻中提取的藻酸盐由于不受温度控制、凝胶较易塑形、材料易得、价格便宜,且具有良好的生物相容性和生物可降解性[5],在细胞三维培养中得到了广泛应用[6-7]。本研究采用藻酸盐为立体支
架进行肝癌HepG2细胞的三维培养,通过观察细胞在该材料中的形态及生长情况,为其应用于肝癌组织工程研究及抗癌药物筛选提供实验依据。
1 材料与方法
1.1 材料与仪器 HepG2细胞株为遵义医学院微生物学教研室保存;DMEM高糖型培养基(Gibco公司);藻酸盐、钙黄绿素-碘化丙啶、四甲基偶氮唑盐、胰蛋白酶(Sigma公司);DMSO、氯化钙(国产分析纯);酶标仪(上海三科仪器有限公司,318-C型);倒置显微镜及显微摄影系统(Olympus公司)。
1.2 方法
1.2.1 藻酸盐溶液的制备 用0.01 mol/L的PBS(pH7.2)配制2%的藻酸盐溶液,常温下磁力搅拌器搅拌4~6 h,充分溶解后用0.22μm的滤器过滤除菌。4 ℃保存备用。
1.2.2 细胞在凝胶中的培养 将HepG2细胞接种于培养瓶中,用含10%胎牛血清的DMEM培养液于5%CO2细胞培养箱中培养,待细胞汇合达80%后,用0.25%胰酶消化离心,细胞计数,调整细胞悬液浓度为1×106/mL;加入等量2%的藻酸盐溶液,充分混匀,将藻酸盐凝胶细胞混合悬液滴入自制模具中,以102 mmol/LCaCl2溶液处理,形成藻酸钙凝胶后取出模具,加入培养液洗涤2次,悬于培养液中进行培养,每48小时换液1次。定期在倒置显微镜下观察凝胶中HepG2细胞的生长情况。
1.2.3 组织学观察 于三维培养的第1、5、10天取细胞凝胶复合物PBS漂洗3次,经4%多聚甲醛固定,乙醇梯度脱水,二甲苯透明,石蜡包埋,连续切片3 μm,HE染色后光镜下观察。
1.2.4 钙黄绿素-碘化丙啶染色 在三维培养的第1、5、10天,取部分标本,预冷PBS润洗3次,15 min/次。依次加入钙黄绿素-碘化丙啶染液,避光、室温孵育45 min,荧光显微镜下观察,钙黄绿素被活细胞胞浆内酯酶活化发出绿色荧光,碘化丙啶与死细胞的细胞核结合发出红色荧光。
1.2.5 MTT法检测凝胶内细胞增殖情况 将细胞凝胶复合物接种于24孔板中进行培养,分别于培养的1、3、5、7 d取样测定,PBS洗涤3次后加入55 mmol/L柠檬酸钠使其溶解,每孔加入5 mg/mL的MTT溶液100 μL孵育4 h,吸弃液体,用1 mL DMSO溶解结晶,吸取200 μL于96孔板中,酶标仪492 nm处测吸光度值。
2 结果
2.1 倒置显微镜观察 二维培养细胞4h后开始贴壁,24h完全贴壁,细胞呈多边形,大小较均一,见图1A,培养第2天细胞汇合达80%。与二维培养相比,三维培养的细胞在藻酸盐凝胶中悬浮生长,增殖相对较慢,第5天才开始相互聚集并增殖成团,呈葡萄串状,随培养时间的延长细胞团体积逐渐增大,细胞数量逐渐增多,形成较大的细胞聚集体,且整个培养过程中细胞均呈圆形或球形,见图1B-D。
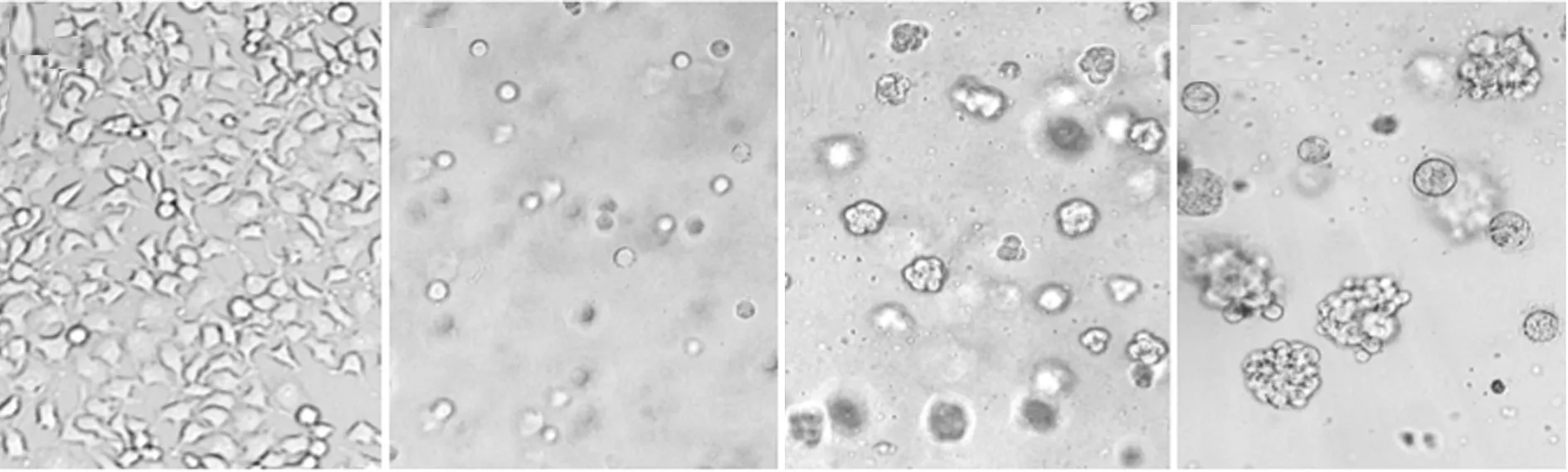
注:A:二维培养;B:三维培养第1天;C:三维培养第5天;D:三维培养第10天。 图1 倒置显微镜观察二维及三维培养细胞(×100)
2.2 组织学观察 如图2所示,藻酸盐凝胶内培养第1天,细胞为单个生长,胞核大而圆;第5天开始逐渐增殖为2~3个细胞组成的的单个小细胞团,胞核清晰蓝染,胞质染色较淡;至第10天,形成较大紧密团状细胞球,表明细胞在凝胶内生长状态较好。
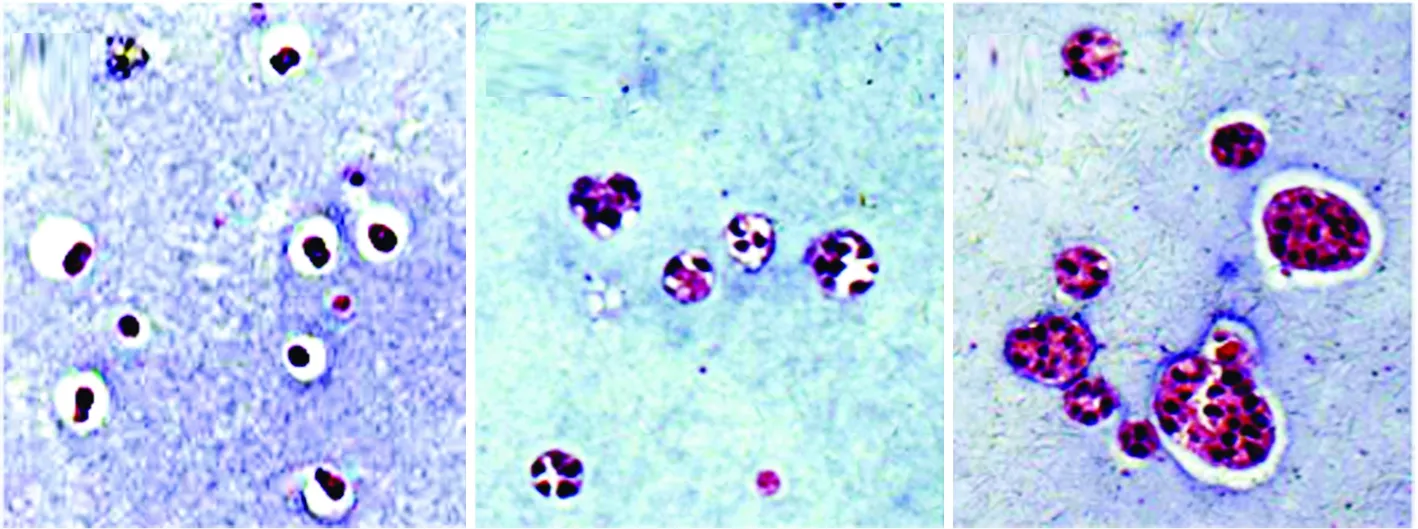
注:A:三维培养第1天;B:三维培养第5天;C:三维培养第10天。 图2 三维培养HepG2细胞(HE×200)
2.3 三维培养细胞荧光染色观察 经钙黄绿素-碘化丙啶染色后(见图3),可见三维培养第1至第10天的细胞逐渐成团,且绝大部分发出绿色荧光,未见红色荧光,提示藻酸盐凝胶内HepG2细胞生长活性良好。
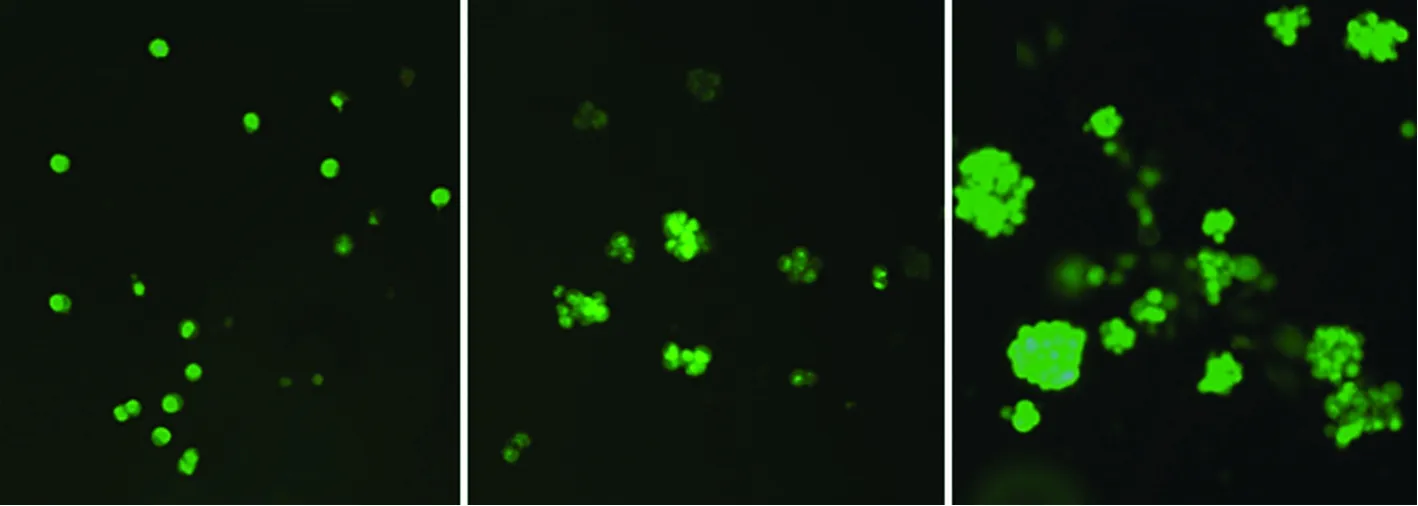
注:A:三维培养第1天;B:三维培养第5天;C:三维培养第10天。图3 三维培养细胞荧光染色(×100)
2.4 MTT法测细胞增殖 HepG2细胞在藻酸盐凝胶中的增长情况见图4。培养初期生长缓慢,第5天开始细胞进入快速增长期,提示细胞在凝胶内保持活跃的增殖状态。
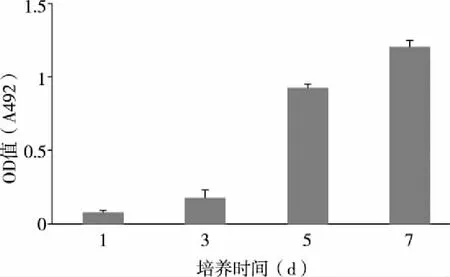
图4 HepG2细胞在藻酸盐凝胶中的增殖情况
3 讨论
目前组织工程研究中使用的支架材料有很多,主要包括天然可降解材料如胶原蛋白、藻酸盐、壳聚糖等和人工合成可降解材料如PLLA、PLGA、PLLA-PLGA共聚物等[8-9]。人工合成可降解材料虽然生产重复性好,可预先设计和控制材料的精细结构、降解时间,但材料在生物相容性、理化性能、降解速率等方面仍有许多问题尚待解决[10]。相比之下来源于动植物或人体的天然生物材料因具有良好的生物相容性、可降解性,且降解产物无毒,在组织工程中得到了广泛应用,其中水凝胶材料如Matrigel、胶原蛋白、藻酸盐等因其可注射性等特点受到重视[11-12]。Matrigel和胶原蛋白常用于肿瘤细胞三维培养,有研究表明这两种材料所构建的三维培养体系均有利于细胞的增殖和分化[13];但由于它们多来源于动物,因此有潜在的动物源性病原体存在,同时它们的价格比较昂贵,且属于温敏型材料,在实验过程中对温度要求较高,使得实验操作难度加大。而藻酸盐是从海藻中提取的一种天然高分子聚合物,极易和二价阳离子如Ca2+作用形成水凝胶。与温敏型材料相比,藻酸盐的成胶过程不受温度影响,使得实验操作更加简单,同时由于藻酸盐具有高度多孔结构及亲水特性,使得营养物质易于渗透,因此藻酸盐在三维培养中得到广泛的应用[6,12-13]。
本实验采用藻酸盐凝胶培养体系进行肝癌HepG2细胞的三维培养,通过组织学、钙黄绿素-碘化丙啶染色及MTT实验观察细胞的形态及生长情况。结果发现,藻酸盐凝胶内的HepG2细胞在培养初期表现为圆形或球形,增殖并不活跃,培养至第5天细胞开始出现快速增殖,并聚集形成细胞团,说明藻酸盐凝胶培养体系适宜于肝癌细胞的体外培养,是一种较为理想的肝癌细胞载体。与传统二维细胞培养相比,虽然三维培养细胞增殖出现较晚,且这种生长方式在一定程度上限制了细胞的生长代谢,但细胞的活性却能长期维持,有利于细胞合成、分泌等功能的发挥;同时细胞在凝胶内呈团状生长,增加了细胞间的接触,有利于细胞与细胞、细胞与支架之间发生相互作用。本研究肝癌细胞藻酸盐凝胶三维培养体系的成功建立,为今后体外深入研究肝癌发病机制、耐药机理提供了重要的实验依据。
[参考文献]
[1] Aravalli R N.Progress in stem cell-derived technologies for hepatocellular carcinoma[J].Stem Cells Cloning, 2010, 3:81-92.
[2] Grun B, Benjamin E, Sinclair J, et al. Three-dimensional in vitro cell biology models of ovarian and endometrial cancer[J]. Cell Prolif, 2009, 42(2): 219-228.
[3] Fischbach C, Kong H J, Hsiong S X, et al. Cancer cell angiogenic capability is regulated by 3D culture and integrin engagement[J]. Proc Natl Acad Sci USA,2009, 106(2): 399-404.
[4] Loessner D, Stok K, Lutolf M, et al. Bioengineered 3D platform to explore cell-ECM interactions and drug resistance of eptithelial ovarian cancer cells[J].Biomaterials,2010,31(32):8494-8506.
[5] Masuda K, Sah R L, Hejna M J. A novel two-step method for the formation of tissue-engineered cartilage by mature bovine chondrocytes: the alginate-ecovered- hondrocyte (ARC) method [J]. J Orthopaedic Res, 2003, 21(1):139-148.
[6] 宋鸿,陈炜. 兔关节软骨细胞在藻酸盐凝胶中体外培养[J]. 遵义医学院学报,2009,32(1):20-23.
[7] Darilis S, Kara B, Eiji S, et al. Controlled nucleation of hydroxyapatite on alginate for stem cell-based bone tissue engineering[J]. J Biomed Mater Res A,2010, 95(1): 222-234.
[8] Gelain F, Bottai D, Vescovi A, et al. Designer self-assembling Peptide nanofiber scaffolds for adult mouse neural stem cell 3-dimensional cultures[J]. PLoS ONE,2006, 1:e119.
[9] Bokhari M, Camachan R J, Cameron N R,et al. Novel cell culture device enabling three-dimensional cell growth and improved cell function[J]. BiochemBiophys Res Commun, 2007, 354(4):1095-1100.
[10] Plieva F M, Galaev I Y, Mattiasson B.Macroporous gels prepared at subzero temperatures as novel materials for chromatography of particulate-containing fluids and cell culture applications[J].J Sep Sci, 2007, 30(11):1657-1671.
[11] Philp D, Chen S S, Fitzgerald W, et al. Complex extracellular matrices promote tissue-specific stem cell differentiation[J]. Stem Cells, 2005, 23(2):288-296.
[12] Andriamanalijiaona R, Duval E, Raoudi M. Differentiation potential of human muscle-derived cells towards chondrogenic phenotype in alginate beads culture[J].Osteoarthritis Cartilage, 2008, 16(12): 1509-1518.
[13] Mondrinos M J, Koutzaki S, Jiwanmall E, et al. Engineering three-dimensional pulmonary tissue constructs[J]. Tissue Eng, 2006, 12(4):717-728.



