赵麒麟, 陈 静,罗军敏,郑 静,秦娜琳,陈富超
(1.遵义医学院 第一临床学院临床医学2009级学生,贵州 遵义 563099;2.遵义医学院 免疫学教研室,贵州 遵义 563099)
ALI是多种细胞因子参与的炎症反应性疾病,其中TNF-α等促炎因子过度表达、IL-10等抗炎因子相对不足在ALI发生发展中起重要作用。若不能积极治疗,当ALI发展为急性呼吸窘迫综合征(ARDS)时其病死率将高达30%~40%,其中80%死于病程后期[1]。目前尚缺乏有效的治疗药物和治疗措施,糖皮质激素用于ALI的治疗由来已久,但由于其副作用的原因影响了其使用。本研究将于腹腔注射和局部气管给药两种方式下比较大鼠肺组织TNF-α和IL-10的表达水平,探讨糖皮质激素经不同给药途径对ALI的保护作用,以期达到减少糖皮质激素用药剂量、降低副作用并提高疗效的目的。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性SD大鼠48只,体重224~271g(由第三军医大学大坪医院实验动物中心提供)。
1.1.2 主要试剂 LPS( L2880美国sigma公司),血清TNF-α、IL-10 ELISA测定试剂盒(山东晶美生物科技有限公司),10%水合氯醛。
1.2 方法
1.2.1 动物分组及处理 将雄性SD大鼠随机分为6组,每组8只:①正常SD大鼠组;②ALI大鼠组;③ALI大鼠气管滴注生理盐水组;④ALI大鼠气管滴注地塞米松组;⑤ALI大鼠腹腔注射生理盐水组;⑥ALI大鼠腹腔注射地塞米松组。第①组至第⑥组均称重记录体重, ①组直接用10%水合氯醛麻醉处死;②组尾静脉注射LPS(5 mg/kg)4 h后用10%水合氯醛麻醉处死;③④组麻醉后固定行气管插管,插管成功后尾静脉注射LPS(5 mg/kg),稳定15 min后③组经气管滴入生理盐水(4 mL/kg),④组气管滴入地塞米松(10 mg/kg), 4h后处死;⑤⑥组尾静脉注射LPS(5mg/kg),15 min后⑤组经腹腔注射生理盐水(4 mL/kg),⑥组经腹腔注射地塞米松(10 mg/kg),4h后用10%水合氯醛麻醉处死;气管插管的老鼠, 中途间断注射10%的水合氯醛维持麻醉状态。所有大鼠处死后开胸取出肺组织,左肺下叶测湿干比,右肺下叶制作切片检测模型效果并作病理学观察,心尖采血离心血清用酶联免疫吸附法(ELISA)检测肺组织TNF-α和IL-10。
1.2.2 肺湿/干重(W/D)比测定 左肺下叶称重(湿重)后置于70℃烤箱至测量值恒定(即为干重),然后计算肺W/D值。
1.2.3 组织学检查 取右肺下叶肺组织用10%甲醛固定24h,石蜡包埋切片,HE 染色,在普通光学显微镜下观察,按照Mikawa、Nishina等[2]推荐的方法从以下四个方面进行肺损伤程度的评分:①肺泡充血;②出血;③间隙或血管壁可见中性粒细胞浸润或聚集;④肺泡间隔增厚或透明膜形成。每项指标病变轻重进行0~4分半定量分析(0=无损伤,1=轻度损伤,2=中度损伤,3=重度损伤,4=极重度损伤),累加各项总分作为ALI的病理评分, 判定肺损伤程度。
1.2.4 对所有大鼠进行心尖采血,分离心血清按照按试剂盒说明书用ELISA法测定各组SD大鼠血清TNF-α和IL-10的浓度。
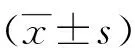
2 结果
各实验组大鼠在尾静脉注射LPS后,均出现呼吸急促,口唇发绀,而地塞米松处理组表现相对较轻,其中气管给药组作用尤为明显,表明ALI造模成功。在实验所设定时间点内所有大鼠均存活。
2.1 病理学观察结果
2.1.1 肉眼观察结果 正常对照组肺表面呈白色略红,组织柔软有弹性;ALI模型组可见肺表面呈暗红色,有明显充血,包膜紧张,表面分布有瘀斑及点状的出血灶; 而给药干预组大体观察均有不同程度减轻且气管给药组减轻程度相对较明显(见图1)。
2.1.2 光镜结果 对照组肺组织结构清晰,肺泡壁薄,肺间质无炎性细胞浸润,肺泡内未见渗液和红细胞;模型组肺损伤最明显,可见肺泡萎陷、肺泡水肿液,肺间质明显增宽、渗出,红细胞渗出,以及透明膜形成及炎性细胞浸润;给药干预组肺泡萎陷、肺泡水肿液,肺间质增宽、红细胞渗出均有不同程度减轻,其中以气管给药干预组效果较明显(见图2)。
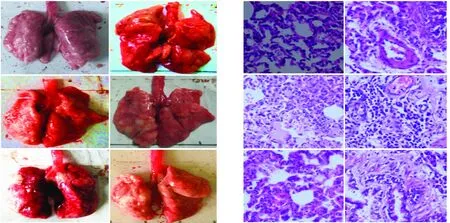
注:A:正常对照组;B:ALI组;C:ALI气管滴生理盐水组;D:ALI气管给药组;E:ALI腹腔注生理盐水组;F:ALI腹腔给药组。 图1 各组大鼠肺脏外观 图2 各组大鼠肺组织HE染色结果(HE×40)
2.1.3 大鼠肺组织损伤评分 相对于正常对照组,各组大鼠肺组织均有不同程度损伤(P<0.05),而相对于模型对照组,腹腔给药和气管给药组大鼠的肺损伤程度均有缓解(P<0.05),就两个给药组而言,气管给药组大鼠的肺损伤程度低于腹腔给药组(见表1)。
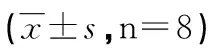
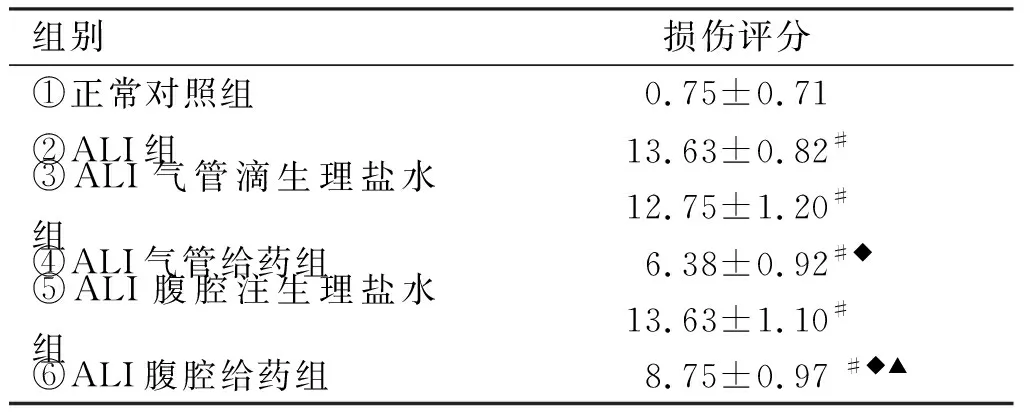
组别损伤评分①正常对照组0.75±0.71 ②ALI组13.63±0.82# ③ALI气管滴生理盐水组12.75±1.20# ④ALI气管给药组6.38±0.92#◆⑤ALI腹腔注生理盐水组13.63±1.10# ⑥ALI腹腔给药组8.75±0.97 #◆▲
注:#vs.①组P<0.05;◆vs.②组P<0.05;▲vs.④组P<0.05。
2.2 肺湿/干重比测定 给大鼠注射LPS,制成ALI模型后,大鼠的肺组织均有明显的增重(P<0.05),给以地塞米松干预后,④组、⑥组大鼠肺组织相比模型组有明显减轻(P<0.01),且④组大鼠肺组织的减轻程度比⑥组明显(P<0.05,见表2)。
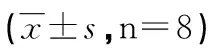
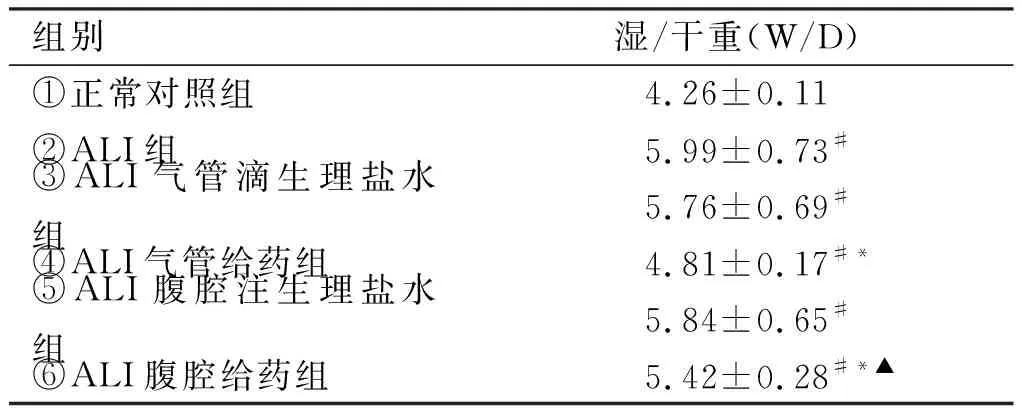
组别湿/干重(W/D)①正常对照组4.26±0.11 ②ALI组5.99±0.73#③ALI气管滴生理盐水组5.76±0.69#④ALI气管给药组4.81±0.17#*⑤ALI腹腔注生理盐水组5.84±0.65# ⑥ALI腹腔给药组5.42±0.28#*▲
注:#vs.①组P<0.05;*vs.②组P<0.01;▲vs.④组P<0.05。
2.3 血清TNF-α和IL-10的表达水平 在给大鼠注射LPS后,TNF-α和IL-10的表达水平均较对照组大幅提高(P<0.05),④组和⑥组大鼠给予地塞米松干预后TNF-α表达水平均较对照组有所下降(P<0.01),气管给药组下降水平明显于腹腔给药组(P<0.05);④组和⑥组大鼠给予地塞米松干预后IL-10表达水平均较对照组有明显提高(P<0.01),气管给药组作用较腹腔给药组明显(P<0.05,见表3)。
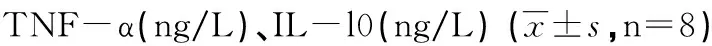
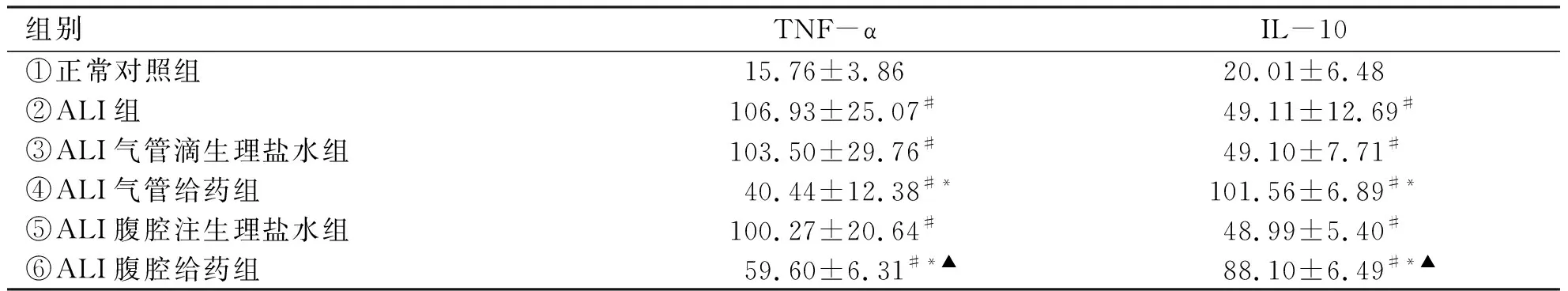
组别 TNF-αIL-10①正常对照组15.76±3.8620.01±6.48 ②ALI组106.93±25.07#49.11±12.69# ③ALI气管滴生理盐水组103.50±29.76# 49.10±7.71# ④ALI气管给药组40.44±12.38#*101.56±6.89#*⑤ALI腹腔注生理盐水组100.27±20.64#48.99±5.40# ⑥ALI腹腔给药组59.60±6.31#*▲88.10±6.49#*▲
注:#vs.①组P<0.05;*vs.②组P<0.01;▲vs.④组P<0.05。
3 讨论
LPS或脓毒血症造成肺泡毛细血管损伤,引起肺水肿,由纤维蛋白,血小板及白细胞聚集可引起微血栓形成,肺动脉压的上升,聚集的血小板释放血管活性物质,补体激活多形核白细胞(PMN)而产生聚集[3]。研究表明,促炎和抗炎因子在ALI的发展过程中起重要作用,促炎因子过度表达,抗炎因子表达不足最终将导致炎症的失控[4-5]。在ALI的发生发展中TNF-α具有触发进一步炎症反应的作用,所以被称之为“早期反应细胞因子”[6],可直接损伤血管内皮细胞,激活PMN和凝血系统、损害肺泡表面活性物质等从而造成ALI[7]。IL-10为机体重要的抗炎因子,可以抑制单核巨噬细胞的作用,抑制TNF-α、IL-1β、PAF、IFN-1 和PLA2促炎因子的产生,缓解炎症,减轻损伤[8]。
当发生ALI时,机体在应激状态下, 肾上腺皮质可的松分泌水平将升高,此时已经存在相对性的肾上腺皮质功能不全, 外源性投用糖皮质激素对于危重患者仅相当于给以替代剂量以缓解或纠正肾上腺皮质功能不全,理论上给予适量激素治疗是可行的,糖皮质激素也可直接、间接作用于与炎症反应有关的炎性细胞及细胞因子等[9]。临床使用糖皮质激素冶疗ALI多是通过静滴或注射,这种全身给药方式用药量大,副作用明显。本研究通过比较地塞米松在不同给药途径下对ALI大鼠的疗效,发现 ALI模型组及各处理组的肺组织W/D比值均明显较正常SD大鼠组高,光镜检查结果也显示肺间质明显增宽、渗出、水肿、 出血、透明膜形成及炎性细胞浸润,与此同时,TNF-α及IL-10均较对照组明显升高,说明ALI模型组及各处理组均有不同程度的炎症发生,在炎症发生的应激条件下,促炎因子和抑炎因子均升高,由于肺组织细胞水肿而导致W/D比值升高。相对于ALI模型组,无论是腹腔给药组还是气管给药组TNF-α浓度、W/D比值均降低,IL-10浓度均升高,说明两种给药方式都有一定的缓解炎症的作用。在促炎因子浓度降低和抑炎因子增加的双重作用下炎症减轻,水肿程度得到缓解,W/D比值降低,但未能恢复到正常水平。相对于腹腔注射地塞米松组,气管滴注地塞米松组的TNF-α浓度、肺组织W/D比值总体降低,而IL-l0浓度总体较高,说明气管给以地塞米松在用药量降低的前提下缓解炎症的作用强于腹腔给药。相应结果在光镜下也得到证实,表明使用地塞米松气管滴注,在降低用药剂量的条件下,仍然具有较好的疗效,提示在临床上通过局部应用糖皮质激素即可避免大剂量用药引起的副反应,还可达到较好的治疗效果。
综上所述,应用糖皮质激素气管给药治疗LPS诱导的大鼠ALI,可增加大鼠TNF-α和IL-10的表达,减轻病理损害,提示通过这种给药方式降低副作用和提高疗效可能是糖皮质激素临床用药可以尝试的途径之一。
[参考文献]
[1] Varpula T, Pettila V, Pintala E,et al. Late steroid therapy in primary acute lung injury[J].Intensive Care Med, 2000, 26(5) : 526- 531.
[2] Mikawa K,Nishina K,Takao Y,et al.ONO-1714,a nitric oxide synthase inhibitor,attenuates endotoxin—induced acute lung in rabbits[J].Anestth Analg,2003,97(6):1751-1755.
[3] 方舒东.急性肺损伤动物模型的建立[J].山西医科大学学报,2002,33(3):280-282.
[4] 钱桂生,陈旭昕.急性肺损伤/急性呼吸窘迫综合征发病机制的研究进展[J].内科理论与实践,2010,5(6):460-463.
[5] 戴田,曹书华.细胞因子在急性肺损伤/急性呼吸窘迫综合征中的作用[J].医学综述,2008,14(6):900-902.
[6] 周满红,李建国,黄祖敏,等.重楼对多发性创伤大鼠的保护作用[J].遵义医学院学报,2008,31(5):461-464.
[7] 美丽班·买买提,祖农·买苏尔.肿瘤坏死因子α与急性呼吸窘迫综合征[J].新医学学刊,2008,5(8):1290-1291.
[8] 陈淑增,王杰华.氟伐他汀预处理对脑缺血再灌注损伤大鼠脑组织及表达的影响[J].免疫学杂志,2012,28(4):309-316.
[9] 常立国,彭守春,李永春.糖皮质激素对急性肺损伤的治疗进展[J].中国全科医学,2006,9(8):684-685.



