符丹丹,顾延会,丁 婷,饶习敏,欧阳瑶
(遵义医学院附属医院 呼吸一科,贵州 遵义 563099)
慢性阻塞性肺疾病(Chronic Obstructive Pulmonary Disease,COPD)是一种以呼气气流受限为特征的慢性气道炎症性疾病,是目前全球第4大死亡原因,且患病率逐年上升[1]。当患者出现咳嗽、咳痰、呼吸困难比平时加重或痰量增加或为黄痰时,提示患者进入了急性加重期,即慢性阻塞性肺疾病急性加重期(Acute exacerbation of chronic obstuctive pulmonary disease,AECOPD)。已经证实,中性粒细胞、巨噬细胞、树突状细胞等炎症细胞参与了AECOPD的发病过程[2]。Chemerin是新近发现的一种脂肪因子,可参与机体的炎症反应[3]。本研究旨在检测AECOPD患者外周血中Chemerin和高
敏C反应蛋白(high sensitivity C Reactive Protein,hsCRP)的水平变化,分析探讨Chemerin在COPD发病过程中的作用和意义。
1 资料与方法
1.1 对象 选取2012年8月至2013年5月在遵义医学院附属医院呼吸一科住院的AECOPD患者50例,其中男42例,女8例,年龄57~73岁(平均68.2岁);同一批住院患者治疗缓解后则进入COPD缓解期组,COPD入选标准符合2011年GOLD指南。选取体检科健康体检对象50例作为正常对照组,其中男39例,女11例,年龄51~76岁(平均65.4岁)。本研究经遵义医学院附属医院医学伦理委员会的批准,并取得研究对象的知情同意。
1.2 方法 所有样本采集均要求研究对象空腹平卧至少8h,一般于清晨使用EDTA-K2采血管收集静脉血4mL,3000r/min离心5min分离血浆,分成小份于-80℃ 保存后择期集中检测。应用酶联免疫吸附法(ELISA)检测血浆Chemerin(Chemerin ELISA 试剂盒购自美国B&D公司)。采血同一时间另送血标本于我院检验科测定白细胞计数、hsCRP的水平。
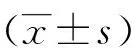
2 结果
2.1 基础资料比较 如表1,3组研究患者的年龄、性别和吸烟指数比较,无统计学意义(P>0.05)。但无论AECOPD组还是缓解期肺功能均低于正常对照组(P<0.05),而COPD患者缓解期肺功能较急性发作期改善,具有统计学意义(P<0.05)。
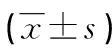
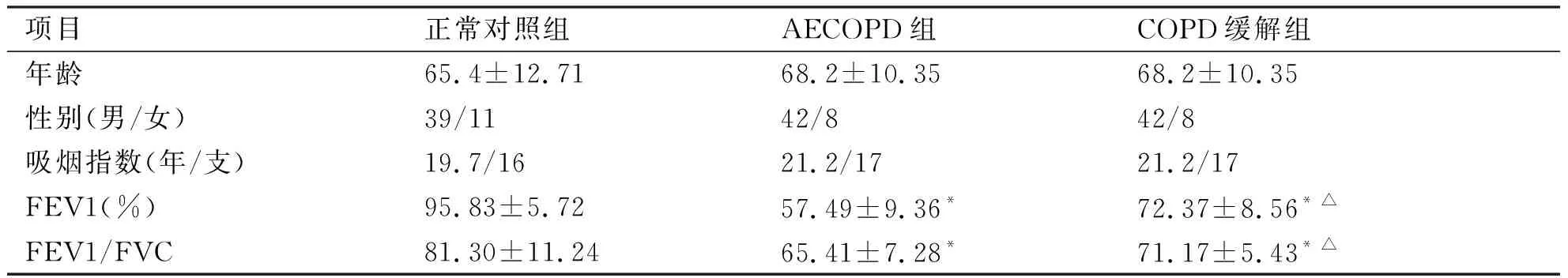
项目正常对照组AECOPD组COPD缓解组年龄65.4±12.7168.2±10.3568.2±10.35性别(男/女)39/1142/842/8吸烟指数(年/支)19.7/1621.2/1721.2/17FEV1(%)95.83±5.7257.49±9.36*72.37±8.56*△FEV1/FVC81.30±11.2465.41±7.28*71.17±5.43*△
*与正常对照组比较,P<0.05;△与AECOPD组比较,P<0.05。
2.2 3组患者外周血炎症标志物和Chemerin水平比较 AECOPD患者多合并严重的感染,因此具有明显的炎症反应。AECOPD患者外周血白细胞计数和hsCRP浓度明显高于正常对照组和COPD,差异具有统计学意义(P<0.05);且随着COPD病情好转,由急性发作期转为缓解期后,白细胞计数和hsCRP水平明显降低,与正常对照组无差异,提示严重反应减轻。同时,外周血Chemerin浓度水平也具有相似的变化趋势,即AECOP患者外周血Chemerin浓度明显高于正常对照组和CDOP缓解期患者,差异具有统计学意义(P<0.05),而随着COPD缓解,Chemerin水平明显下降,基本达到正常人水平(见表2)。
2.3 COPD患者外周血Chemerin和hsCRP相关性分析 相关性分析研究显示,在COPD患者中,外周血Chemerin浓度与炎症标志物hsCRP浓度呈正相关(见图1,r= 0.659,P<0.05)。
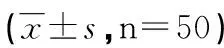
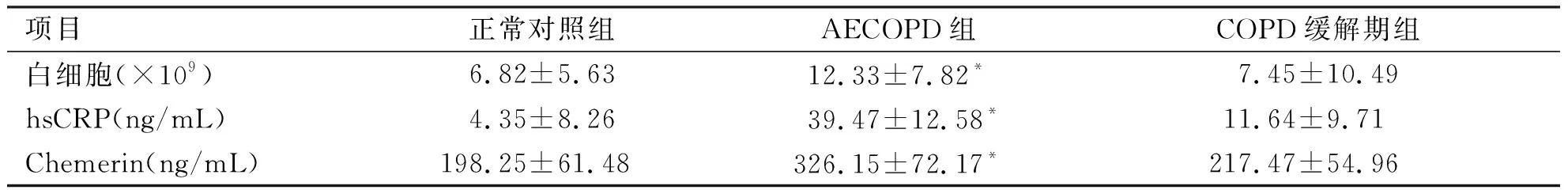
项目正常对照组AECOPD组COPD缓解期组白细胞(×109)6.82±5.6312.33±7.82*7.45±10.49hsCRP(ng/mL)4.35±8.2639.47±12.58*11.64±9.71Chemerin(ng/mL)198.25±61.48326.15±72.17*217.47±54.96
*与COPD缓解期及正常对照组比较,P<0.05。
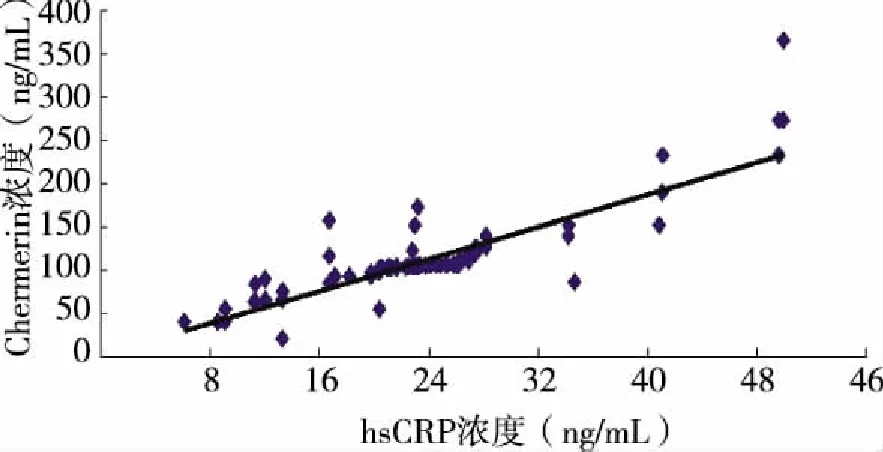
图1 外周血Chemerin浓度与炎症标志物hsCRP浓度变化的比较
3 讨论
2003年,Wittamer等在卵巢癌患者腹腔积液中分离获得Chemerin。Chemerin具有趋化白细胞的功能,其受体为ChemR23(chemokine like receptorl,CMKLR1)属于G蛋白偶联受体,主要分布在浆细胞样树突状细胞(Dendritic Cells,DCs)和巨噬细胞膜上[4-5]。肺脏、淋巴结和脾脏等均已发现存在丰富的ChemR23。Chemerin是由大部分机体细胞产生的,主要是以其前体形式存在proChemerin,并分泌到细胞外。Chemerin-ChemR23通路在炎症反应、脂肪代谢等方面都具有重要功能。当机体受到炎症刺激时,Chemerin发生活化,其通过与pDCs和巨噬细胞膜上的ChemR23特异性结合,使未成熟DCs(imDCs)通过血管内皮到达炎症反应部位[6],在炎症因子的作用下,imDCs逐渐成熟并发挥抗原递呈作用,即将抗原递呈给T细胞,引发机体免疫应答。
本课题组既往研究发现,COPD患者诱导痰中DCs含量明显增多,且与肺功能严重程度呈正相关,由此推测DCs参与了COPD的发病过程,并启动了机体的免疫应答。这些结果与国外报道结果类似[7]。但DCs是如何到达炎症部位发挥作用的一直未能阐明。有研究发现[8],采用ChemR23基因缺乏大鼠构建的COPD动物模型,其支气管肺泡灌洗液(Bronchotracho Alveolar Larvage,BAL)中中性粒细胞、DCs及CD4+ T细胞数量明显下降,且Chemerin表达亦显着下降,推测Chemerin在炎症反应早期即参与了COPD的发病过程,提示Chemerin可能参与连接特异性免疫应答及非特异性免疫应答的重要环节。本研究结果显示,AECOPD患者外周血白细胞计数和hsCRP浓度明显高于正常对照组和COPD;随着COPD病情好转,由急性发作期转为缓解期后,白细胞计数和hsCRP水平明显降低,与正常对照组无差异,提示严重反应减轻。同时,外周血Chemerin浓度水平也具有相似的变化趋势,即AECOPD患者外周血Chemerin浓度明显高于正常对照组和COPD缓解期患者,而随着COPD缓解,Chemerin水平明显下降,基本达到正常人水平,这表明,Chemerin参与可能参与COPD急性发作的病理过程。
众所周知,白细胞能够消灭入侵机体的病原体,并产生抗体、参与机体免疫反应,是机体抵御病原体入侵的主要防线。作为炎症反应标志物hsCRP能够提高白细胞的吞噬能力,与其受体结合会产生一系列的细胞因子造成组织损伤。本研究同时测定了白细胞及hsCRP在AECOPD、COPD缓解期及正常对照组中浓度,结果发现,AECOPD组白细胞及CRP含量均高于COPD缓解期及正常对照组。通常认为,hsCRP是早期感染的检测指标之一,本研究在AECOPD患者外周血中hsCRP含量明显升高,且白细胞亦同时增高,同时检测Chemerin浓度在AECOPD显着增加,并与hsCRP浓度呈正相关,说明Chemerin确实参与了早期炎症反应。COPD的发病机制中炎症是最主要的,当COPD发生急性加重时往往发生了严重的肺部感染,这时炎症细胞可吸引proChemerin到达炎症部位,经过脱氨基等一系列反应Chemerin去前体化,开始发挥其趋化imDCs的功能,使imDCs到达炎症部位,逐渐发挥其抗原递呈作用。
总之,本研究结果证实在AECOPD患者,外周血中Chemerin浓度同炎症标志物一样明显升高,提示Chemerin可能参与了COPD的炎症过程。但Chemerin水平升高是继发于炎症之后,还是于炎症早期即升高,其与COPD的关系以及对COPD患者预后意义,尚不明确,需要进一步深入研究。
[参考文献]
[1] Vestbo J, Hurd S S, Agusti A G, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary[J]. Am J Respir Crit Care Med, 2013, 187(4): 347-365.
[2] 饶习敏,欧阳瑶,顾延会.慢性阻塞性肺疾病大鼠肺组织中树突状细胞的变化[J].遵义医学院学报,2013,36(5):410-412.
[3] Cash J L,Hart R,Russ A,et al. Synthetic chemerin-derived peptides suppress inflammation through ChemR23[J].J Exp Med,2008,205(4):767-775.
[4] Wittamer V, Franssen J D, Vulcano M, et al. Specific recruitment of antigen presenting cells by chemerin, a novel processed ligand from human inflammatory fluids[J]. J Exp Med, 2003, 198(7): 977-985.
[5] Zabel B A, Ohyama T, Zuniga L, et al. Chemokine-like receptor 1 expression by macrophagesinvivo: regulation by TGF-beta and TLR ligands[J]. Exp Hematol,2006, 34(8): 1106-1114.
[6] Penna G, Sozzani S, Adorini L. Cutting edge: selective usage of chemokine receptors by plasmacytoid dendritic cells[J]. J Immunol, 2001, 167(4):1862-1866.
[7] 符丹丹,欧阳瑶,李书光.慢性阻塞性肺疾病患者诱导痰中DCs及CCR6的变化及意义[J].山东医药,2011,51(48):7-9.
[8] Demoor T, Bracke K R, Dupont L L, et al. The role of ChemR23 in the induction and resolution of cigarette smoke-induced inflammation[J].Immunol,2011,186(9):5457-5467.



