李长福,梁大敏,束 波,杨加伟,生 欣,范 芳
(遵义医学院 生物化学教研室,贵州 遵义 563099)
在细胞的生存过程中DNA会遭受各种内外源性因素的损伤,使DNA发生单链或双链断裂(double-stranded breaks, DSBs),如果这些损伤得不到及时修复,可引起细胞基因组不稳定性增加,最终导致细胞死亡,这也是抗癌药物致肿瘤细胞死亡的主要机制[1-2]。非同源重组修复(nonhomologous end-joining,NHEJ)是哺乳动物细胞中最重要的一种修复机制, DNA依赖性蛋白激酶催化亚基(DNA-dependent kinase catalytic subunit,DNA-PKcs)是NHEJ的核心组分,在DSBs修复及癌症预防方面发挥重要作用[3-4]。
为进一步研究DNA-PKcs在NHEJ修复通路及肿瘤细胞DNA损伤修复中的作用,本研究将靶向DNA-PKcs的干扰质粒shDNA-PKcs转染肝癌耐药细胞BEL7402/5-FU,观察DNA-PKcs基因沉默对其下游分子Artemis的激活作用,探讨DNA-PKcs基因影响肝癌细胞Bel7402/5-FU 耐药性的可能机制。
1 材料与方法
1.1 材料 PRNAi-U6.1-Neo shRNA质粒(百奥迈科生物科技有限公司),BEL7402/5-FU细胞株(南京凯基公司), LipofectamineTM2000 Reagent(Invitrogen公司),DNA-PKcs抗体(Assay biotech公司),Artemis抗体及P-Artemis抗体(abcam公司)。
1.2 方法
1.2.1 细胞培养 用含10%FBS、20 μg/mL 5-FU的1640培养液培养BEL7402/5-FU细胞,置于37 ℃、5%CO2孵箱中培养,细胞贴壁生长,隔天传代。
1.2.2 细胞转染 将培养好的BEL7402/5-FU细胞分为4组:空白对照组、脂质体组、空质粒组和shDNA-PKcs转染组。细胞计数后,将BEL7402/5-FU细胞按8×104细胞/孔接种于6孔培养板中,当细胞生长到70%~80%融合时进行转染,按200 μL/孔将质粒-脂质体复合物加至相应培养孔中,6 h后换液。
1.2.3 实时荧光定量PCR检测DNA-PKcs mRNA水平的表达 按Trizol®Reagent试剂盒说明书提取各组细胞总RNA行real-time PCR扩增,DNA-PKcs及β-actin引物见参考文献[5]。实验组和对照组DNA-PKcs mRNA表达量通过公式2-( △△CT)分析计算。
1.2.4 Western blot检测DNA-PKcs、Artemis及P-Artemis蛋白表达 按常规方法提取各组细胞总蛋白,BCA法计算样品蛋白浓度。取50 μg蛋白样品与上样缓冲液混匀,SDS-PAGE电泳后转移到NC膜上,室温封闭1h,加一抗4℃过夜,用TBST洗膜3次。加二抗37℃孵育1h后TBST洗膜3次,用ECL发光液显色曝光,Quantity One定量分析软件分析灰度比。
2 结果
2.1 DNA-PKcs mRNA水平表达 实时荧光定量PCR检测结果显示(见图1):各对照组细胞中DNA-PKcs mRNA表达无明显差异(P>0.05),shDNA-PKcs转染组DNA-PKcs mRNA的表达较对照组明显下调(P<0.01)。
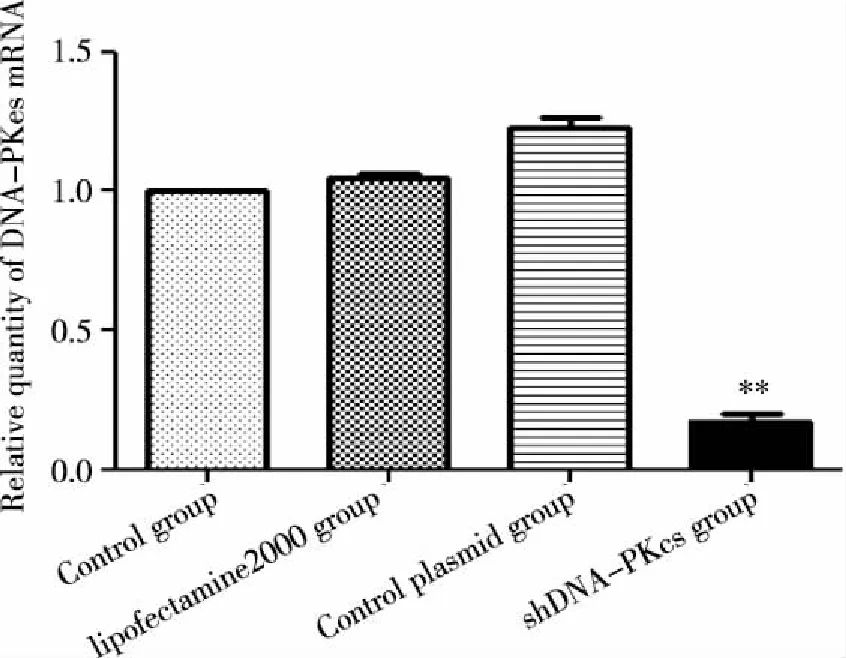
**:与空白对照组相比图1 各组细胞DNA-PKcs mRNA相对表达量
2.2 DNA-PKcs、Artemis及P-Artemis蛋白的表达 转染shDNA-PKcs 48h后收集细胞,通过Western blot检测各组细胞DNA-PKcs、Artemis及P-Artemis蛋白的表达。Western blot检测结果显示(见图2~4):各对照组细胞中DNA-PKcs、Artemis及P-Artemis蛋白的表达无明显变化(P>0.05);shDNA-PKcs转染组DNA-PKcs、Artemis蛋白表达均下降,与对照组比较差异有统计学意义(P<0.05);shDNA-PKcs转染组P-Artemis蛋白表达与对照组比较无差异 (P>0.05)。
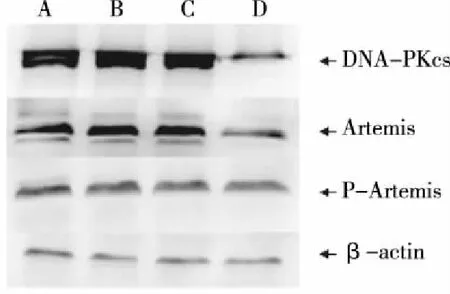
A:空白对照组;B:脂质体组;C:质粒对照组;D:shDNA-PKcs转染组。图2 各组细胞DNA-PKcs、Artemis和P-Artemis蛋白表达情况

**:与空白对照组相比 P<0.05。图3 各组细胞DNA-PKcs蛋白的表达
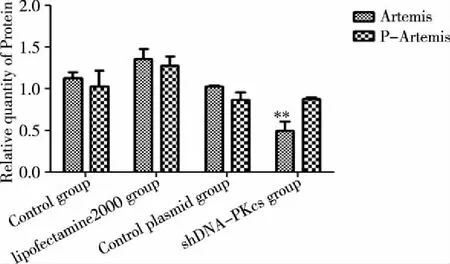
**:空白对照组相比 P<0.05。图4 各组细胞Artemis和P-Artemis蛋白表达情况
3 讨论
目前认为,肿瘤的发生与细胞DNA损伤及其修复机制缺陷有关,而肿瘤细胞对放化疗的敏感性主要取决于细胞DNA损伤修复的能力。NHEJ是哺乳动物细胞中最重要的一种修复机制,DNA-PKcs是NHEJ的核心组分,在DSBs修复及癌症预防方面发挥重要作用[3-4]。在NHEJ中,Artemis是DNA-PKcs的下游靶分子,在DNA损伤修复、细胞周期检测及肿瘤耐药中均起关键作用。
DNA -PKcs是由4128个氨基酸组成的相对分子量为469kD的大分子量蛋白质,当细胞发生DSBs时,DNA-PKcs招募NHEJ中的组分Ku70/80迅速结合到DNA断端,通过自身磷酸化和磷酸化下游蛋白如Artemis、DNA ligase4、XRCC4等对损伤DNA进行修复[6-7]。DNA-PKcs被认为具有肿瘤抑制功能,能维持基因组稳定性。目前已有一些研究表明下调DNA-PKcs能增加肿瘤细胞对药物的敏感性[8-9]。在NHEJ中,Artemis是DNA-PKcs的下游靶分子,具有多个DNA-PKcs的磷酸化位点[10-12]。本课题组前期研究工作发现:转染靶向DNA-PKcs的干扰质粒后,肝癌耐药细胞BEL7402/5-FU对化疗药物的敏感性增加[5],而DNA-PKcs是NHEJ修复通路中的核心组分,说明肿瘤细胞中DNA损伤修复与肿瘤耐药有关。为进一步了解DNA损伤修复与肝癌细胞耐药的机制,观察肝癌耐药细胞在DNA损伤修复过程中DNA-PKcs基因对其下游靶分子的激活情况,探讨NHEJ修复通路肝癌耐药中所起的作用,本实验用Western blot法检测了转染shDNA-PKcs后各组细胞Artemis、P-Artemis蛋白表达情况,结果显示DNA-PKcs沉默后肝癌耐药细胞BEL7402/5-FU中DNA-PKcs及Artemis蛋白表达减少,说明DNA-PKcs表达的抑制可以下调其下游靶分子Artemis的表达;而转染组P-Artemis表达与对照组相比无差异,说明DNA-PKcs的沉默不能抑制Artemis的磷酸化,因此推测Artemis不仅是DNA-PKcs的下游靶分子,还有可能是其他信号通路的靶分子。事实上,有研究表明Artemis参与NHEJ修复过程中还需要ATM的激活[13-14]。因此DNA-PKcs沉默所致Bel7402/5-Fu细胞耐药性降低,不一定与DNA-PKcs/Artemis通路有关,可能还有其他信号通路共同参与,其作用机制还需要进一步研究。
[参考文献]
[1] Lord C J, Ashworth A. The DNA damage response and cancer therapy[J].Nature, 2012, 481(7381): 287-294.
[2] Curtin N J. DNA repair dysregulation from cancer driver to therapeutic target[J].Nat Rev Cancer, 2012, 12(12): 801-817.
[3] Hsu F M, Zhang S, Chen B P. Role of DNA-dependent protein kinase catalytic subunit in cancer development and treatment[J]. Transl Cancer Res, 2012, 1(1): 22-34
[4] Lee K J, Lin Y F, Chou H Y, et al.Involvement of DNA-dependent protein kinase in normal cellcycleprogression through mitosis[J]. J Biol Chem,2011,286(14): 12796-12802.
[5] 梁大敏,束波,杨加伟,等. shRNA沉默DNA-PKcs表达对肝癌耐药细胞BEL7402/5-Fu耐药性的影响[J].遵义医学院学报, 2014,37(3):81-85.
[6] Uematsu N, Weterings E, Yano K, et al. Autophosphorylation of DNA-PKCS regulates its dynamics at DNA double-strand breaks[J]. J Cell Biol,2007,177(2): 219-229.
[7] Nishida Y, Mizutani N, Inoue M, et al. Phosphorylated Sp1 is the regulator of DNA-PKcs and DNA ligase IV transcription of daunorubicin-resistant leukemia cell lines[J]. Biochim Biophys Acta,2014,1839(4): 265-274.
[8] Evert M, Frau M, Tomasi M L, et al.Deregulation of DNA-dependent protein kinase catalytic subunit contributes to human hepatocarcino genesis development and has a putative prognostic value[J].Br J Cancer,2013,109(10):2654-2664.
[9] Cornell L,Munck J,Curtin N, et al. PTU-042 DNA-PKor ATM inhibition inhibits non-homologous end joining and enhances chemo- and radio sensitivity in hepatocellular cancer cell lines[J].Gut,2012,61: A201.
[10] Lundholm L, Hååg P, Zong D, et al. Resistance to DNA-damaging treatment in non-small cell lung cancer tumor-initiating cells involves reduced DNA-PK/ATM activation and diminished cell cycle arrest[J]. Cell Death Dis, 2013, 4: e478.
[11] Lieber M R. The mechanism of double-strand DNA break repair by the nonhomologous DNA end joining pathway[J]. Annu Rev Biochem , 2010, 79: 181-211.
[12] Goodarzi A A, Yu Y, Riballo E, et al. DNA‐PK autophosphorylation facilitates Artemis endonuclease activity[J]. Embo J, 2006, 25(16): 3880-3889.
[13] Lee B S, Gapud E J, Zhang S, et al. Functional Intersection of ATM and DNA-Dependent Protein Kinase Catalytic Subunit in Coding End Joining during V(D)J Recombination[J]. Mol Cell Biol ,2013,33(18):3568-3579.
[14] Kurosawa A, Adachi N. Functions and regulation of Artemis: a goddess in the maintenance of genome integrity[J]. J Radiat Res, 2010, 51(5): 503-509.



