张 意,周时高,王兴荣,陆伟兰,熊 漫,王 淼
(1.上海中医药大学附属龙华医院 中医经典病房,上海 徐汇 200032;2.上海市金山区中西医结合医院 内科,上海 金山 200082)
肥胖(Obesity)、2型糖尿病(Type 2 diabetes mellitus,T2DM)以及非酒精性脂肪性肝病(Nonalcoholic fatty liver disease,NAFLD)均是与生活方式密切相关的内分泌代谢疾病,三者之间关系密切。脂代谢异常是三者之间的关键环节。而脂代谢相关指标,如血浆甘油三酯(Triglyceride,TG)可作为一种简单有效的方法用来评估T2DM、NAFLD以及心血管疾病等内分泌代谢性相关疾病的发病风险[1]。
MicroRNA是一类内源性的非编码小RNA分子,可以通过与靶基因miRNA碱基配对引导沉默复合体抑制miRNA的翻译或直接降解miRNA,从而沉默编码基因的表达。研究表明,miRNA在许多疾病的发生发展过程中,起着重要的调节作用。miRNA可以通过调控细胞的分化、增殖和程序性死亡等多种生理病理过程来影响癌症的发生与发展[2-3]。miRNA也可以通过调控机体的炎症、氧化应激以及自噬等多种通路途径来调节其脂肪细胞分化情况和糖脂代谢水平[4-5]。调查显示,人体血浆中的miRNA谱与其它组织器官存在着显着的表达差异,这提示了组织细胞会选择性的分泌释放部分miRNA参与机体代谢的调节[6]。由于miRNA在调节脂肪组织的分布及代谢功能中起着重要的作用[7],因此,循环miRNA就可能成为诊断和治疗肥胖及其相关疾病潜在的治疗靶点和生物标记物[8]。本研究中,我们应用了miRNA芯片和定量RT-PCR的检测方法,比较了高甘油三酯血症患者和健康对照组人群血浆miRNA的表达差异,筛选出可能作为高甘油三酯血症的诊断标志物以及作为肥胖、非酒精性脂肪性肝病等脂代谢异常疾病的治疗靶点。
1 材料与方法
1.1 研究对象 选取2016年12月至我院体检的高甘油三酯血症患者137例及健康对照人群161例纳入研究。高甘油三酯血症组:男52例,女85例;年龄38~73岁,平均年龄(41.1±10.2)岁。健康对照组:男64例,女97例;年龄35~74岁,平均年龄(39.3±10.6)岁。两组一般资料纳入统计学软件进行对比,组间差异无统计学意义(P>0.05),具有可比性。本试验的开展已通过上海中医药大学附属龙华医院伦理委员会的审批。
纳入标准:①年龄40~75岁,患者及家属均充分了解本次研究内容,并签订相关知情同意书;②高甘油三酯血症组的诊断参照2016年中华医学会发布的《中国成年人血脂异常防治指南》,即TG≥1.7 mmol/L;③健康对照组患者的血脂属于正常范围。
排除标准:胆囊疾病、肾脏疾病、精神疾病、认知障碍、交流障碍、血液疾病、免疫性疾病等;1月内有酗酒以及过度吸烟、因用药导致血脂水平异常升高的患者。
1.2 血浆分离和miRNA抽提 每例患者收集 EDTA抗凝全血5 mL,静置15 min后于4℃ 1620 g的条件下离心15 min,取上清至无菌无RNase的离心管中即为血浆样本。
血浆miRNA的提取使用mirVana PARIS试剂盒(Ambion,US),按照试剂盒说明书提供的标准操作流程进行样品的total RNA抽提,抽提所得经Agilent Bioanalyzer 2100(Agilent technologies,Santa Clara,US)电泳质检合格后备用。
1.3 芯片实验 miRNA芯片使用的是Agilent Human miRNA(8*60K)V21.0芯片,miRNA数据库来源于Sanger microRNA数据库(miRbase)21.0版本,覆盖了2549个人类相关的miRNAs。
样品RNA采用Agilent miRNA芯片配套提供的试剂盒miRNA Complete Labeling and Hyb Kit (Agilent technologies,Santa Clara,US),按照标准操作流程的标记部分对样品中的miRNA分子进行杂交实验。样品在滚动杂交炉中滚动杂交20 h,杂交完成后在洗缸中洗片,洗片所用的试剂为Gene Expression Wash Buffer Kit(Agilent technologies,Santa Clara,US)。芯片结果采用Agilent Microarray Scanner进行扫描,用Feature Extraction software 10.7.1.1读取数据,最后采用Gene Spring Software 12.6进行归一化处理,所用的算法为Quantile。
1.4 逆转录和RT-PCR miRNA的逆转录选用miRcute miRNA cDNA第一链合成试剂盒(TIANGEN,Beijing,China),RT-PCR选用miRcute Plus miRNA qPCR Kit miRNA荧光定量检测试剂盒(TIANGEN,Beijing,China)将稀释引物至10μM,稀释探针至5μM,以U6作为内参照,目的基因和参照基因每个组各设至少两个复孔,按照试剂盒说明书提供的标准操作流程进行操作实验,用ABI Step One Plus Real-Time PCR System进行融解曲线分析(Melting/Dissociation Curve Analysis)。PCR反应条件:95 ℃预变性15min,94 ℃变性20 s,60 ℃退火34 s,40~45个循环。
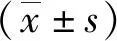
2 结果
2.1 临床资料分析 本研究共纳入高甘油三酯血症患者137例及健康对照人群161例。比较两组研究对象之间年龄、性别分布差异无统计学意义(P>0.05),而高甘油三酯血症组(Hypertriglyceridemia,HTC)血浆甘油三酯高于健康对照组(Normal triglyceride,NTC),差异有统计学意义(P<0.05,见表1)。
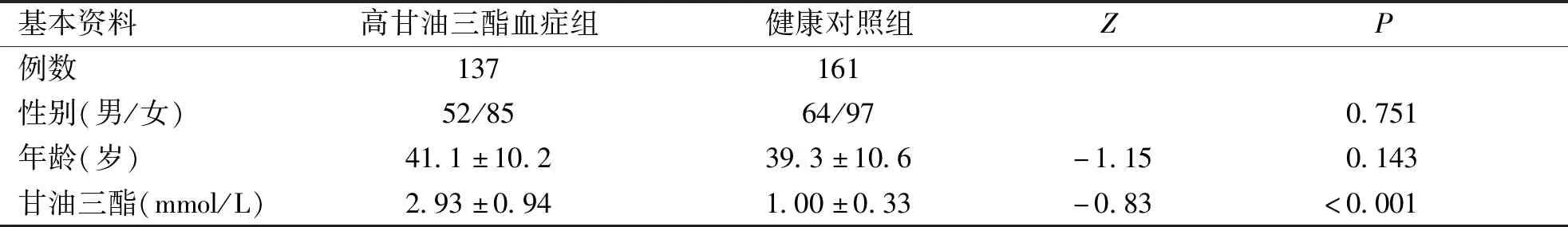
表1 298例临床样本资料分析
2.2 miRNA芯片实验 分别选取高甘油三酯血症患者及健康对照人群血浆样本各3例进行miRNA芯片实验。通过对芯片结果的比较和分析,计算样本之间的相关系数。样品相关系数图显示两组研究对象之间的基因表达存在显着差异(见图1A)。原始数据通过Gene Spring Software软件进行归一化,得到的差异基因散点图同样显示两组间存在表达显着差异的基因位点(见图1B)。最终,采用表达差异倍数(Fold change)以及t检验的统计学方法对差异基因进行筛选,选出12个有显着差异的miRNAs,详见表2。
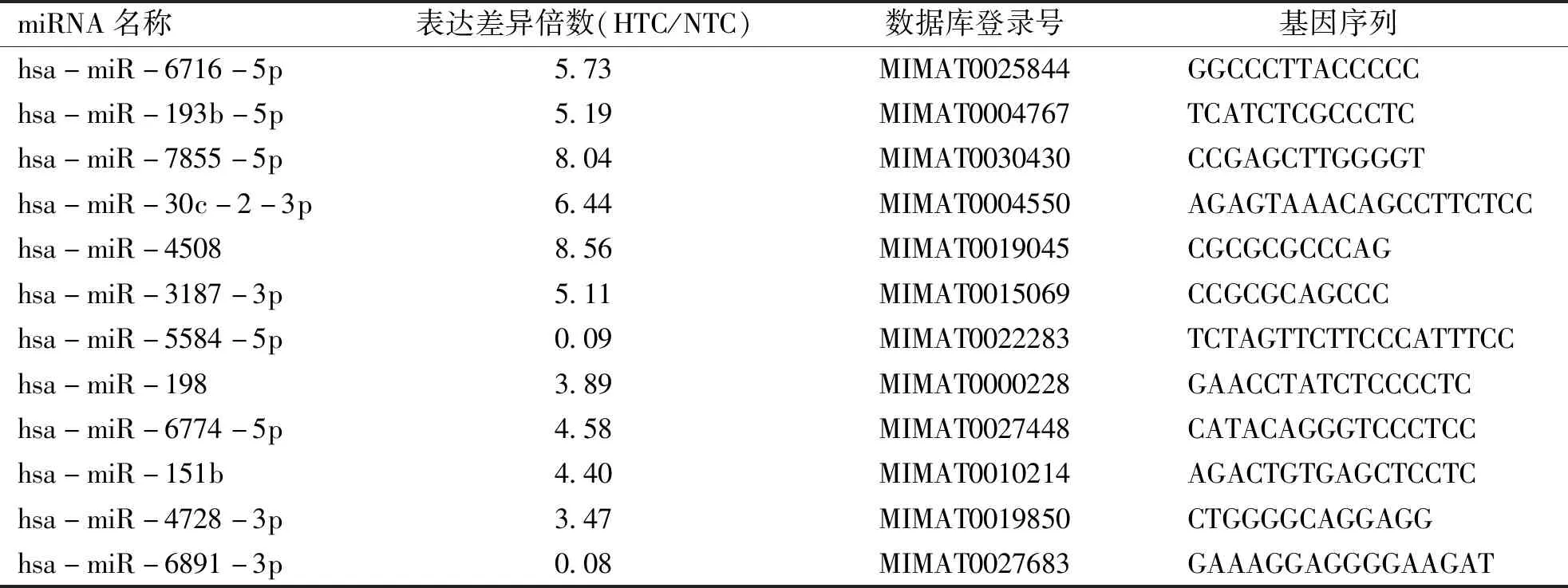
表2 miRNA芯片表达差异分析

A:miRNA芯片实验样品相关性系数图,表示样品基因之间的表达关系及差异情况;N:健康对照组;H:高甘油三酯血症组;B:差异基因散点图,落在图形中位线两侧45°线之外的点,代表这个探针点在两张芯片中信号值差异fold change>2,g1:健康对照组,g2:高甘油三酯血症组。图1 miRNA芯片实验样品相关性系数图和差异基因散点图
2.3 RT-PCR 根据miRNA芯片实验结果,设计相应的探针及特异性扩增引物,本研究选用U6作为内参基因。miRNAs的特异性引物由上海闪晶分子生物科技有限公司合成,引物序列见表3。
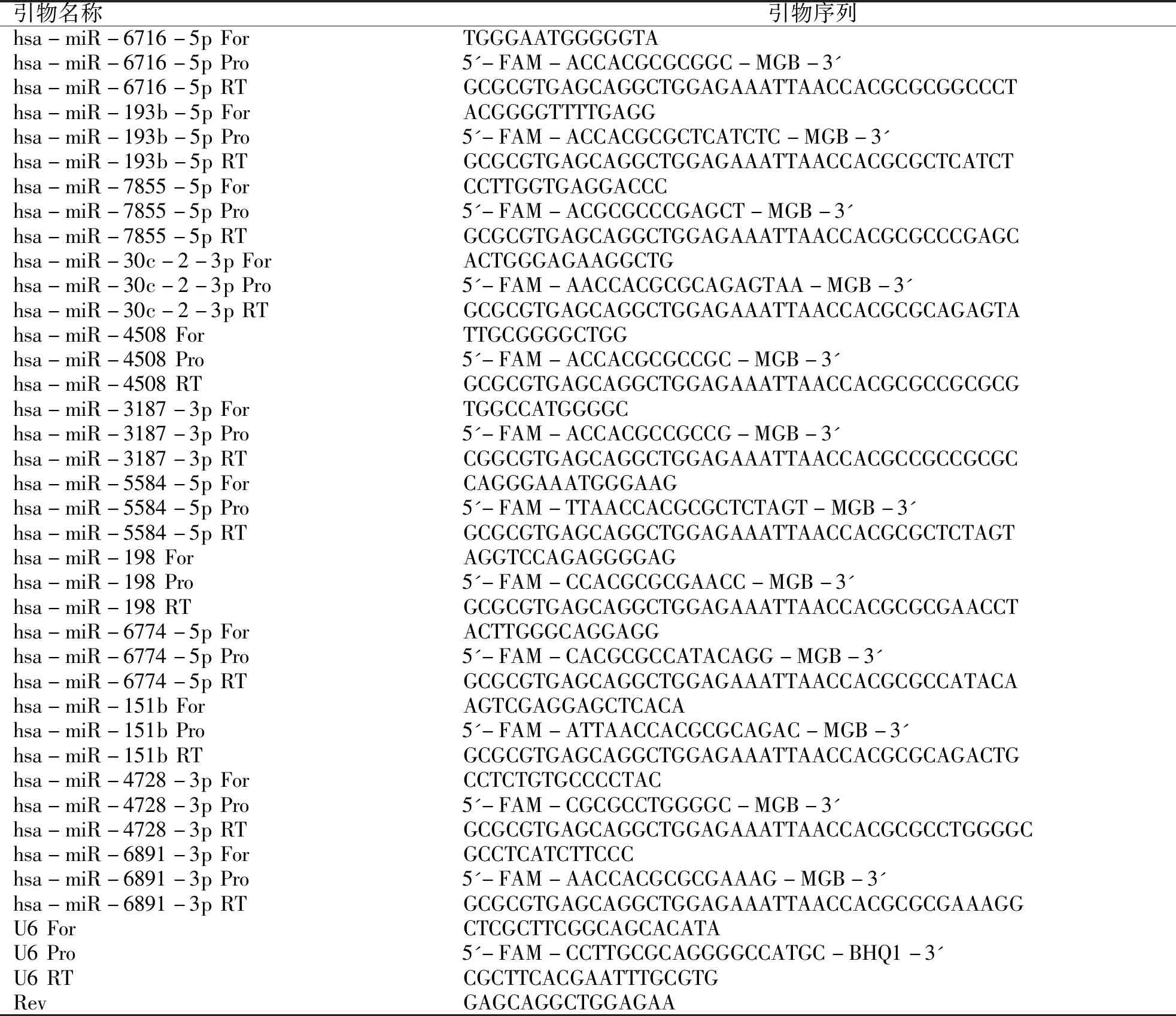
表3 RT-PCR引物序列
在全部298例临床样本中针对miRNA芯片筛选出的12个候选miRNAs采用RT-PCR的方法进行验证。结果显示,与健康对照人群相比,高甘油三酯血症患者血浆hsa-miR-4728-3p表达水平明显升高,差异有统计学意义(P<0.05)。而包括miR-6716-5p、miR-193b-5p、miR-7855-5p、miR-30c-2-3p、miR-4508、miR-3187-3p、miR-5584-5p、miR-198、miR-6774-5p、miR-151b、miR-6891-3p在内的其余11个miRNAs在两组之间血浆表达水平无明显差异(P>0.05,见图2)。
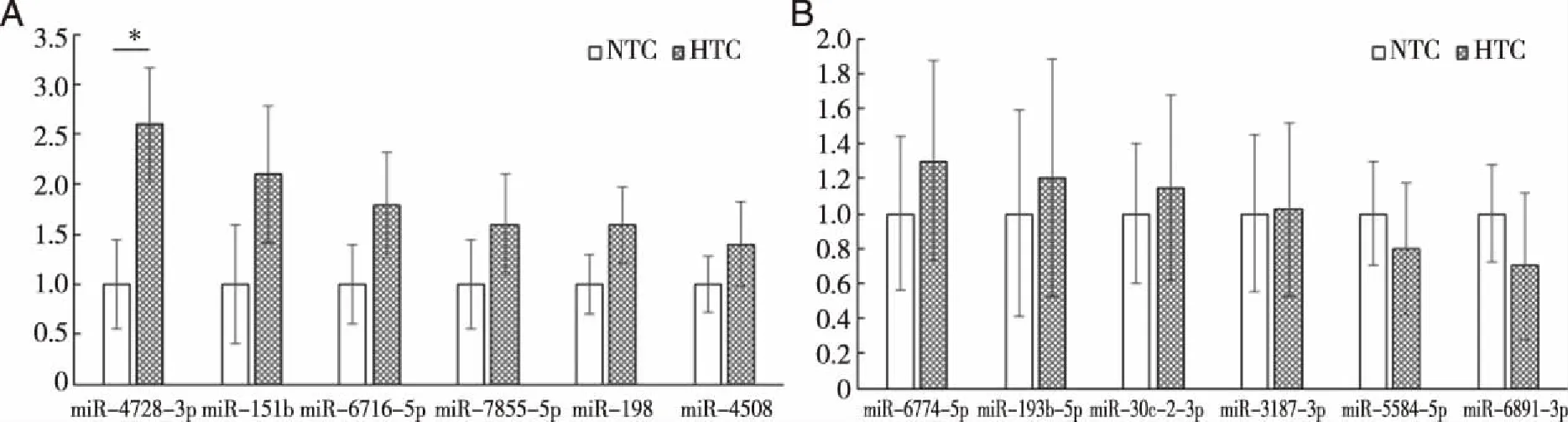
图2 miRNA血浆表达水平差异
3 讨论
近年来,随着肥胖、2型糖尿病、非酒精性脂肪性肝病等多种以糖脂代谢紊乱为代表的慢性内分泌代谢疾病的广泛流行,各国的医疗工作者已经进行了大量相关研究。研究认为,各种以糖脂代谢紊乱为标志的代谢性疾病,其中心环节在于胰岛素抵抗,而在胰岛素抵抗的发生与发展过程中,肥胖是一个重要的影响因素[9]。肥胖患者过度堆积的内脏脂肪会导致脂肪细胞的异常肥大,而肥大的脂肪细胞由于其细胞膜上胰岛素受体数量的相对减少,会导致机体胰岛素敏感性及反应性的降低,从而引发胰岛素抵抗[10]。胰岛素抵抗,又会使外周组织对葡萄糖的利用率和对肝糖原生成的抑制作用明显降低,进而导致游离脂肪酸的升高[11]。升高的游离脂肪酸可使胰岛β细胞中甘油三酯和神经酰胺的合成增多,其中,甘油三酯的异常增高又会促使脂肪重新分布,在一定程度上加重肥胖的程度[12]。由此,糖脂代谢的异常就形成了互为因果的恶性循环。
研究显示,miRNA可有效控制炎症、改善胰岛素抵抗、抑制脂滴的形成[13-14]。本研究通过对高甘油三酯血症患者和健康对照人群的血浆miRNA表达谱进行分析,希望找出能够作为高甘油三酯血症的诊断标志物及治疗靶点。目前,人类基因库中已发现2 000多种miRNA,参与了人体内半数以上mRNA的调控环节,人体外周血液循环中也存在稳定表达且数量较多的miRNA,miRNA可作为一类新型的疾病生物标志物[15]。miRNAs与肥胖和糖尿病关系密切,其通过诸多代谢关键靶点调节糖代谢、脂代谢及线粒体功能等,进而参与代谢性疾病、心血管疾病的发生发展过程,在机体糖脂代谢紊乱的病理状态下,相关 miRNA 的表达能够快速、显着的出现异常,比如:有研究表明高脂血症患者的miR-365的表达水平明显高于正常个体[16];在高糖高脂的刺激下,血清miR-25-5p、miR-4658、miR-4773、miR-4132、miR-5771-5p和miR-3165在人群中显着升高,miR-130b和miR-494-5p明显降低[17];miR-7在胰岛细胞中高表达并参与了胰岛素的生物合成和分泌等过程[18];miR-126通过调节靶向胰岛素受体底物1的水平间接参与了胰岛素抵抗的发展[19]。因此,miRNAs可能成为代谢性疾病诊断和预后的重要潜在生物标志物。
我们的芯片实验结果初步筛选出二者之间表达显着异常的12个miRNAs,而后通过RT-PCR的方法进行进一步验证,最终发现与健康对照人群相比,高甘油三酯血症血浆hsa-miR-4728-3p表达水平明显升高。有趣的是,在与肿瘤相关的研究中,预测miR-4728-3p的靶基因共有54个,靶基因功能主要富集于转录活性调节、DNA结合及蛋白质磷酸化氨基酸结合等方面[20];miR-4728-3p被认为能够下调MAPK信号通路的表达水平,而MAPK/mTOR信号通路能有效抑制细胞自噬的发生[21-22]。最新研究表明,自噬在细胞脂质代谢的过程中起着至关重要的作用[23]。脂肪细胞因子的异常释放能够激活细胞的自噬信号通路,从而清理细胞内受损的细胞器以及脂滴等脂毒性代谢产物,改善机体的炎症及氧化应激状态,调节脂肪的重新分布[24-25]。因此,调节细胞的自噬水平,保障细胞的代谢活力就成为了治疗糖脂代谢紊乱疾病的一个有效途径。我们认为,高甘油三酯血症患者血浆miR-4728-3p表达水平的升高,很可能揭示了机体应激性自噬激活的生理过程,而该miRNA则有可能成为脂代谢异常疾病,尤其是高甘油三酯血症的治疗靶点。
值得一提的是,在之前的一些研究中有报道miR-30c能够影响人体脂肪的重新分布以及脂肪细胞因子的释放[26]。高表达的miR-30c可以抑制纤溶酶原激活物抑制物1(PAI-1)的mRNA和蛋白表达,导致血管内皮细胞活力和迁移能力明显增强,从而参与代谢相关的心血管疾病[27];miR-30c还能通过沉默自噬相关蛋白Beclin-1,抑制自噬,从而保护糖代谢紊乱时的心脏功能,NF-κB是miR-30c重要的正向调控因子[28];MiR-30c能诱导肿瘤细胞程序性死亡发挥抑癌作用,RAS/MAPK/ERK为MiR-30c的主要信号调控通路[29]。然而,在本研究中,尽管芯片实验的初步筛选过程中发现了血浆miR-30c-2-3p水平的异常表达,但是,在后续的RT-PCR验证中该miRNA在两组人群之中却并未显示出有统计学意义的表达差异(见图2)。考虑到可能是由于本研究样本量较少,实验结果数据离散度较大所致,因此,在后续的研究过程中应进一步增加样本量以明确该实验结果的准确性。另外,虽然本研究明确了miR-4728-3p与高甘油三酯血症的相关性,进而通过文献对比提出了该miRNA可能通过MAPK/mTOR自噬信号通路影响脂肪细胞因子的释放,然而,其具体调控机制仍不清楚。因此,我们希望能够通过进一步深入的研究验证并明确其作用靶点,为糖脂代谢紊乱相关疾病带来全新的治疗思路和方法。



