钟 翔,向晓曦
(恩施州中心医院1.病理科;2.普外科,湖北 恩施 445000)
结肠癌是我国癌症相关死亡的主要原因之一[1]。目前临床上免疫法粪便隐血检测和纤维乙状结肠镜检查作为主要的筛查手段,已经明显降低了结肠癌的死亡率,然而这些技术都有其固定的局限性[2],开发结肠癌特异性标志物,则有助于提高患者的早期诊断率。许多恶性肿瘤组织中都存在miRNAs表达或功能异常,这与其表观遗传学改变有关,而检测粪便样本中miRNAs内源性表达和甲基化状态有望成为癌症早期诊断和预后评估最具潜力的、无创性的生物学检测手段[3]。miR-21和miR-34a都是靶向肿瘤坏死因子α(Tumor necrosis factor α,TNF-α)相关炎症通路的重要介质[4],而且众多研究证实miRNAs表达和甲基化调节具有一定的组织依赖性[5]。因此本研究拟分析粪便和癌组织中miR-21和miR-34a表达及甲基化检测对于结肠癌诊断的临床价值。
1 资料与方法
1.1 一般资料 从2019年3月至2020年1月在我院行结肠癌原发灶肿瘤切除(部分患者同时行肝转移灶切除)82例结肠癌患者中,收集了肿瘤组织标本和癌旁(距离癌变组织边界大于5 cm)结肠黏膜组织样本。同时在手术前使用15mL的收集管取得粪便样本。将手术前接受化疗、放疗、免疫治疗等患者,复发患者或合并任何其他恶性肿瘤的患者排除在本研究之外。所有病例术后病理证实为原发性结肠癌,采取美国癌症联合委员会或国际联合抗癌委员会(UICC/AJCC)的结肠癌(第7版)TNM分期系统进行结肠癌病理分期[6]。对照组粪便样本来自40例结肠良性肿瘤患者,经体格检查和实验室检查排除合并任何恶性肿瘤者。包括结肠息肉12例,结肠腺瘤20例,直肠息肉5例,直肠腺瘤3例。结肠癌组(n=82例),男性51例,女性31例,平均年龄(59.87±10.67)岁,平均体重指数(23.58±4.12)kg/m2,吸烟史20.73%(17/82),家族肿瘤史6.10%(5/82);TNM I~II期44例,III~IV期38例,9例发生肝转移。对照组(n=40),男性22例,女性18例,平均年龄(58.55±12.73)岁,平均体重指数(23.90±3.75)kg/m2,吸烟史15.0%(6/40),家族肿瘤史5.0%(2/40)。结肠癌患者和正常对照组在性别、年龄、体重指数、吸烟史、家族肿瘤史等方面,差异无统计学意义(P>0.05),从而排除潜在影响DNA甲基化水平的一些客观因素。本研究是根据我院医学伦理委员会批准的方案进行的。在详细解释了目的和具体程序之后,所有参与者签署了书面知情同意书。
1.2 方法
1.2.1 实时荧光定量PCR法检测miR-21/miR-34a基因表达情况 采用Trizol试剂盒(美国Sigma-Aldrich公司)和粪便RNA提取试剂盒(美国Omega Bio-Tek公司)分别提取组织样本和粪便样本中的总RNA。采用NanoDrop 2000C超微量分光光度计检测RNA质量,只采用A260/280 nm1.8~2.0的RNA片段用于逆转录。以5μg/L的RNA为模板,采用通用cDNA合成试剂盒(美国Qiagen公司)合成cDNA。利用Roche LC480系统检测miR-21/miR-34a的表达。根据Primer Finder数据库(www.applied-science.roche.com)设计了miR-21、miR-34a的PCR引物序列,并委托上海生工生物工程公司合成。PCR反应体系包含2μL特异性引物、8μL DNA模板、10μL LC480 SYBR Green I Master mix,总体积为20μL。PCR反应混合液在95℃预变性5min,然后经过45个三步扩增周期(95℃5s,50℃15 s,72℃5s)。所有样本平行进行3次,取平均值。以5srRNA和U6snRNA作为内源参考,对数据进行归一化处理。采用2-ΔΔCT法比较相对miRNA表达水平。miR-21引物序列为(正向)5’-GCG GTA GCT TAT CAG ACT GA-3’,(反向)5’-TGC GTG TCG TGG AGT C-3’。miR-34a引物序列为(正向)5’-GCG GTA GCT TAT CAG ACT GA-3’,(反向)5’-TGC GTG TCG TGG AGT C-3’。 U6引物序列为(正向)5’-CTC GCT TCG GCA GCA CA-3’,(反向)5’-AAC GCT TCA CGA ATT TGC GT-3’。qRT-PCR反应特异性由熔解曲线判断,若呈单峰则特异。在分析miRNAs表达与病理分期的关系时,将中位数设为临界值(临界值高值和下限值均为50%),95%置信区间。
1.2.2 甲基化特异性PCR(MSP)法分析miR-21/miR-34a基因启动子甲基化状态 用液氮砂浆将组织标本(20 ± 1 mg)快速研磨成粉末。粪便样品(200~220 mg)称重后,置于2 mL微量离心管中离心,然后加入1.6 mL缓冲液。所有的操作步骤都在冰浴中完成。分别用Universal Genomic DNA Extraction Kit Ver.3.0(大连宝生公司)和QIAamp DNA Stool Mini Kit(美国Qiagen公司)提取组织和粪便基因组DNA。用紫外分光光度法测定DNA的浓度,同样采用A260/280 nm1.8~2.0的DNA片段用于逆转录。使用EpiTect Fast DNA Bisulfite Kit试剂盒(美国Qiagen公司)对1.5~2.0μL DNA样本进行亚硫酸盐修饰。将修饰后的DNA稀释成15 μL保存。合成MSP引物,配制25 μL PCR扩增反应体系,PCR反应混合液在95℃预变性5 min,然后经过45个三步扩增周期(95℃5 s,50℃ 15 s,72℃ 5 s),最后的延伸步骤在72℃下进行5 min。将PCR产物经2%琼脂糖凝胶分离,凝胶成像分析系统显示清晰的特征DNA条带。miR-21甲基化引物序列为(正向)5’-ATT CGT TTC GTT TCG CGT TCG TTT C-3’,(反向)5’-CTA AAA CTA ACT CTC TCG ACC CCG-3’。miR-21非甲基化引物序列为(正向)5’-TTT TTA TTT GTT TTG TTT TGT GTT TGT TTT G-3’,(反向)5’-CCT AAA ACT AAC TCT CTC AAC CCC A-3’。miR-34a甲基化引物序列为(正向)5’-GGT TTT GGG TAG GCC GTT TC-3’,(反向)5’-TCC TCA TCC CCT TCA CCG CCG-3’。miR-34a非甲基化引物序列为(正向)5’-NNG GTT TTG GGT AGG TGT GTT TT-3’,(反向)5’-AAT CCT CAT CCC CTT CAC ACC A-3’。对PCR产物进行电泳,若甲基化特异性引物扩增出目的条带,而非甲基化特异性引物未扩增出条带则为甲基化;若非甲基化特异性引物扩增出目的条带,而甲基化引物未扩增出条带,则为非甲基化;若甲基化或非甲基化引物都能扩增出目的条带,则判断为部分甲基化。
1.2.3 血清学指标检查 采集粪便样本同时留取血液样本,2 000 r/min离心10 min取上清,-80℃保存直至分析。采用酶联免疫吸附法检测血清肿瘤坏死因子α(Tumor necrosis factor α,TNF-α)、白细胞介素-6(Interluekin-6,IL-6)水平。试剂盒购自美国Genzyme公司。
1.2.4 粪便隐血检测 以粪便隐血胶体金检测试纸法检测所有参与者的粪便样本。若试纸出现蓝绿色则为阳性。

2 结果
2.1 结肠癌患者肿瘤组织和癌旁组织中miR-21、miR-34a表达和甲基化状态 与癌旁组织相比,结肠癌组织中miR-21相对表达量升高,同时miR-34a相对表达量降低,差异有统计学意义(P<0.05)。而经qMSP法检测,结肠癌组织中miR-21启动子甲基化率(6例完全甲基化和19例部分甲基化)较癌旁组织降低,同时miR-34a启动子甲基化率(26例完全甲基化和32例部分甲基化)较癌旁组织升高,差异有统计学意义(P<0.05,见表1和图1)。

表1 结肠癌患者肿瘤组织和癌旁组织中miR-21、miR-34a表达和甲基化状态(n=82)
2.2 两组粪便中miR-21、miR-34a表达和甲基化状态 与对照组相比,结肠癌患者粪便中miR-21相对表达量升高,同时miR-34a相对表达量降低,差异有统计学意义(P<0.05)。而经qMSP法检测,结肠癌患者粪便中miR-21启动子甲基化率(3例完全甲基化和14例部分甲基化)较对照组降低,同时miR-34a启动子甲基化率(33例完全甲基化和40例部分甲基化)较对照组升高,差异有统计学意义(P<0.05,见表2和图2)。

表2 结肠癌患者和对照组人群粪便中miR-21、miR-34a表达和甲基化状态
2.3 结肠癌患者肿瘤组织和粪便中miR-21、miR-34a表达和甲基化状态的关系 经Pearson相关分析,miR-21、miR-34a在结肠癌患者肿瘤组织和粪便中的表达量呈正相关性(r=0.782,0.618,P<0.001)。此外,根据Fisher’s精确概率法检验结果,P<0.001,提示肿瘤组织和粪便中miR-21、miR-34a甲基化状态不一致;而根据Kappa一致性检验结果,Kappa>0.4,P<0.001,提示肿瘤组织和粪便中miR-21、miR-34a甲基化结果存在一致性,但是Kappa在0.4~0.75范围内,一致性一般(见表3、4和图1)。

表3 结肠癌患者肿瘤组织和粪便中miR-21甲基化状态的一致性

表4 结肠癌患者肿瘤组织和粪便中miR-34a甲基化状态的一致性

图1 结肠癌患者肿瘤组织和粪便中miR-21、miR-34a表达的Pearson相关性
2.4 粪便中miR-21、miR-34a甲基化检测联合粪便隐血试验对结肠癌的诊断价值 结肠癌的诊断以术后病理检查作为金标准。粪便miR-21、miR-34a甲基化检测分别联合粪便隐血均能够提高粪便隐血单独用于结肠癌诊断的敏感性、特异性和检出率,差异有统计学意义(P<0.05,见表5)。

表5 粪便中miR-21、miR-34a甲基化检测对结肠癌的诊断价值
2.5 结肠癌患者粪便中miR-21、miR-34a甲基化与临床病理特征的关系 结肠癌患者粪便miR-21非甲基化和miR-34a甲基化状态与肿瘤直径有关,经χ2检验,差异有统计学意义(P<0.05)。但是与其他临床病理特征,包括年龄、性别、吸烟史、病灶部位、淋巴结转移、分化程度、TNM分期、肝转移无关(P>0.05,见表6)。

表6 结肠癌患者粪便中miR-21、miR-34a甲基化检测与临床病理特征的关系(例,%)
2.6 结肠癌患者粪便中miR-21、miR-34a甲基化状态与血清TNF-α、IL-6水平的关系 结肠癌患者粪便miR-21非甲基化组血清TNF-α、IL-6水平较甲基化组水平升高,同时粪便miR-34a甲基化组血清TNF-α、IL-6水平较非甲基化组水平亦升高,差异有统计学意义(P<0.05,见表7)。
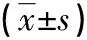
表7 结肠癌患者粪便中miR-21、miR-34a甲基化状态与血清TNF-α、IL-6水平的关系
3 讨论
本研究利用人粪便标本,证实结肠癌患者粪便miR-21呈低甲基化,同时miR-34a则呈高甲基化,联合检测粪便miR-21或miR-34a甲基化状态可以提高粪便隐血用于结肠癌诊断的敏感性、特异性和检出率,因此可作为常规筛查手段的辅助工具,以提高早期结肠癌的筛查或诊断率。此外粪便miR-21和miR-34a甲基化状态发生变化可能与下游TNF-α炎症信号通路的激活也有一定的关系,进而促进肠黏膜上皮细胞癌变的进展。
在我国,结肠癌患者5年生存率极低,这可能与早期筛查手段有限有关[7]。因此迫切需要新的健全和可靠的诊断方法来改进现有的筛查策略,以提高结肠癌的早期诊断率,进而改善患者预后。目前大多数针对结肠癌筛查或诊断的非侵入性分子检测都是基于粪便和/或血液的分析。例如免疫学粪便隐血检测(Fecal occult blood testing,FOBT)就是最常用的检测方法。然而,FOBT检测也有一些局限性,例如对于结肠癌和结肠腺瘤的鉴别诊断敏感性较低。另一种鉴别结直肠和其他良性肿瘤的有前途的方法是检测粪便中代表癌症相关基因和/或表观遗传变异谱的分子生物标志物。肿瘤组织中的肿瘤细胞不断脱落,进入粪便,这为发现癌症相关基因“特征”提供了基础[8]。在本研究中,结肠癌miR-21表达量普遍升高,同时miR-34a表达量则降低,这与其基因启动子发生去甲基化或者超甲基化有关;且这两项因子在粪便组织和癌组织中的表达变化和甲基化状态基本一致,说明粪便DNA检测能够敏感地反应肿瘤组织中的DNA分子变化。虽然众多研究也已证实粪便DNA甲基化检测的可行性,但是由于临床医学数据有限,目前粪便DNA检测暂时只能作为研究或试验用,距临床应用尚需要大量的工作支持[9]。但是本研究结果也为筛选粪便中的生物标志分子提供了可靠的数据支持。
众多研究表明,miR-21的表达增加与结肠癌[9]等多种恶性肿瘤密切相关,对肿瘤细胞的增殖和凋亡具有促进作用。例如You等[10]学者发现,上调miR-21表达后,可以促进结肠癌细胞系SW480的增殖,而且miR-21在结肠癌组织中呈高表达,与患者的恶性化程度呈正相关性,但与生存率呈负相关性。说明miR-21可能参与结肠癌细胞增殖的调控。此外Hulf等[11]学者证实,在前列腺癌细胞系中,miR-21启动子高甲基化导致其表达被抑制;而经去甲基化药物5-氮杂-2′-脱氧胞苷(5-Aza-CdR)处理后,可导致miR-21表达上调。Ortiz等[12]学者采用Illumina的450K甲基化芯片分析、TCGA数据库筛查、数据验证(焦磷酸测序和qRT-PCR)和功能分析等方法,证实miR-21和miR-146b 可能受到去甲基化的调节,导致miR-21和miR-146b表达模式发生改变;并且通过细胞实验也证实在TPC1细胞系中检测到由于甲基化丢失导致miR-21表达增加。因此作者推断检测miR-21基因的甲基化和表达水平对恶性病变和良性病变的鉴别具有潜在的临床价值。为了证实上述推断,我们首先检测了结肠癌组织标本中miR-21的表达情况和甲基化状态,证实miR-21在结肠癌组织中呈高表达,同时伴有甲基化丢失,说明miR-21表达增加是由于DNA甲基化缺失引起的转录机制和生物学途径的中断。而且粪便组织中miR-21表达水平直接反映了结肠癌组织的状态,但是甲基化状态与肿瘤组织中存在一定的差异,这可能与样本量偏少有关。同样miR-34a在结肠癌组织和患者的粪便样本中也出现表观遗传学改变。miR-34a在结肠癌组织中表现出频繁的表观沉默,而在邻近的正常肠黏膜组织中则没有表现,这可能是导致miR-34a表达量下调的主要原因,这与很多其他类型的癌症研究结论基本一致[13-14],如miR-34a高甲基化可抑制多种肿瘤细胞的增殖、迁移以及侵袭能力。
此外,我们还分析了粪便miR-21、miR-34a的甲基化状态与结肠癌患者临床病理特征之间的关系,由于纳入的样本量有限,我们进证实粪便miR-21、miR-34a甲基化状态与肿瘤直径有关。这也可以分子机制角度解释,例如miR-34a表达下降与c-Met、Snail和β-catenin蛋白水平上调有关,而这些转录因子表达上调是促进结肠癌细胞转移的重要原因[15]。除此以外,我们还发现,粪便miR-21、miR-34a甲基化状态与血清炎症因子TNF-α、IL-6水平升高有关。炎症是结肠癌发生和进展的重要机制。一些炎症细胞因子在癌症组织中被上调,包括TNF-α、IL-6等,进而导致坏死和炎症,并促进癌症的发生。而miR-21、miR-34a和TNF-α旁分泌/自分泌之间的关系早已被多项研究证实[16-19]。但是根据miRDB数据库发现,人们认为TNF-α并非miR-21或miR-34a的直接靶标,因此miR-21、miR-34a对TNF-α蛋白表达的调节作用可能是通过间接途径发生的,但具体的调控网络尚需进一步完善。
综上所述,结肠癌患者粪便和癌组织中miR-21呈低甲基化,同时miR-34a呈高甲基化,联合检测粪便中miR-21或miR-34a甲基化状态都能够提高粪便隐血对结肠癌的临床诊断效能。但是是否具有临床推广价值尚需要扩大样本量进一步证实该结论的可靠性。



