蒙祖迪,张焱皓,亓 凯,卫麟娜,高雪涵,罗军敏
(遵义医科大学 免疫学教研室,贵州 遵义 563099)
结核病是一种慢性呼吸道传染性疾病,由主要寄生在巨噬细胞中的结核分枝杆菌(mycobacterium tuberculosis,MTB)引起[1]。当MTB侵入机体后,巨噬细胞可对其进行识别、吞噬、杀伤。MTB通过刺激巨噬细胞产生大量的炎性细胞因子和趋化因子[2]募集适合自身寄居的免疫细胞,促使其逃避宿主的杀伤清除。然而,其也可通过抑制巨噬细胞凋亡、自噬体形成以及吞噬溶酶体融合等多种机制来逃避巨噬细胞的免疫清除[3]。热休克蛋白16.3(heat shock protein 16.3,Hsp 16.3)是在休眠期大量表达且存在于MTB膜上的小分子热休克蛋白质,通过干扰巨噬细胞自噬体形成[4]、凋亡[5]和促进巨噬细胞 M2 型极化[6]使MTB发生免疫逃逸。因MTB在躲避宿主免疫杀伤中的功能特性,猜想其可能在潜伏感染阶段对巨噬细胞趋化功能产生影响从而有利于自身寄居在巨噬细胞内。因此,本研究采用H37Ra野生型菌株(WT)、H37Ra热休克蛋白16.3回补菌株(COMP)、H37Ra热休克蛋白16.3敲除菌株(MUT)感染小鼠骨髓来源巨噬细胞,初步探讨结核分枝杆菌H37Ra热休克蛋白16.3敲除菌株对小鼠骨髓来源巨噬细胞炎性细胞因子表达及趋化功能的影响,旨在为深入探索MTB Hsp16.3 在潜伏感染中对巨噬细胞功能的影响打下实验基础。
1 材料与方法
1.1 材料 结核分枝杆菌H37Ra(H37Rv弱毒株)热休克蛋白16.3敲除菌株由本实验室构建保存;6~10周龄雌性BALB/c小鼠购买于重庆市第三军医大学医学实验动物中心并饲养于本实验室SPF级动物房;小鼠重组GM-CSF购于NOVUS公司;RNAisoTMPlus、PrimeScriptTMRT Reagent Kit 和 SYBR Premix Ex Taq Real-time PCR Kit 购于TAKARA 公司;TNF-α和IL-6 ELISA 试剂盒购于英捷潍基公司;引物购于上海生物工程有限公司;APC标记的抗小鼠 CD11b 抗体和FITC 标记的抗小鼠 F4/80 抗体购于eBioscience公司;APC 标记的抗小鼠 CCR1 抗体、PE 标记的抗小鼠 CCR2 抗体和 APC 标记的抗小鼠 CCR5 抗体购于 R&D 公司;兔抗小鼠iNOS抗体和和兔抗小鼠 GAPDH 抗体购于abcam公司;HRP 标记的山羊抗兔二抗购于 CST 公司。
1.2 方法
1.2.1 小鼠骨髓来源巨噬细胞的诱导和培养 将6~10 周龄雌性BALB/c 小鼠脱颈处死,无菌条件下提取小鼠胫、腓骨骨髓细胞,经裂红、洗涤、离心后加入含有终浓度为20 ng/mL GM-CSF和10% FBS的 DMEM 低糖培养基,调整细胞密度为 1×106个/mL并铺板,培养7 d后得到的贴壁细胞即为小鼠骨髓来源巨噬细胞。
1.2.2 吞噬率检测 将 WT、COMP 和 MUT以MOI=1∶10感染小鼠骨髓来源巨噬细胞3 h,经0.5% TritonX-100裂解后进行倍比稀释并铺板于 7H10 固体培养基培养 21 d,对菌落进行计数。吞噬率=巨噬细胞吞噬细菌数/原菌数。
1.2.3 体外潜伏感染模型的构建 将WT菌株以MOI=4、2、1感染培养于细胞爬片上的小鼠骨髓来源巨噬细胞,经洗涤、固定、封闭、孵一抗、孵二抗、染DAPI以及染MTB、封片等一系列操作后于荧光显微镜下镜检。
1.2.4 实时荧光定量 PCR(Real-time PCR)检测 采用TRIzol法抽提总RNA,并逆转录为cDNA,随后以cDNA为模板进行Real-time PCR实验。Real-time PCR实验数据用2-ΔΔCt法分析目的基因mRNA的相对表达水平,引物序列见表1。

表1 引物序列
1.2.5 ELISA检测培养上清中的细胞因子 收集培养好的细胞上清液,按照ELISA说明书检测TNF-α、IL-6的分泌,在450 nm处检测各微孔吸光度。
1.2.6 Western-blot 检测巨噬细胞蛋白表达 提取细胞蛋白,BCA法测定蛋白浓度,统一蛋白浓度后上样,通过电泳、转膜及封闭等步骤后,加入iNOS一抗,GAPDH内参抗体,4 ℃孵育过夜,加入HRP 标记的山羊抗兔二抗室温孵育2 h,最后加入发光液于Bio-Rad凝胶成像系统进行曝光,采用Image Pro Plus软件和Graph pad Prism进行图像分析。
1.2.7 流式细胞术鉴定巨噬细胞 收集培养好的巨噬细胞,加入F4/80、CCR1、CCR2以及CCR5流式抗体4 ℃孵育,PBS洗涤后用流式细胞仪进行检测。
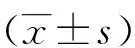
2 结果
2.1 小鼠骨髓来源巨噬细胞的诱导培养 收集培养成熟的小鼠骨髓细胞,采用流式细胞术鉴定巨噬细胞表面分子标志物,发现其 CD11b 和 F4/80 双阳性率高达 97.8 %,结果如图 1 所示,提示小鼠骨髓来源巨噬细胞诱导成功。
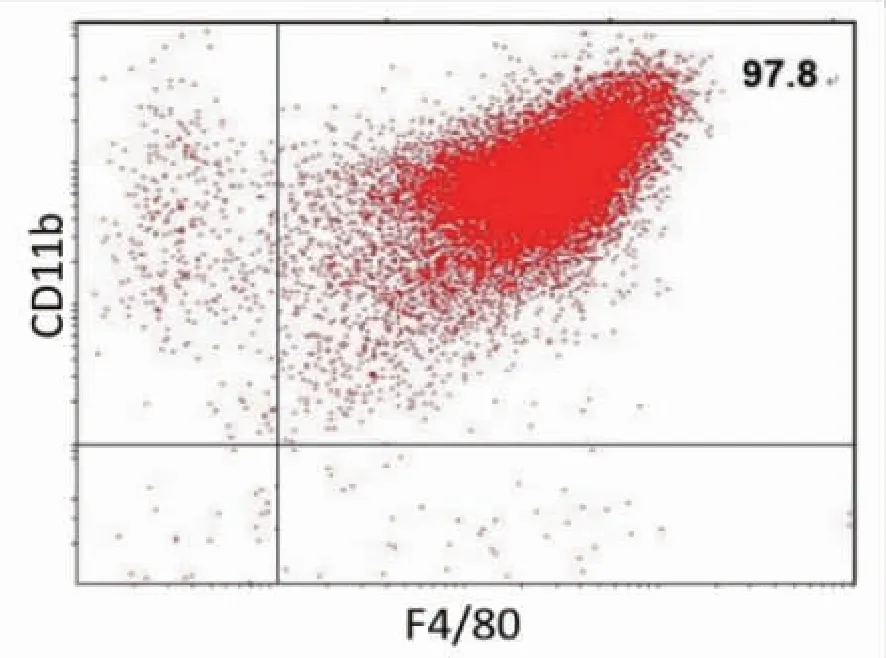
图1 小鼠骨髓来源巨噬细胞的鉴定
2.2 小鼠骨髓来源巨噬细胞对WT、COMP和 MUT菌株吞噬率的检测 由图2所示,在用WT、COMP和 MUT菌株分别感染小鼠骨髓来源巨噬细胞后,巨噬细胞对WT、COMP和 MUT菌株的吞噬率分别为 (66±5)%、(72±10)%、( 73±10)%,经统计学分析发现3组之间没有差异。
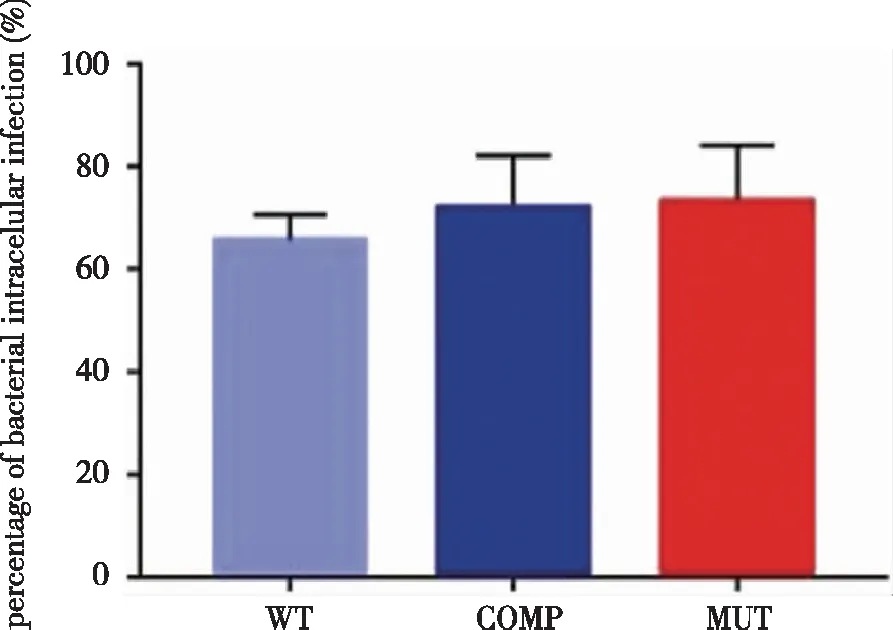
图2 小鼠骨髓来源巨噬细胞对WT、COMP和 MUT菌株的吞噬差异统计
2.3 小鼠骨髓来源巨噬细胞在不同 MOI 下受感染情况 图2结果显示小鼠骨髓来源巨噬细胞对WT、COMP 和 MUT菌株的吞噬率相同,因此,选用 WT 菌株进行体外潜伏感染模型的试验。如图 3 所示,分别用 WT 菌株以 MOI=4、2 和 1 感染小鼠骨髓来源巨噬细胞, 3 h后通过免疫荧光进行检测。结果显示,当 MOI=2 时,每个巨噬细胞含有 1~2 个结核分枝杆菌,且有 80 %的巨噬细胞受到感染,因此后续实验采用MOI=2构建巨噬细胞体外潜伏感染模型并进行相关实验。
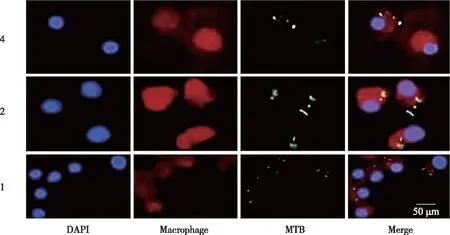
图3 WT菌株在不同 MOI下感染小鼠骨髓来源巨噬细胞的情况
2.4 WT、COMP和 MUT菌株对小鼠骨髓来源巨噬细胞炎性细胞因子 mRNA 相对表达水平的影响 在潜伏感染模型构建成功后继续培养24 h,经 Real-time PCR 检测发现 MUT 菌株感染组相较于WT 和 COMP 菌株感染组, TNF-α和 IL-6 的mRNA 相对表达水平更高(P<0.05),而在 48 h 时,各感染组间 TNF-α 和 IL-6 的mRNA 相对表达水平没有差异。在潜伏感染模型构建成功后继续培养24 h,经检测发现各感染组间iNOS的 mRNA 相对表达水平没有差异,而在48 h时,MUT 菌株感染组较 WT 和 COMP 菌株感染组iNOS的 mRNA 相对表达水平更低(P<0.05,图4)。
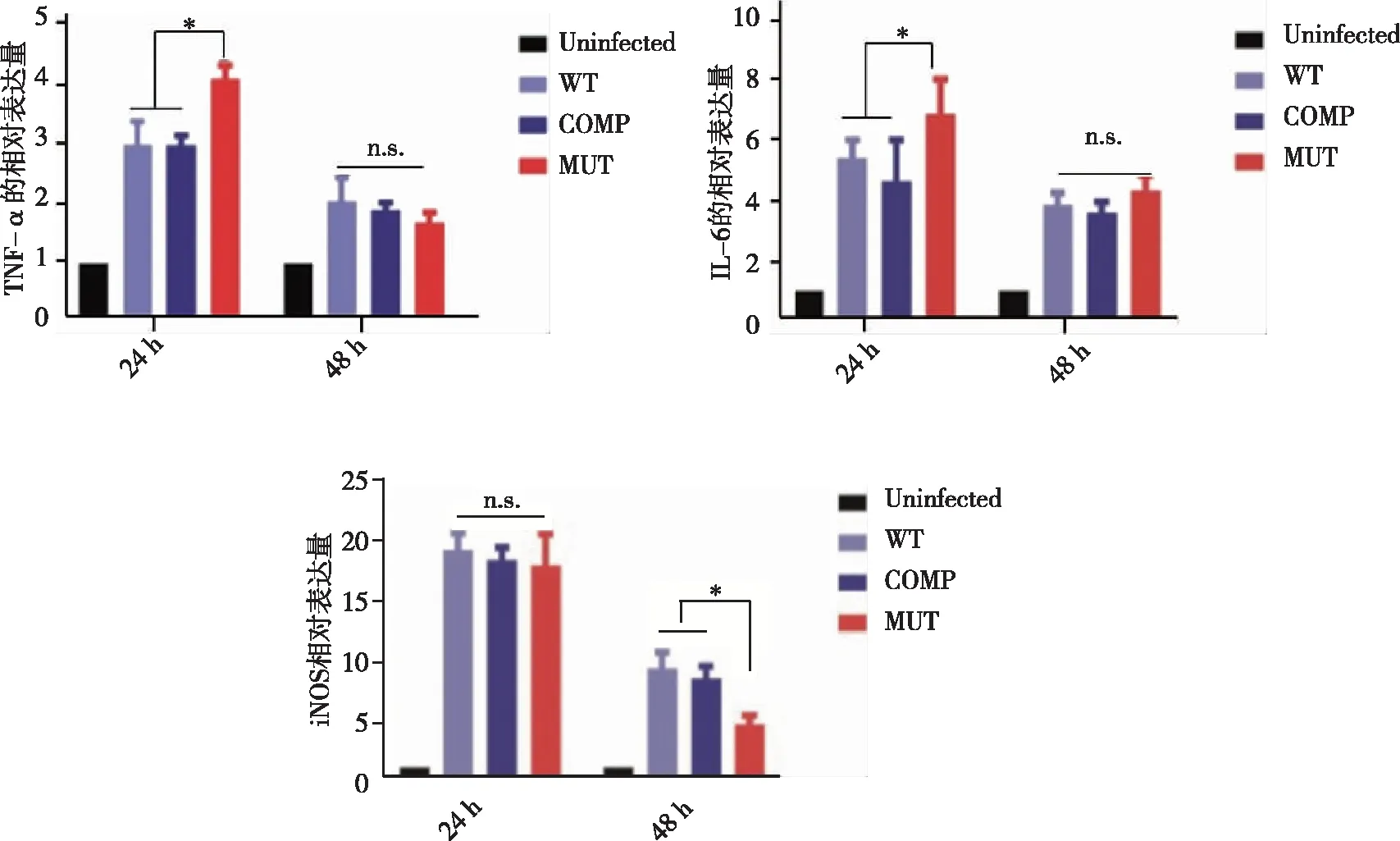
n.s.:无差异;*:MUT感染组与WT、COMP感染组比较,P<0.05。图4 各种菌株对小鼠骨髓来源巨噬细胞炎性细胞因子 mRNA相对表达水平的影响
2.5 WT、COMP和 MUT菌株对小鼠骨髓来源巨噬细胞炎性细胞因子表达的影响 结果如图 5 所示,在潜伏感染模型构建成功后继续培养 24、48 h时,通过ELISA检测发现各感染组上清液中巨噬细胞TNF-α和IL-6的分泌水平没有差异,Western-blot 检测出的iNOS的表达在各组间也没有明显差异。
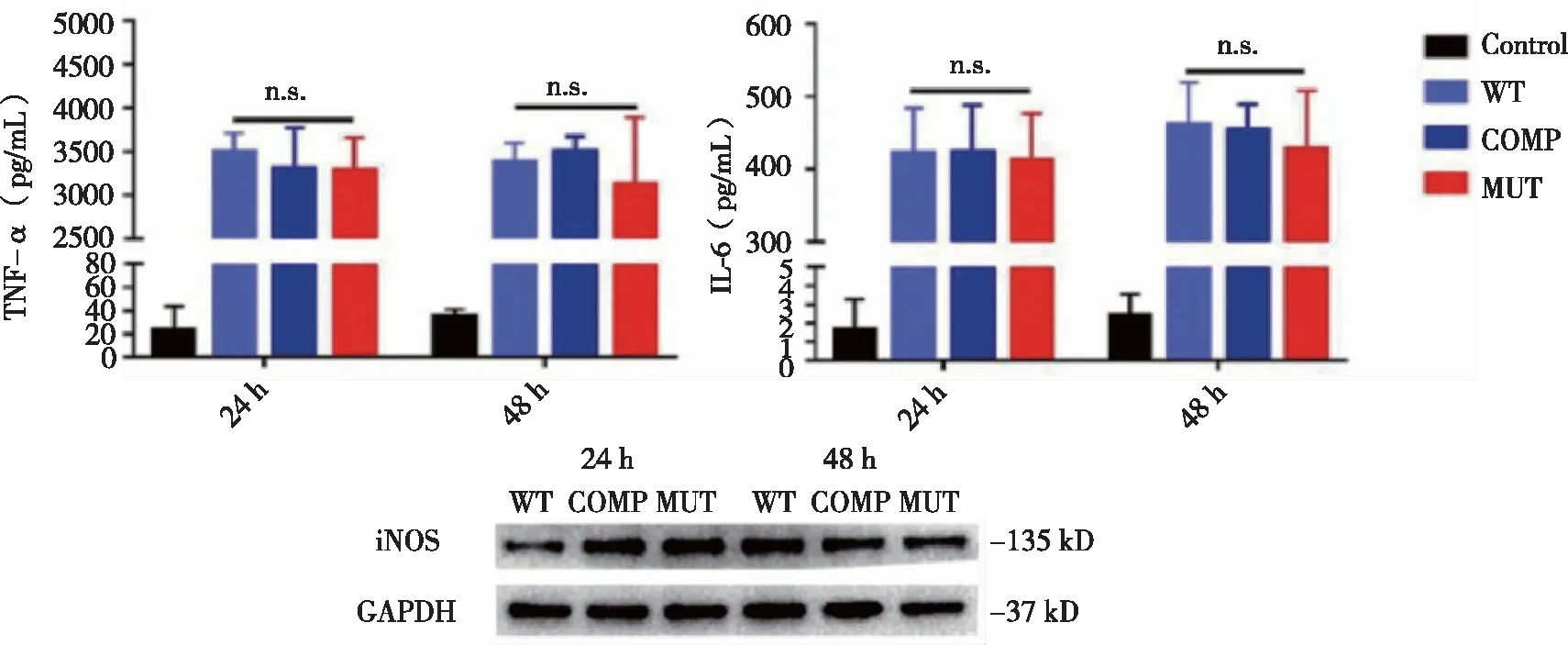
n.s.:无差异。图5 各种菌株对小鼠骨髓来源巨噬细胞炎性细胞因子表达的影响
2.6 WT、COMP和 MUT菌株对小鼠骨髓来源巨噬细胞趋化功能的影响
2.6.1 WT、COMP和 MUT菌株对巨噬细胞迁移功能的影响 如图6所示,通过Transwell实验检测发现,相较于 WT 菌株以及 COMP 菌株感染组,MUT 菌株感染组能够趋化数量更多的巨噬细胞至下室,差异具有统计学意义。
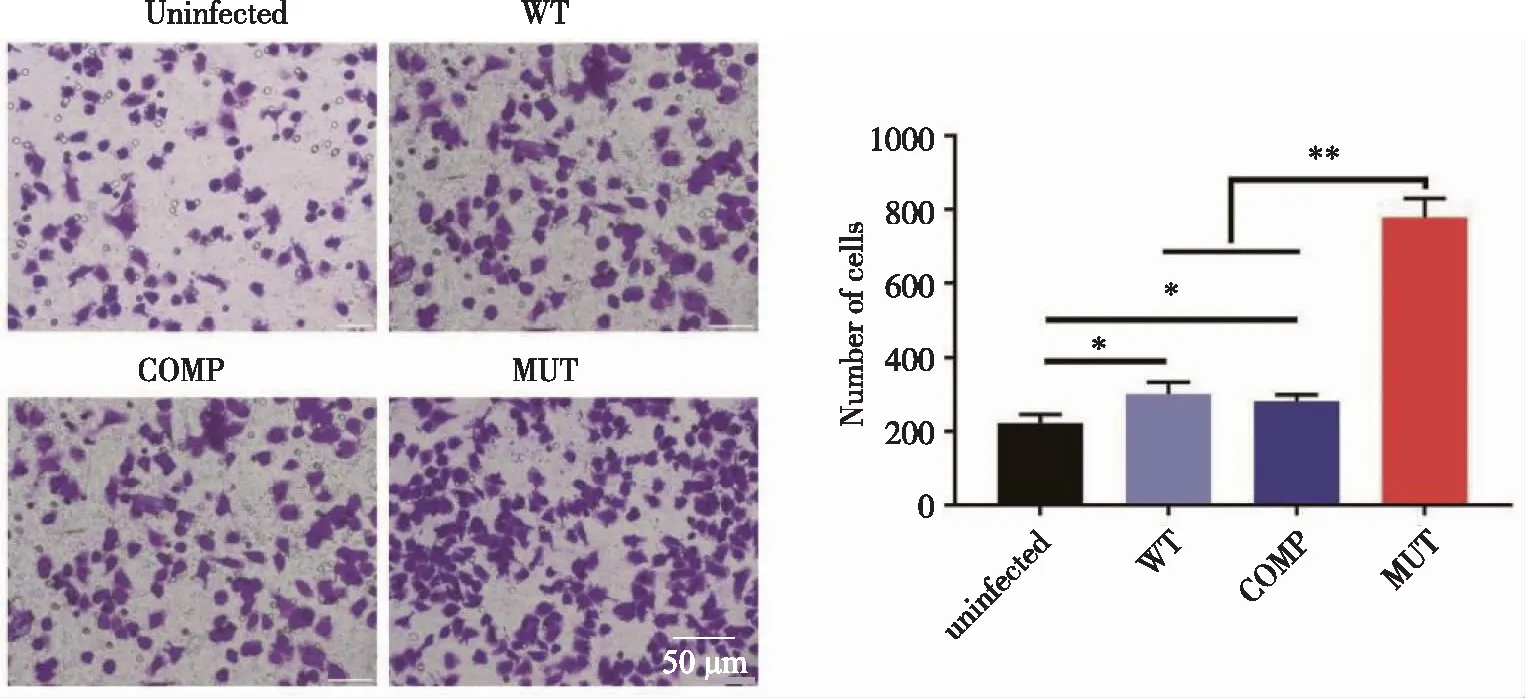
*、**:分别与未感染组比较,P<0.05,P<0.01。图6 Transwell实验检测巨噬细胞的迁移功能
2.6.2 WT、COMP和 MUT菌株对巨噬细胞趋化因子转录水平的影响 如图7所示,用3株菌株分别以 MOI=2 感染巨噬细胞 3 h 后通过 Real-time PCR 检测发现,相较于 WT 菌株以及 COMP 菌株感染组,MUT 菌株感染组 CCL2、CCL3、CCL4、CCL5 和 CCL12 的基因表达水平上调(P<0.05)。
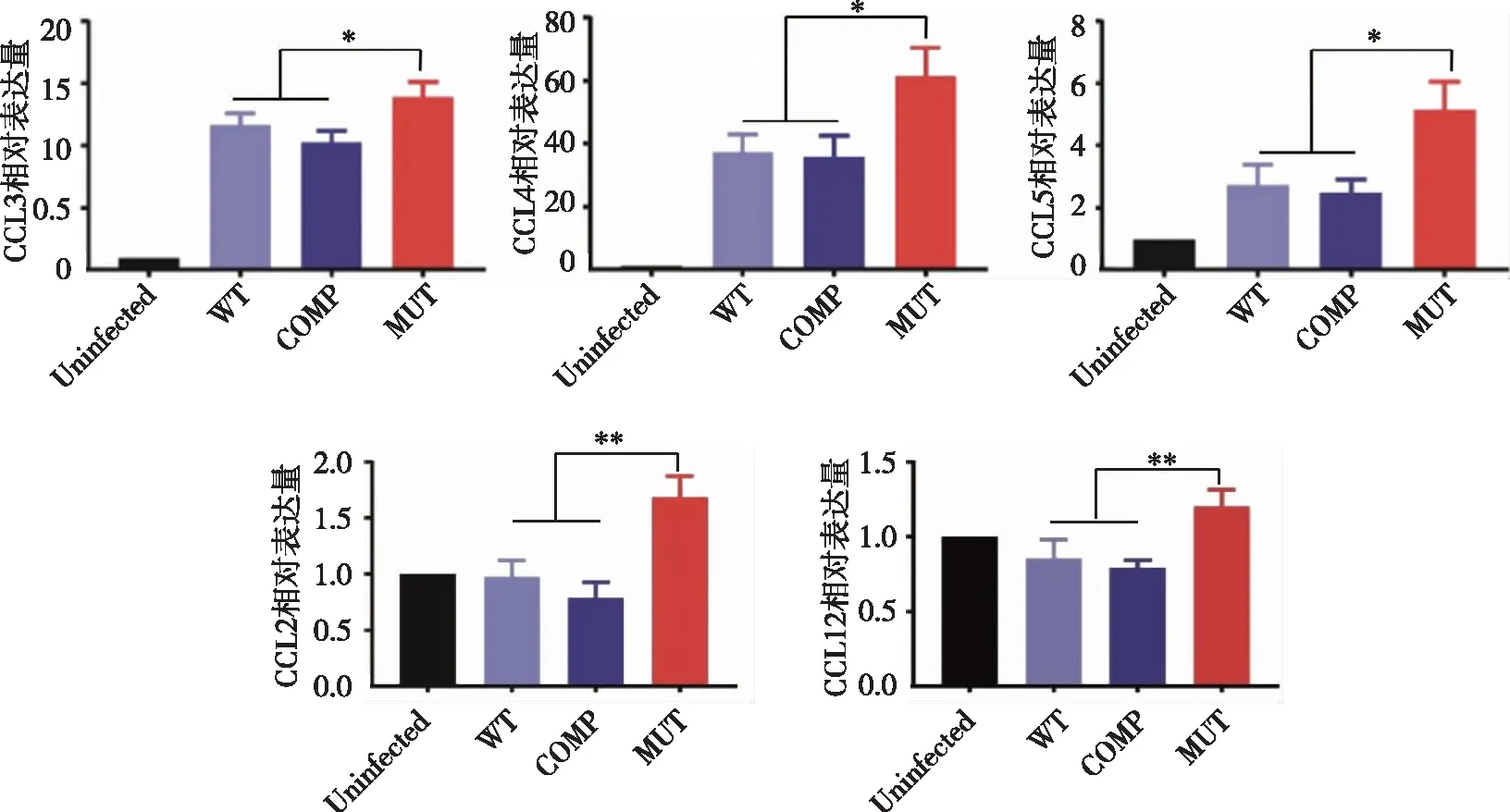
*、**:MUT感染组与WT、COMP感染组比较,P<0.05、P<0.01。图7 Real-time PCR 检测巨噬细胞趋化因子的相对表达水平
2.6.3 WT、COMP和 MUT菌株对巨噬细胞趋化因子受体表达的影响 潜伏感染模型构建成功后继续培养24 h,取培养上清液培养未处理的巨噬细胞,通过流式细胞术检测 F4/80+CCR1+(CCR1 为 CCL3、CCL4 和CCL5 的受体),F4/80+CCR2+(CCR2 为 CCL2 和 CCL12 的受体)和 F4/80+CCR5+(CCR5 为 CCL3、CCL4 和 CCL5 的受体)细胞数量,结果如图8所示,提示各感染组间F4/80+CCR1+的数量没有差异,MUT 菌株感染组 F4/80+CCR2+和 F4/80+CCR5+的数量相较于其他感染组明显上调(P<0.05)。
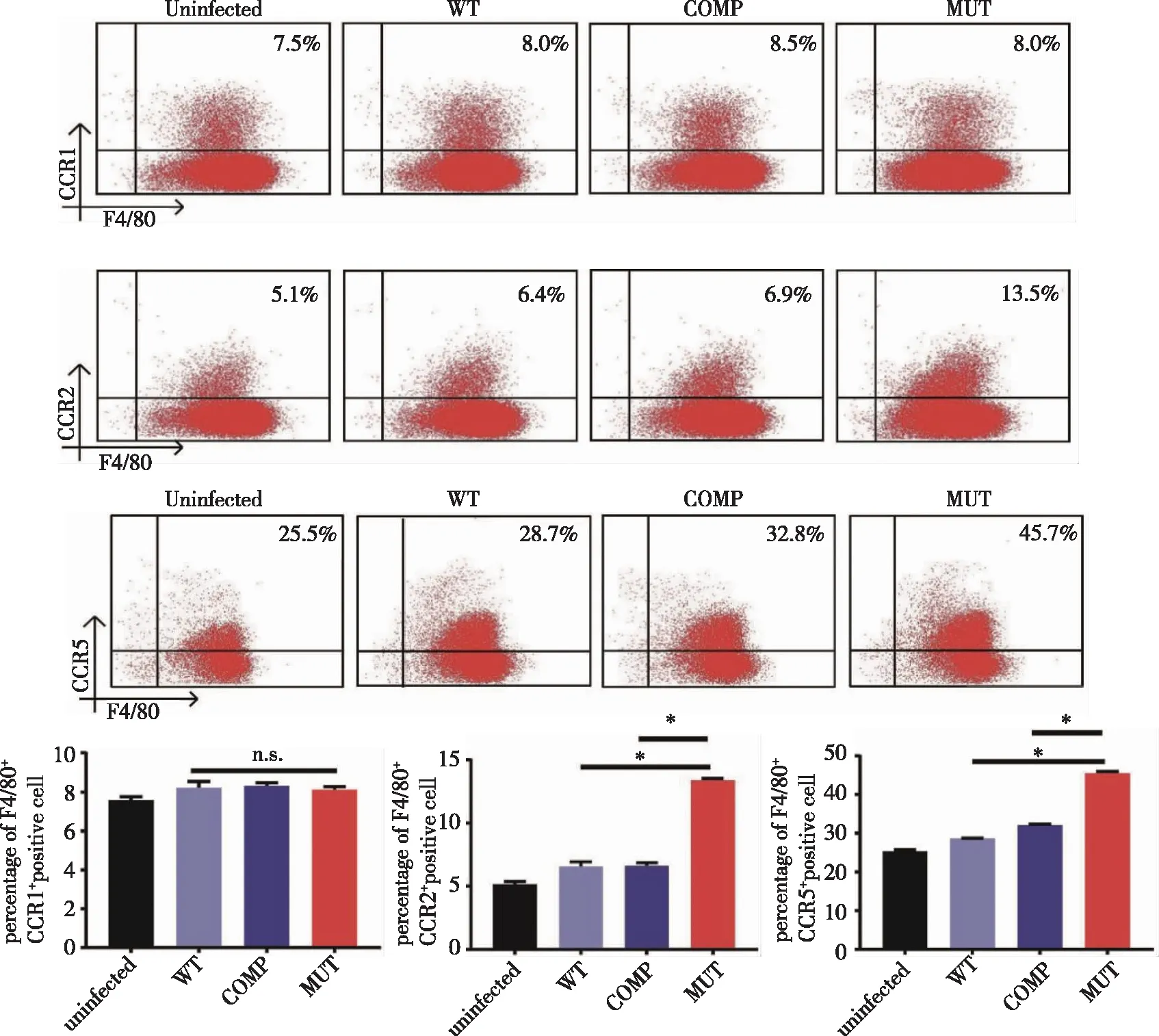
*:MUT感染组与WT、COMP感染组比较,P<0.05。图8 流式细胞术检测巨噬细胞趋化因子受体的表达
3 讨论
MTB潜伏感染阶段是其传播难以控制的原因,MTB 侵入机体后主要寄生在巨噬细胞内,在潜伏感染阶段抑制巨噬细胞的免疫杀伤功能是其能够在机体内存活的策略。MTBHsp16.3在潜伏感染阶段高表达且能帮助 MTB 抵御外界环境压力的特性提示MTB Hsp16.3 可能通过抑制巨噬细胞功能而存活于巨噬细胞中。因此本实验的核心部分就在于构建巨噬细胞体外潜伏感染模型。为了构建该模型,本文检测小鼠骨髓来源巨噬细胞对3种菌株的吞噬率,结果差异无统计学意义。因此任选某一菌株摸索潜伏感染的条件,预期目的是在较低感染量的情况下可以使绝大多数巨噬细胞感染MTB,且巨噬细胞能在培养板中长时间存活。本实验选用了 WT 菌株感染小鼠骨髓来源巨噬细胞,通过荧光显微镜观察感染情况发现当 MOI=2 时,80%以上的巨噬细胞都被WT菌株感染,且巨噬细胞生存时间较长,因此以此感染条件为构建 MTB 感染小鼠骨髓来源巨噬细胞的体外潜伏感染模型。
大量研究报道巨噬细胞分泌的炎性细胞因子在抗 MTB 感染中发挥着重要作用。研究发现结核病患者巨噬细胞产生的 IL-6 水平高于健康受试者[7],而IL-6的大量产生会抑制巨噬细胞内MTB的生长[8]。TNF-α 是宿主对抗结核病的关键耐药因子,在MTB感染后,TNF-α的表达可呈剂量依赖性的增加[9],且大量的TNF-α可促进线粒体活性氧ROS的产生和Cyclophilin D的参与启动信号级联信号从而触发巨噬细胞程序性的坏死[10]。大量研究表明,iNOS是巨噬细胞产生 NO 和控制 MTB 感染的关键酶,MTB分泌蛋白LprG可抑制LPS诱导的NO和iNOS的产生[11],而iNOS在细胞间表达活性的差异明显可以影响MTB在巨噬细胞内的生存速率[12]。在本研究中,MTB Hsp16.3只影响了巨噬细胞IL-6、TNF-α、iNOS基因水平的表达,而未能调控其蛋白释放的变化,其原因可能是菌体成分复杂且对小鼠骨髓来源巨噬细胞存在复杂的转录后调控网络。
当机体感染MTB后,免疫细胞试图立即遏制并杀死病原菌。但若被感染的巨噬细胞没有控制 MTB 感染的能力,无法完全消除结核分枝杆菌时,其会通过分泌趋化因子募集其他的免疫细胞到感染灶形成肉芽肿以控制感染[13]。为了探讨MTB Hsp16.3 是否对巨噬细胞的趋化功能产生影响而有利于自身潜伏感染,本研究设计了Transwell实验检测小鼠骨髓来源巨噬细胞的趋化功能。结果提示,Hsp16.3 对巨噬细胞的迁移产生了抑制作用。趋化因子受体及其配体形成的信号网络对免疫细胞在 MTB 感染部位的定位至关重要。感染MTB的早期,巨噬细胞在气道积聚并表达CCR2,随着疾病的进展,巨噬细胞离开气道并定位于肉芽肿内,且缺乏CCR2的巨噬细胞对MTB的易感性增加[14]。CCL2 被证明为MTB感染的易感因素[15]。这表明了CCR2 及其配体在机体 MTB 感染中具有机体保护性作用。此外,CCR5 及其配体也是在结核感染中将巨噬细胞等固有免疫细胞募集到肺部的关键因素,与结核病的易感性及疾病进展有关[16]。CCR5 主要在巨噬细胞、T淋巴细胞和树突状细胞上表达并受到 CCL3(巨噬细胞炎性蛋白-1α)、CCL4(巨噬细胞炎性蛋白-1β)和 CCL5(调节活化正常 T 细胞表达和分泌因子)的调控[17]。在 MTB感染的小鼠模型中3种 CCR5 配体在肺中均被上调,其中 CCL5 被诱导至最高水平[18]。另外有研究发现CCR5缺乏的小鼠感染MTB后其存活率增加并且控制了MTB在体内的生存[19]。以上研究表明了 CCR5 在结核肉芽肿的形成中有着不可忽视的作用。为了明确MTBHsp16.3是否通过CCR2和CCR5受体信号途径影响巨噬细胞趋化功能,本研究进行了初步的检测,结果提示 MUT 菌株感染组较其他组 F4/80+CCR2+细胞比例数量有明显上调且CCL2 和 CCL12 mRNA的相对表达水平较其他组上调了约 1.5 倍,这说明MTB Hsp16.3 可能通过抑制 CCR2 信号轴相关分子的表达影响巨噬细胞的趋化。MUT 菌株F4/80+CCR5+细胞比例为45.7%,高于WT、COMP组,这表明Hsp16.3明显抑制了 CCR5 的表达;MUT组 CCR5配体 CCL3、CCL4 和 CCL5 的基因表达较 WT 、COMP组明显上调,可能提示CCR5相关信号轴在MTB Hsp16.3调控巨噬细胞中发挥着作用。目前的研究报道 CCR1 也为 CCL3、CCL4 和 CCL5 的受体,但未见文献报道 CCR1 与 MTB 感染后巨噬细胞趋化功能的联系。本研究也检测了 F4/80+CCR1+的细胞数量,发现 Hsp16.3 对其表达没有影响。以上结果说明MTB Hsp16.3 可能通过CCL3、CCL4、CCL5/CCR5和CCL2、CCL12/CCR2抑制巨噬细胞的趋化功能。本研究在体外细胞水平初步探讨了MTB Hsp16.3对巨噬细胞趋化功能的影响,包括MTB Hsp16.3是通过胞吞胞吐作用还是通过与巨噬细胞表面的模式识别受体结合进入到细胞内,在细胞内的亚细胞定位又在哪?与哪个靶标分子相互作用才介导了巨噬细胞的趋化功能的抑制仍需要更进一步的探索。本探究初步阐明MTB Hsp16.3对巨噬细胞炎性细胞因子表达以及趋化功能的影响,旨在为深入探索MTB Hsp16.3 在潜伏感染中对巨噬细胞功能的影响打下实验基础。



