马竹君 冯红超 宋宇峰 高琼 孙昊轩
(1.贵州医科大学,贵州 贵阳 550004;2.贵阳市口腔医院,贵州 贵阳 550001;3.贵州省食品药品监督管理局,贵州 贵阳 550004;4.贵州医科大学附属口腔医院颌面外科,贵州 贵阳 550004;5.河北省眼科医院口腔颌面外科,河北 邢台 054001)
GSK-3β、E-cadherin、Cytokeratin在口腔鳞状细胞癌中的表达及意义
马竹君1冯红超2△宋宇峰3高琼4孙昊轩5
(1.贵州医科大学,贵州 贵阳 550004;2.贵阳市口腔医院,贵州 贵阳 550001;3.贵州省食品药品监督管理局,贵州 贵阳 550004;4.贵州医科大学附属口腔医院颌面外科,贵州 贵阳 550004;5.河北省眼科医院口腔颌面外科,河北 邢台 054001)
目的 本实验通过观察已确诊的口腔鳞状细胞癌组织中上皮间质化(EMT)相关蛋白及糖原合成酶激酶-3β(GSK-3β)的表达,初步探讨其在人口腔鳞状细胞癌中的临床意义,并研究其在口腔鳞癌及正常上皮组织中上皮间质化中的作用,为口腔鳞状细胞癌的预防、控制和治疗提供一定参考。方法 通过免疫组织化学的方法检测32例口腔鳞癌组织中上皮源性标记物:上皮-钙黏蛋白(E-cad)及细胞角蛋白(CK)、GSK-3β的表达情况,并与临床病理资料作对照分析。结果 在口腔鳞癌组中,GSK-3β、CK及E-cad的表达明显低于正常组织组(P<0.05);T4+T3组中,E-cad、GSK-3β的表达明显低于T1+T2组(P<0.05);在有淋巴结转移组中,E-cad、CK及GSK-3β的表达低于无淋巴结转移组(P<0.05),E-cad与GSK-3β表达呈正相关(r=0.572,P=0.001)。结论 口腔鳞癌组织中存在上皮间质化现象,E-cad、CK表达减少,GSK-3β在OSCC与正常上皮组织表达中存在差异,GSK-3β的减少可促进OSCC细胞发生EMT,使口腔鳞癌侵袭及转移,联合上述3个因子,可能为预测OSCC的转移及针对OSCC转移的治疗研究提供一定帮助。
口腔鳞癌; 糖原合成酶激酶-3β; 细胞角蛋白; 上皮-钙黏蛋白; 上皮间质化; 淋巴结转移
口腔鳞状细胞癌(OSCC)是口腔颌面部最常见的上皮来源的恶性肿瘤,约占口腔颌面部肿瘤的80%,具有恶性程度高,易向周围侵袭,淋巴结易转移,预后差等特点,发病率逐年上升。侵袭和转移是恶性肿瘤的生物学特性之一[1],其中OSCC的颈部淋巴结转移是目前临床上肿瘤致死的主要因素,严重威胁人类的生命及健康。上皮细胞间质转化(EMT)是指上皮细胞失去上皮表型转化为间质细胞表型的过程,是一个繁杂有序的、多基因的、可调控的生物学过程,在发育、组织愈合及器官纤维化等过程中起关键作用。其特点是上皮细胞标记物如上皮-钙黏蛋白(E-cad)、细胞角蛋白(CK)的丢失与间质细胞标记物的获得[2]。随着研究深入,有研究[3-4]发现,在发生了转移的胸腺导管癌、结直肠癌、前列腺癌等恶性肿瘤中,存在EMT现象,与多条信号通路相关[5],EMT与肿瘤的迁移及侵袭逐渐成为近年来研究热点。
有研究表明,糖原合成酶激酶-3β(GSK-3β)与食道癌、喉癌等许多恶性肿瘤密切相关,而对于GSK-3β及其相关信号通路与OSCC的临床关系及其与OSCC中EMT的关系的相关研究较少。为了阐明GSK-3β与OSCC的临床关系与OSCC中是否存在EMT而导致其易转移的恶性生物学行为及其机制,我们通过免疫组化(PV二步法)的方法对32例口腔鳞癌标本中GSK-3β的表达进行了检测,同时以免疫组化的方法对EMT标记蛋白:E-cad、CK进行了检测分析,为了解口腔鳞癌转移的发展机制提供一定理论基础。
1 资料与方法
1.1 材料
1.1.1 标本选择 收集贵州医科大学附属医院口腔颌面外科2009-2015年手术切除的,术前未采用任何针对肿瘤的治疗,如放疗、化疗等,经组织蜡块保存完好的口腔鳞癌标本。均经常规病理检查确诊为鳞状细胞癌。
1.1.2 临床资料 口腔鳞癌患者32例,男23例,女9例,年龄42~78岁,平均60岁。高分化21例、中低分化11例。无淋巴结转移13例,有淋巴结转移19例,无发生远处转移者。另设12例口腔黏膜正常组织作对照。
1.1.3 试剂 小鼠抗人细胞角蛋白(广谱)、E-cadherin单克隆抗体及DAB显色试剂盒、免疫组化PV试剂盒均购自北京中杉金桥生物技术有限公司,小鼠抗人GSK-3β单克隆抗体购自恩晶生物技术有限公司。
1.2 实验方法
1.2.1 免疫组织化学染色行PV二步法 组织蜡块经厚5 μm连续切片,脱蜡水化后,柠檬酸抗原修复液高压热处理修复抗原,3%去离子水封闭内源性过氧化物酶分别加入GSK-3β(1∶50)、E-cadherin(1∶100)、细胞角蛋白(1∶100)一抗工作液、4 ℃孵育过夜。加入生物素化二抗,DAB显色,苏木素复染,中性树胶封固。PBS代替一抗做阴性对照。实验程序严格按照试剂说明书进行。另取一张切片行苏木精-伊红(HE)染色。
1.2.2 结果判定 免疫组织化学及原位杂交每例切片随机选择10个视野(放大200倍)拍照。参考相关文献以Imagepro-plus图像分析系统进行平均光密度(MOD)分析,分析中进行了光密度校准及空间标定,按照阳性表达在照片中的范围在照片中画出测量区域,即总面积,读取积分光密度(IOD)数值,作为此张照片的累积光密度值。MOD计算方法为MOD=IOD/Area(Sum)。
1.3 统计学处理
采用SPSS 21.0统计软件分析数据,GSK-3β、E-cad、CK光密度不满足正态分布,参数检验(P>0.05),故采用中位数及四分位间距M(P25,P75)表示。正常组织与口腔鳞癌组织的光密度的差异,不同临床特征下GSK-3β、E-cad、CK光密度比较采用Mann-Whitney非参数检验,两样本比较采用Spearman秩和相关进行相关检验。检验水准为双侧α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 GSK-3β、E-cad、CK在OSCC及正常组织中的表达
E-cad阳性信号主要位于正常上皮组织细胞膜,少量表达于细胞质(图1a),在OSCC组织中多表达于仍存在细胞极性的鳞状上皮部分,呈浅淡的不均质点状分布,在大多数癌巢组织无着色表现(图1b);CK主要定位于上皮细胞质(图1c),相较于周围上皮组织,癌巢部位CK的表达相对较低(图1d)。GSK-3β的阳性信号主要定位于正常口腔鳞状上皮细胞质中(图1e),在OSCC组织中表达减少或少数在细胞核中异位表达 (图1f)。
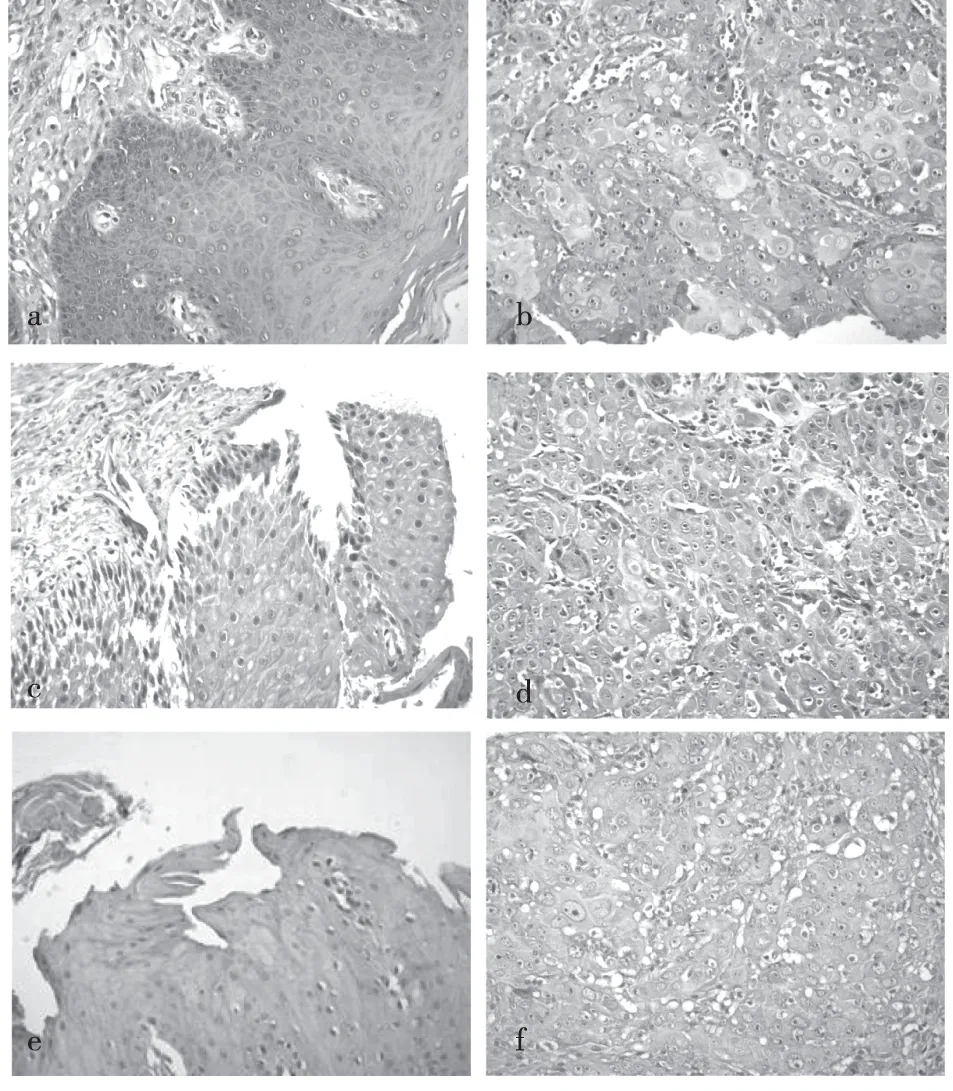
图1 免疫组织化学染色结果(SP×20)
2.2 GSK-3β、E-cad、CK在OSCC与正常组织表达的MOD值
GSK-3β、E-cad、CK在OSCC与正常组织表达的MOD值见表1,在OSCC组织中,GSK-3β、E-cad及CK的表达明显低于正常组织(P<0.05)。

表1 GSK-3β、E-cad、CK在OSCC与正常组织表达的MOD值
2.3 OSCC组织中GSK-3β、E-cad、CK表达与临床病理资料的关系
在OSCC中,E-cad在有淋巴结转移组中高于无淋巴结转移组,在T1+T2分期中表达低于T3+T4分期;CK在有淋巴结转移组中高于无淋巴结转移组;GSK-3β在有淋巴结转移组中表达低于无淋巴结转移组,在T1+T2分期中表达高于T3+T4分期,以上差异均有统计学意义(P<0.05);GSK-3β、E-cad表达在不同分化组中差异无统计学意义;CK的表达在不同肿瘤分期中差异无统计学意义(P>0.05)。见表2。
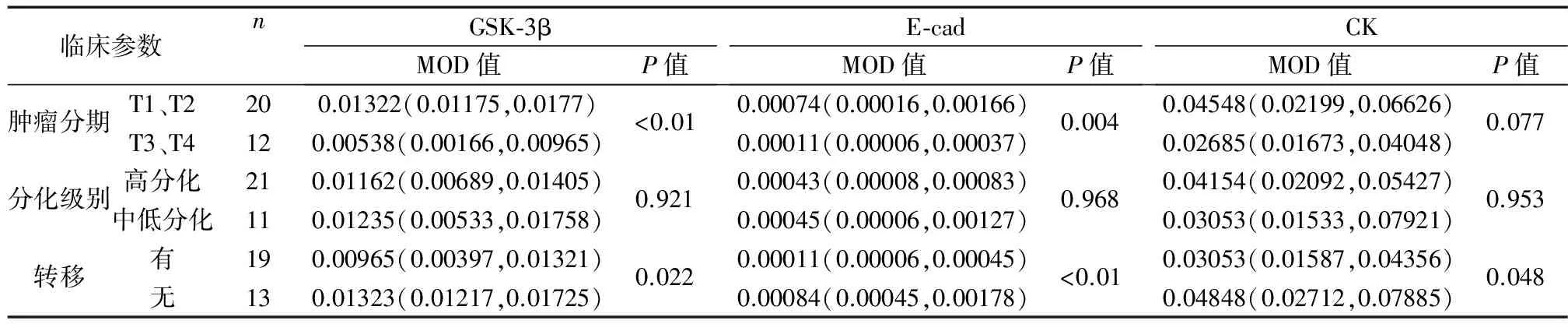
表2 OSCC组织中GSK-3β、E-cad、CK表达与临床病理资料的关系
2.4 OSCC中GSK-3β、E-cad、CK的相关性
CK与其他指标无相关性,E-cad及GSK-3β呈正相关,相关系数为0.572(P=0.001)。
3 讨 论
GSK-3β是一种能磷酸化多种底物的多功能丝氨酸/苏氨酸激酶[6]。它可与其他蛋白组成复合物,也可游离散在分布于胞浆中,在成熟的上皮细胞中为活化状态,通过对底物磷酸化[7],可作用于众多信号蛋白、结构蛋白和转录因子,调节细胞的分化、增殖、存活和凋亡[8-9]。GSK-3β在多种信号通路中起负性调节作用[10-11],此外研究[12]还发现,在口腔、肝、前列腺等肿瘤中,GSK-3β具有抑瘤作用,而Chandra等[13]发现,在已发生EMT的侵袭性胸腺导管癌中,GSK-3β在细胞质中表达减少,细胞核中有表达,证实GSK-3β与肿瘤的EMT存在一定关系。E-cad是一类介导同型细胞间黏附的钙依赖型跨膜糖蛋白,是目前公认的最为经典的上皮细胞标记物[14],主要参与细胞间连接,维持生理条件下上皮组织的极性和结构的完整性[10]。有研究[15-17]认为,在甲状腺肿瘤、胃癌、结直肠癌等肿瘤中发现E-cad的表达下调,E-cad的减少或丢失是EMT发生的典型特征,与上皮来源的肿瘤细胞侵袭有密切联系[18]。CK是另一种上皮细胞特征标记物,其具有多个亚型且不同亚型存在于不同类型上皮细胞的不同阶段[19],已有研究表明在某些人上皮肿瘤中有不同类型的CK的表达。E-cad、CK是目前最常用的监测EMT进程的上皮标记物。
本研究结果显示,GSK-3β、E-cad、CK在OSCC组织中表达较正常组织低(P<0.05),这与多数研究结果相似,提示GSK-3β、E-cad、CK的异常表达可能与OSCC发生发展相关,OSCC可能存在EMT现象;E-cad、GSK-3β在T1+T2分期组表达较T3+T4分期组高,提示异常的GSK-3β低表达,可能促进OSCC生长,瘤细胞不易凋亡,肿瘤能顺利增殖、分化,E-cad的异常低表达,促使瘤组织细胞间连接越加松散;E-cad、GSK-3β、CK在有淋巴结转移组表达较无淋巴结转移组降低,提示E-cad、CK、GSK-3β异常表达与OSCC的淋巴转移密切相关,三者表达的降低有可能使OSCC发生淋巴转移的几率提高。本研究结果显示,上皮标记物E-cad及CK存在异常低表达,在OSCC组织可能存在上皮间质转化现象,E-cad与GSK-3β表达呈正相关(r=0.572,P=0.001),提示GSK-3β的异常低表达可能是OSCC中发生EMT的重要因素,与肿瘤EMT发生密切相关。
有研究[12]表明,GSK-3β在肿瘤细胞中表达减少,对肿瘤的抑瘤作用降低,可以使肿瘤的发生发展获得一定自由,同时GSK-3β可参与Wnt/β-catenin、FAS等多种与EMT发生机制相关的信号通路,起负性调节作用,其表达减少,有可能促进肿瘤发生EMT现象[20],使细胞获得转移和入侵的能力。OSCC的淋巴转移及侵袭机制涉及多因素及机制,本实验通过研究E-cad、CK、GSK-3β在OSCC中的表达,证实在人OSCC中存在EMT现象,通过分析各因子与临床病理资料之间关系证实,OSCC中GSK-3β的表达水平与OSCC发生发展相关,且GSK-3β与EMT发生有一定关系,其具体如何参与EMT的进程,有待进一步深入研究。GSK-3β的抑瘤及对EMT形成的影响使其有可能成为早期预测肿瘤侵袭转移的标记蛋白,为提前预测肿瘤的转移提供新的预测方法及为研究肿瘤的治疗方法提供一些新的思路。
[1] 魏宏琳,宋宇峰.组织因子和基质金属蛋白酶-2在口腔鳞癌生长和转移中的作用[J].贵州医药,2012, 36(8):675-678.
[2] 邹丹丹,汤显斌.上皮间质转化与肿瘤干细胞[J].中华病理杂志,2013,42(1):62-65.
[3] Lamouille S, Xu J, Derynck R. Molecular mechanisms of epithelial-mesenchymal transition[J]. Nature reviews Molecular cell biology, 2014, 15(3): 178-196.
[4] Ruscetti M,Quach B,Dadashian E L,et al.Tracking and functional characterization of epithelial-mesenchymal transition and mesenchymal tumor cells during prostate cancer metastasis[J].Cancer research,2015,3476.
[5] 姚蝉,茂德.上皮间质转化(EMT)及其分子机制[J].国际遗传学杂志,2006,29(4):290-294.
[6] 占育华,崔涵,刘济远,等.核因子κB/B细胞淋巴瘤2信号通路与糖原合成激酶3β在口腔鳞状细胞癌中的表达及临床意义[J].华西口腔医学杂志,2015,33(4):11-15.
[7] Thornton T M,Pedraza-Alva G.Phosphorylation by p38 MAPK as an alternative pathway for GSK-3β inactivation[J].Science,2008,320(5876):667-670.
[8] 尹定子,宋海云.Wnt信号通路:调控机理和生物学意义[J].中国细胞生物学学报,2011,33(2)103-111.
[9] Larue L,Bellacosa A. Epithelial-mesenchymaltransition in development and cancer: role of phosphatidylinositol 3'Kinase/ Akt pathways [ J ].Oncogene, 2005, 24(50):7443-7454.
[10] Duzyji CM,Buhimschi A,Motawea H,et al.The invasive phenotype of placenta accreta extravillous trophoblasts associates with loss of E-cadherin[J].Placenta,2015(36):645-651.
[11] Yan D, Avtanski D, Sanxena NK, et al. Leptin-induced epithelial-mesenchymal transition in breast cancer cells requires β-catenin activation via Akt/GSK3-and MTA1/Wnt1 protein-dependent pathways[J]. J BiolChem, 2012,287(11):8598-8612.
[12] Thamilselvan V,Menon M,Thamilselvan S. Anticancer efficacy of deguelin in human prostate cancer cells targeting glycogen synthase kinase-3 β/β-catenin pathway [J].Int J Cancer,2011,129 ( 12) : 2916-2927.
[13] Chandra P Prasad, Gayatri Rath, Sandeep Mathur,et al. Ranju ralhan:expression analysis of E-cadherin, slug and GSK3β in invasive ductal carcinoma of breast[J]. BMC Cancer ,2009, 18:215-230.
[14] Marcello Guarino .Eptithelial-mesenchymal transition and tumour invasion[J].M.Guarino/The International Journal of Biochemistry&Cell Biology,2007, 39:2153-2160.
[15] Cheng Y,Zhou Y,Jiang W,et al.Significance of E-cadherin,β-catenin,and vimentin expression as postoperative prognosis indicatorsin cervical squamous cell carcinoma[J].Hum Pathol,2012,43(8):1213-1220.
[16] Huiping C,Kristjansdottir S,Jonasson JG,et al.Alterations of E-cadherin and catenin in gastric cahcer[J].BMC Cancer,2001,1(1):16.
[17] Ichikawa Y,Nagashima Y,Morioka K,et al.Colorectal laterally spreading tumors show characteristic expression of cell polarity factors,including atypical protein kinase Cλ/ι,E-cadherin,β-catenin and basement membrane component[J].Oncology letters,2014,8(3):977-984.
[18] Scarpa E,SzabA,Bibonne A,et al.Cadherin switch during EMT in neural crest cells leads to contact inhibition of locomotion via repolarization of forces[J].Developmental cell,2015,34(4):421-434.
[19] Chu PG, Weiss LM.Keratin expression in human tissues and neoplasms[J].Histopathology,2002,40:403-439.
[20] Tsai K H,Hsien H H,Chen L M,et al.Rhubarb inhibits hepatocellular carcinoma cell metastasis via GSK-3-β activation to enhance protein degradation and attenuate nuclear translocation of β-catenin [J].Food Chem,2013,138(1):278-285.
Expression and significance of GSK-3β etc. and relation with epithelial-mesenchymal transition inoral squamous cell carcinoma
MaZhujun1,FengHongchao2,SongYufeng3,GaoQiong4,SunHaoxuan5.
1.GuizhouMedicialUniversity,Guiyang550004,China. 2.GuiyangCityStomatologicalHospital.Guiyang550001,China. 3.FoodandDrugAdministrationBureauinGuizhouProvince,Guiyang550004,China. 4.DepartmentofOralandMaxillofacialSurgery.AffiliatedStomatologyHospital,GuizhouMedicialUniversity,Guiyang550004,China. 5.DepartmentofOralandMaxillofacialSurgery,OphthalmologyHospitalofHebeiProvince,Xingtai054001,China.
Objective To analysis the expression of GSK-3β and EMT correlated protein to discuss the clinicopathological feature of OSCC and investigate the relationship between EMT and OSCC lymph node invasion or distant metastasis. Methods 32 cases of OSCC and 10 cases of normal human were detected by IHC to explore the expression of GSK-3β and epithelial drived markers: E-cadherin, Cytokeratin. Results In OSCC group, the expression of GSK-3β, Cytokeratin and E-cadherin is significantly lower than those in the normal group (P<0.05, Table 1); the expression of GSK-3β and E-cadherinis in T4+T3 group is significantly lower than T1+T2 group (P<0.05, Table 2). In the group with lymph node metastasis, the expression of GSK-3β, E-cadherin and Cytokeratin is obviously lower than the group without lymph node metastasis (P<0.05,). The expression of GSK-3β, E-cadherin and Cytokeratin had no obvious relationship with patient's degree of tumor differentiation (P>0.05). The expression of GSK-3β and E-cadherin were observed strong positive correlations (r=0.572,P=0.001). Conclusion EMT takes place in OSCC. E-cadherin, Cytokeratin and GSK-3βare differently expressed in OSCC and normal epithelial tissue. GSK-3β may involve the progression of EMT in OSCC, promote infiltraton and metastasis of OSCC. Combined with the above three factors, it may be helpful for predicting the transfer of OSCC and the targeted therapy of OSCC.
OSCC; GSK-3β; Cytokeratin; E-cad; EMT; LNM
贵阳市卫生局科学技术计划项目 (2014筑卫科技合同字第15号);贵州省科技计划课题任务[黔科合LG字(2011)001号]
R739.8
A
1000-744X(2016)04-0354-04
2015-09-25)
△通信作者,E-mail:hongchaof@126.com



