王艳 刘卫国 章文斌 于翠玉 祝雅静 闫磊 王晓
(1.南京大学医学院附属南京鼓楼医院集团宿迁市人民医院,江苏 宿迁 223800;2.南京大学医学院附属南京市脑科医院,江苏 南京 210000)
·技术与方法·
急性左旋多巴冲击试验对帕金森病患者运动症状的改善特点
王艳1刘卫国2△章文斌2于翠玉2祝雅静2闫磊2王晓2
(1.南京大学医学院附属南京鼓楼医院集团宿迁市人民医院,江苏 宿迁 223800;2.南京大学医学院附属南京市脑科医院,江苏 南京 210000)
目的 分析急性左旋多巴冲击试验(ALCT)对帕金森病(PD)患者运动症状改善的特点。方法 收集南京市脑科医院PD中心已行脑深部刺激(DBS)手术治疗的患者ALCT的相关资料,以统一帕金森病评分量表(UPDRSⅢ)运动部分评分为指标,分析左旋多巴冲击试验运动症状、中轴症状改善情况,观察不同运动症状改善率有无显着差异。 结果 患者的运动症状UPDRSⅢ平均改善率为57.7%,PD的运动症状中震颤、强直、运动迟缓、步态或姿势异常分别改善了75.1%、51.4%、58.9%、57.5%,组间比较有统计学差异;患者的轴性损害症状UPDRSⅢ平均改善率为54.3%,言语、步态和姿势的平均改善率分别为48.4%,64.6%,40.0%,组间比较有统计学差异。结论 急性左旋多巴冲击试验对PD患者运动症状全面改善,作为DBS术前筛选具有重要的临床意义,可作为DBS治疗估计预后的指标。
帕金森病; 急性左旋多巴冲击试验; 运动症状; 中轴症状; 脑深部刺激治疗
帕金森病(PD)[1]是一种中老年人常见的神经系统变性疾病,运动症状(静止震颤、肌肉僵直、运动迟缓和步态或姿势异常)是帕金森病的主要诊断标准,随着病程的进展运动症状呈进行性加重,中晚期患者的多巴胺能反应较病程早期多明显下降,常规药物治疗效果不佳,对药物疗效下降[2, 3]。脑深部刺激(DBS)治疗作为一种侵入性的外科治疗方法,已成为药物治疗的重要补充方法,但术前病人的筛选尤为重要,术前对左旋多巴敏感是筛选适合DBS治疗及估计预后的重要指标。我国指南[4]推荐急性左旋多巴冲击试验(ALCT)是判断DBS疗法疗效的重要预测指标,最大改善率≥30%提示DBS疗法可能有良好疗效。针对ALCT对PD患者不同运动症状的改善特点,本研究选取20例进行DBS治疗的PD患者,对其术前急性左旋多巴冲击试验的资料进行总结,分析ALCT对不同运动症状改善特点,现报告如下。
1 对象与方法
1.1 研究对象 收集2013年1月至2014年5月在南京医科大学附属南京脑科医院帕金森治疗中心曾进行DBS手术的患者20例,男女各10例,平均年龄(59.0±8.6)岁,平均发病年龄(49.5±8.6)岁,平均病程(9.5±3.8)年,H-Y分期(3.7±0.7),MMSE评分(29.0±1.3)。诊断符合英国PD协会脑库PD诊断标准 (UKPDSBB),排除标准:(1)经头颅CT或MRI检查存在帕金森叠加症或继发性帕金森综合征;(2)合并脑占位病变,脑积水;(3)严重抑郁,焦虑,精神疾病及痴呆。患者术前均进行急性左旋多巴冲击试验并完成试验。
1.2 方法 20例患者试验前72 h停服多巴胺受体激动剂,试验前12 h停服复方左旋多巴制剂及其他抗PD药物。本试验由两位未参加病例筛选的神经科医生进行评测。试验药物应采用复方左旋多巴标准片,服用剂量以之前每天早上第1次服用的抗PD药物换算为左旋多巴等效剂量(LED)的1.5倍。空腹状态下,先进行UPDRS -Ⅲ评分作为基线, 30 min后服用复方左旋多巴标准片,随后每30 min进行1次UPDRS -Ⅲ评分,至服药后4 h。计算UPDRS-Ⅲ的最大改善率:最大改善率=(服药前基线评分-服药后最低评分)/服药前基线评分×100%。在试验过程中,监测患者心率、血压等, 记录不良反应。以两位评分者的平均数作为受试者服用复方左旋多巴的最大改善率。再分别计算左旋多巴冲击试验前后各自的震颤分,强直分,运动迟缓分,步态或姿势异常分差值,分别计算各运动症状的改善率。分别计算出20例患者各运动症状的改善率后,20例改善率相加后除以20得出各运动症状的平均改善率。
1.3 统计学方法 采用SPSS 20.0软件进行统计学分析,定量数据组间比较采用独立样本t检验,组内比较采用配对t检验,定性数据采用卡方检验,以P<0.05,为差异有统计学意义。
2 结 果
所有完成试验的患者均无严重的或持续的不良反应。冲击后的评分明显低于冲击前的评分(P<0.05)。试验后帕金森UPDRSⅢ总分平均分平均改善率为57.70%。帕金森四主征的的平均改善率分别为67.9%,49.8%,59.1%,53.3%,四主征平均改善率之间差异有统计学意义(P<0.05)。轴性损害症状的UPDRSⅢ平均改善率为54.3%,言语、步态和姿势的平均改善率分别为48.4%,64.6%,40.0%,轴性症状之间比较有统计学意义(P<0.05),见表1。
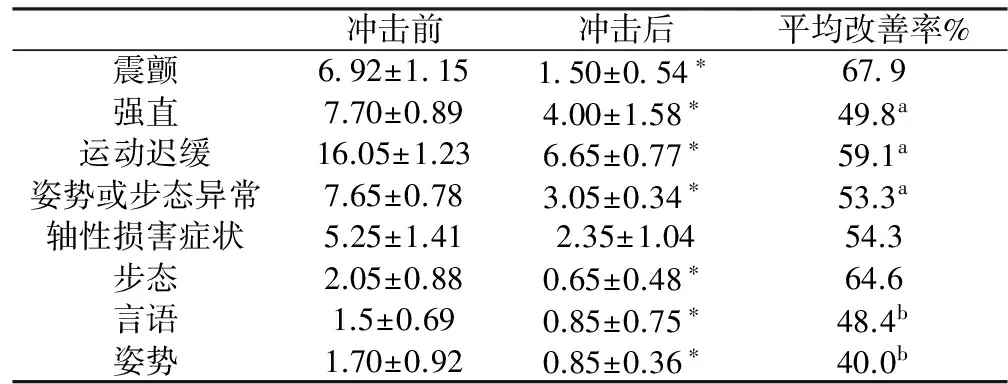
表1 冲击试验前后运动症状改善率
注:与冲击前相比较,*P<0.05,与震颤相比较,;aP<0.05;与步态相比较,bP<0.05。
3 讨 论
DBS是中晚期PD治疗的一个重要补充方法,运动评估是术前筛查的重要步骤,运动波动、异动患者对复方左旋多巴的反应性极为重要,良好的反应性预示着DBS疗法的良好反应。ALCT是运动评估常用的判断指标,开期的持续时间并不重要,关键是运动症状的改善程度,我国指南推荐最大改善率≥30%提示DBS疗法可能有良好疗效,本研究发现行DBS治疗的PD患者ALCT的最大改善率为57.70%,显着高于指南推荐的最大改善率。我们同时发现不同的运动症状之间其改善率存在显着性差异,其中以震颤改善最为显着。
多巴胺能反应性的大小与黑质纹状体退行性变的进展程度有关, ALCT是常用的评估多巴胺能反应性的方法。ALCT可以作为PD和非PD的鉴别诊断手段,选用UPDRSG改善率≥30%作为鉴别诊断PD与非PD的标准时具有较高的敏感性和特异性。本研究选择已经行DBS治疗的PD患者作为研究对象,观察最大改善率和不同运动症状UPDRSG改善率,我们发现在200/50mg试验的剂量下得到的UPDRSⅢ改善率为61.1%,大于指南[4]推荐的最大改善率,明显高于同等剂量下文献报道[5]的40.36%,也高于文献[6]报道及本研究在300/75mg剂量下UPDRSⅢ的改善率49.93%,52.69%,考虑进入本研究的被试者多为左旋多巴反应特别良好的患者,文献所筛选的是符合英国PD协会脑库PD诊断标准的患者,存在混杂非PD的帕金森综合征患者的可能,本研究分别计算震颤、强直、运动迟缓和姿势或步态异常四主征的平均改善率为67.9%,49.8%,59.1%,53.3%,其中震颤改善最明显,与其他三组比较有统计学差异(P<0.05),这与我们使用美多巴治疗帕金森患者时震颤的症状改善最明显是一致的。既往的研究[7]表明,多巴胺能神经元减少是运动症状发生的共同基础,但震颤发生的具体机制及特定中心尚有争议。目前认为[8]震颤是神经元网络包括基底节,丘脑、小脑相互影响导致的,其严重程度主要与小脑蚓状体及相关环路受损相关,因此行DBS治疗的患者术前的震颤评分可能与其他运动症状有所不同,本研究发现入组患者的震颤UPDRS评分是运动症状四主征中是最低的,而ALCT的改善率却为四主征中最高,符合目前对震颤发病机制的认知,也提示在DBS患者筛选中需重视术前震颤评分和改善率的变化。
轴性损害症状是运动症状中治疗的难点,近年来受到较多关注。既往的研究认为步态异常是进展性PD的常见症状,主要与病程及多巴胺反应性相关[9]。步态异常的患者对多巴胺的反应性分为多巴胺反应性、多巴胺抵抗性、多巴胺诱导性三种类型,若术前对多巴胺具有良好反应性提示DBS效果可能为佳[10]。本研究发现入组患者的轴性损害症状改善率达到54.3%,在轴性症状中步态的UPDRSG改善率最高(64.6%),显着高于言语和姿势(48.4%,40.0%)(P<0.05),考虑入组患者为多巴胺反应性患者,对DBS效果较好,我们将纵向随访该批患者以观察其轴性损害症状的动态变化。
[1] Gazewood J D, Richards D R, Clebak K. Parkinson disease: an update[J]. Am Fam Physician,2013,87(4):267-273.
[2] 徐坚,陶陶. 特发性震颤伴发帕金森氏病17例报告[J]. 贵州医药,2004,28(12):1065.
[3] 唐明. 帕金森病的影响因素探讨[J]. 贵州医药,2011,35(7):658-660.
[4] 中国帕金森病脑深部电刺激疗法专家组. 中国帕金森病脑深部电刺激疗法专家共识[J]. 中华神经科杂志,2012,45(7):541-543.
[5] Feng T, Li W, Lu L, et al. Acute stepwise challenge test with levodopa in treated patients with parkinsonism[J]. Parkinsonism Relat Disord,2009,15(5):354-358.
[6] Feng T, Li W, Lu L, et al. Acute stepwise challenge test with levodopa in treated patients with parkinsonism[J]. Parkinsonism Relat Disord,2009,15(5):354-358.
[7] Pirker W. Correlation of dopamine transporter imaging with parkinsonian motor handicap: how close is it?[J]. Mov Disord,2003,18 Suppl 7:S43-S51.
[8] Fishman P S. Paradoxical aspects of parkinsonian tremor[J]. Mov Disord,2008,23(2):168-173.
[9] Giladi N, Mcdermott M P, Fahn S, et al. Freezing of gait in PD: prospective assessment in the DATATOP cohort[J]. Neurology,2001,56(12):1712-1721.
[10] Ferraye M U, Debu B, Pollak P. Deep brain stimulation effect on freezing of gait[J]. Mov Disord,2008,23 Suppl 2:S489-S494.
R742.5
B
1000-744X(2016)07-0763-02
2016-02-25)
△通信作者



