王旭杰 蔡蓓珺
(上海市长宁区妇幼保健院妇科,上海 200051)
宫颈癌为目前最常见的女性恶性肿瘤之一,DNA依赖性蛋白激酶(DNA-depended protein kinase,DNA-PK)作为DNA靶向性和调节性成分,在DNA修复中发挥重要的作用,高表达意味着修复能力的提高[1-3]。国外关于DNA-PK在放化疗宫颈癌患者中的表达已有报道,但国内这方面资料尚少,且关于DNA-PKcs表达与预后关系尚不清楚[4-5]。本研究观察了DNA-PKcs蛋白在放化疗宫颈癌患者中的表达,及其与生存相关,为提高宫颈癌放化疗的敏感性提供新途径。报告如下。
1 资料与方法
1.1 临床资料 选择2009年1月至2013年7月我科治疗的Ⅱb~Ⅲb期宫颈癌患者109例,年龄23~75岁,平均(45.6±9.73)岁。入选标准:明确诊断为Ⅱb~Ⅲb期宫颈癌;均未经过其他化疗药物治疗;检查肝肾功能、肺功能、心电图均正常,无化疗禁忌;能配合治疗,无药物过敏史者。排除标准:(1)合并其他组织器官肿瘤者;(2)不配合治疗者,随访资料缺失者;(3)伴有严重的神经和精神障碍的患者。患者肿瘤特征,如分期、肿瘤大小、病理组织学类型和分级与RT后肿瘤缓解程度见表1。本文经我院伦理委员会批准,患者或患者家属均签署了知情同意书。
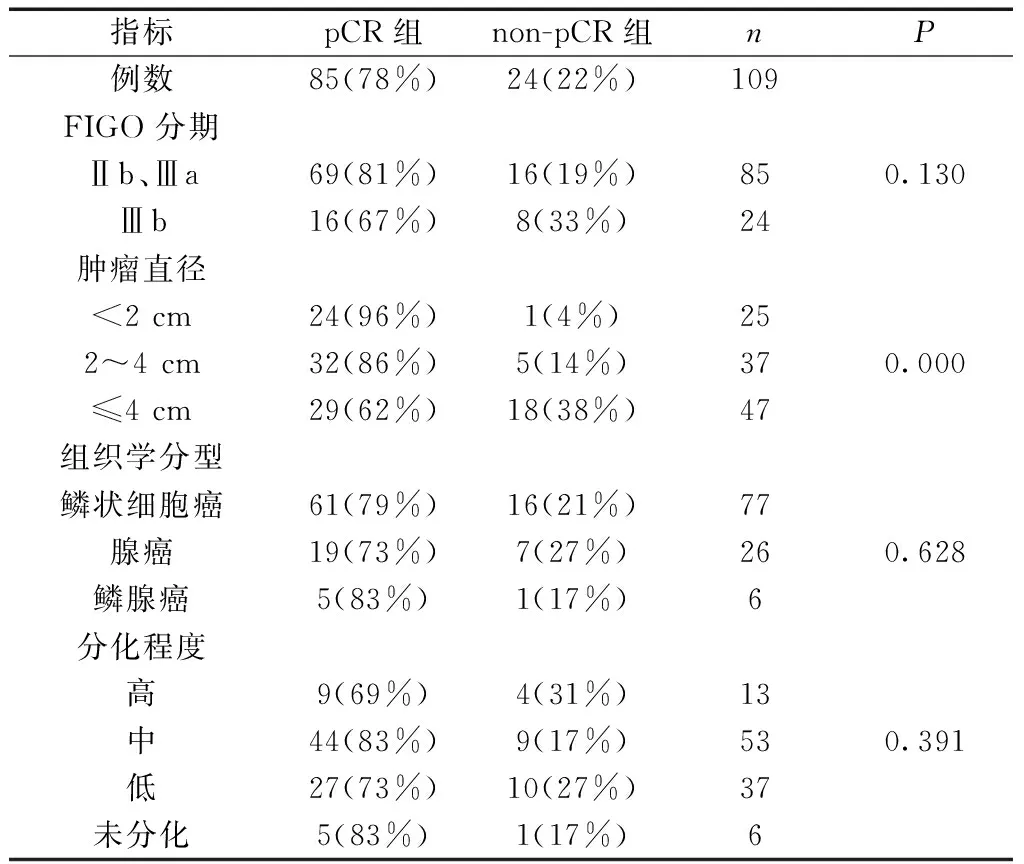
表1 与肿瘤缓解相关的肿瘤特征
1.2 治疗方法 体外照射野采用6-MVX线直线加速器,全骨盆外照射(EBRT)和低剂量率或高剂量率联合使用。前后对穿照射,每周5次,每次1野,每野盆腔中平面剂量(DT)2Gy。当达到DT30Gy时改为盆腔四野照射,于全盆照射中央挡铅(4~5) cm×(10~11) cm,每次每野DT 2Gy,每周5次,总量DT 20Gy。大野10次后同时给予192铱腔内后装治疗,每次A点6Gy,每周1~2次,共7次,A点总量42Gy。同步采用经股动脉穿刺双侧髂内动脉灌注化疗,药物选择顺铂、环磷酰胺、阿霉素或5-Fu,二联或三联用药。根据临床疗效及检查结果选择1~4个疗程的动脉灌注化疗,疗程间隔3周,每个疗程结束后2周评估介入疗效,符合下列情况且具备手术条件者行根治性手术:(1)宫颈基本光滑或宫颈肿瘤缩小2/3,临床分期出现逆转;(2)宫旁组织变松软有弹性;(3)无严重的介入化疗损伤。此时可行广泛子宫切除+盆腔淋巴结清扫术。放化疗敏感性的评估由手术切除的标本1周内组织病理学进行评价。免疫组化检测DNA-PK蛋白表达及结果判断:采用免疫组织化学法检测标本中的DNA-PK表达,标本经福尔马林固定后液体石蜡包埋,制成4μm厚度连续切片。先行梯度酒精脱水,然后采用PBS缓冲液冲洗,加入生物学一抗过夜,山羊血清封闭后加人生物学二抗,DAB显色。梯度酒精水化后采用苏木精复染,再以中性树胶封片。SP-9002免疫组化试剂盒与PBS缓冲液均购自广州安必平医药科技公司,检验医师严格遵照说明书操作。DNA-PK以细胞核出现黄色或棕黄色颗粒为阳性,同时随机选取每张切片10个400倍视野,并综合染色强度以及阳性细胞所占比例进行判定[5],染色强度评分:0分为不着色,1分为黄色,2分为棕黄色,3分为黄褐色。阳性细胞占比评分[6]:0分为阳性细胞占比<5%,1分为阳性细胞占比在5%~24%之间,2分为阳性细胞占比在25%~49%之间,3分为阳性细胞占比在50%~74%之间,4分为阳性细胞占比>75%。染色强度评分×阳性细胞占比评分即为综合评分,其中0分记为阴性,1~12分记为阳性。随访:患者均自电话或门诊随访,术后随访5年,失访人群在生存分析前删除。
2 结 果
2.1 两组标本中DNA-PK阳性率表达 DNA-PK蛋白主要位于细胞核,在正常宫颈组织中表达呈阴性,宫颈癌周围淋巴结组织中呈淡黄色或黄色阳性(++)表达,低分化腺癌组织、鳞状细胞癌癌组织中呈棕褐色强阳性表达(+++)。见图1。pCR组的DNA-PK阳性率(56/85,65.8%)低于non-pCR组(18/24,75.0%),差异有统计学意义(χ2=8.06,P=0.04)。见表1。
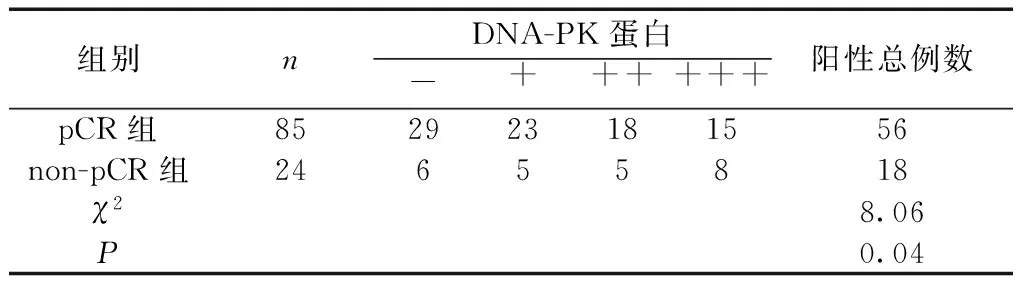
表2 pCR组及non-pCR组DNA-PK蛋白阳性表达率比较(n,%)
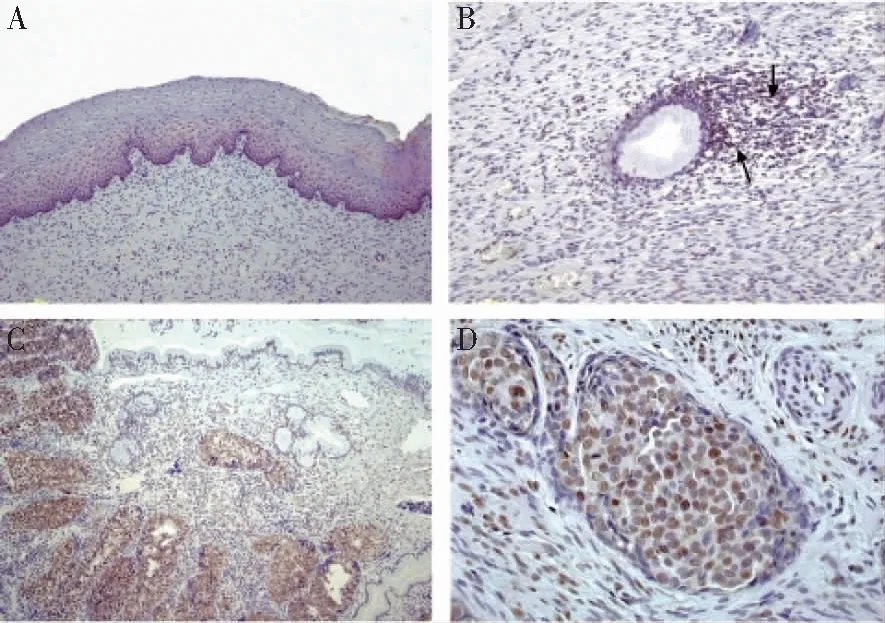
注:A DNA-PK在正常宫颈组织中不表达;B DNA-PK在宫颈癌周围淋巴结中弱表达;C DNA-PK在低分化腺癌组织中高表达;D DNA-PK在鳞状细胞癌组织中高表达。
图1 DNA-PK在宫颈癌及正常组织中的表达情况
2.2 DNA-PK的表达与宫颈癌患者预后的关系 109例宫颈癌患者均自电话或门诊随访,术后随访5年,随访截至日期为2018年8月3日,109例患者中,105例完成随访,2例DNA-PK蛋白表达阳性患者失访,失访率为1.8%(2/109),失访人群在生存分析前删除。随着DNA-PK表达水平增加,患者中位生存时间逐渐缩短,DNA-PK表达水平不同的三组患者1、3 和 5 年生存率比较差异有统计学意义(P<0.05)。见表3。采用 Cox比例回归风险模型对103例宫颈癌患者的5年生存影响因素进行分析, 结果显示:DNA-PK 蛋白(+++)表达(P=0.002)、分化程度越低(P=0.036)、浸润深度越高(P=0.001)和有远处转移(P=0.002)是宫颈癌患者的独立危险因素。见表4。
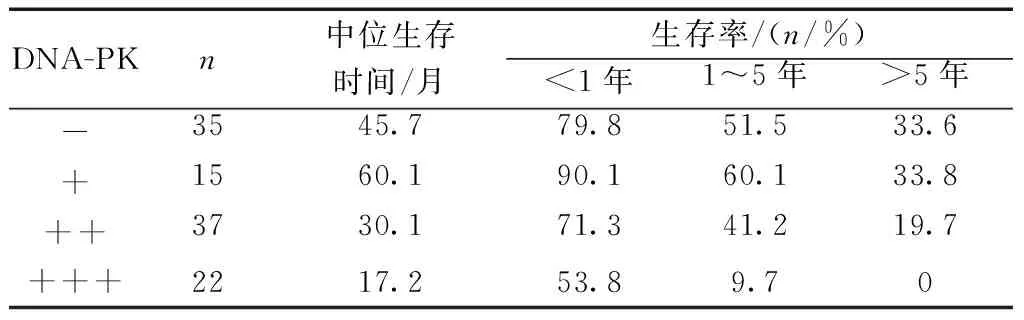
表3 不同水平DNA-PK表达的宫颈癌患者中位生存时间和生存率
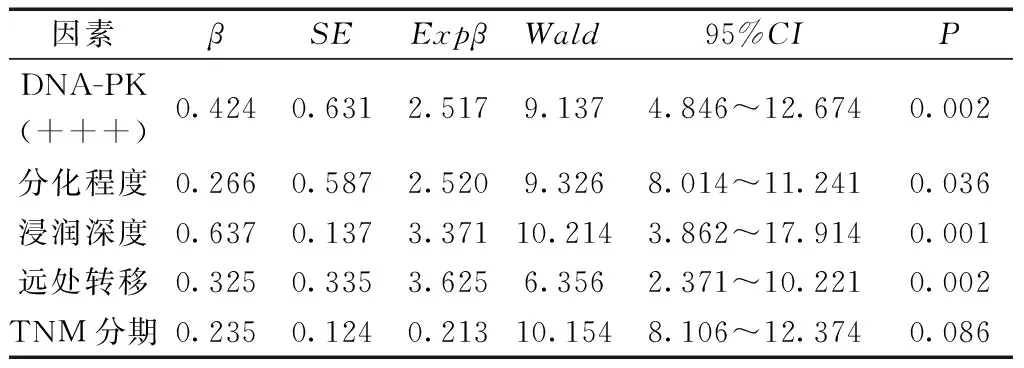
表4 影响宫颈癌患者5年生存结局的COX模型多因素分析
注:总χ2=47.20,ν=5,P<0.001。
3 讨 论
宫颈癌是常见的妇科恶性肿瘤之一,呈逐年上升趋势。电离辐射可以损伤肿瘤细胞DNA,杀死细胞,而肿瘤细胞对电离辐射的敏感性取决于DNA双链断裂(DSBS)修复。非同源末端连接(NHEJ)是哺乳动物细胞DNA DSBS修复的主要途径[7]。DNA-PK在NHEJ过程中发挥至关重要的作用。DNA-PK由一个催化亚基DNA-PKcs(大小470 kD)和2个调节亚基Ku70、Ku80组成[8]。DNA-PKC为丝氨酸/苏氨酸蛋白激酶,属于磷脂酰肌醇-3激酶相关激酶家族,包括其他涉及DNA修复信号的蛋白,如ATM和ATR[9]。ATM中的基因突变DNA PKC基因导致免疫缺陷、癌症易感性对电离辐射具有超敏反应。目前,人肿瘤细胞系胶质母细胞,肺癌细胞系细胞中DNA PKC含量与辐射敏感性的相关性已经得到证实[10]。另外学者研究了I b~Ⅱa期子宫颈癌组织中DNA损伤反应蛋白与肿瘤放疗敏感性的关系,发现肿瘤组织中DNA-PKcs、Ku86、Ku70表达明显高于相邻的非瘤组织,而且三者密切相关;但结论是DNA-PK各亚基在瘤组织中的表达水平不能作为早期宫颈癌放射敏感性的预测指标[11]。研究[12]发现,DNA-PKcs在肺癌、食管癌、大肠癌等多种肿瘤组织中高表达,且可以降低肿瘤的放疗敏感度。有研究用免疫组化法检测DNA-PKcs蛋白在治疗前I B~ⅡB期宫颈癌组织中的表达,发现DNA-PKcs在放疗敏感组32例中仅有7例高表达,放疗抗拒组31例中有30例高表达,DNA-PKcs高表达组总生存时间均数比低表达组短[13]。本研究结果显示,病理缓解宫颈癌中的DNA-PK阳性率低于病理无缓解宫颈癌,差异具有统计学意义。提示DNA-PKcs的低表达是宫颈癌对放化疗敏感的一项参考指标。因为放射线是通过损伤细胞DNA导致细胞坏死凋亡而杀死肿瘤细胞,而抗肿瘤药物是在肿瘤细胞增值周期中破坏或抑制DNA的合成而杀灭肿瘤细胞。如果肿瘤细胞DNA修复基因过度表达,肿瘤细胞可能快速修复,从而对放疗和化疗产生耐受,使治疗难以奏效。因此,在治疗之前,检测患者宫颈癌组织中DNA-PKcs的表达水平,可以较好地预测宫颈癌的放化疗敏感性,对临床治疗方案的选择有着重要的指导意义。DNA-PK与宫颈癌的远处转移、浸润有关,可作为宫颈癌发生、发展及转移的预测因子。DNA-PK蛋白(+++)表达死亡风险更大,5年生存率及中位生存时间更低。因此推测,DNA-PK蛋白的高表达可能反映了宫颈癌患者的不良预后结局。采用 Cox比例回归风险模型对103例宫颈癌患者的5年生存影响因素进行分析,结果显示:DNA-PK 蛋白(+++)表达(P=0.002)、分化程度越低(P=0.036)、浸润深度越高(P=0.001)和有远处转移(P=0.002)是宫颈癌患者的独立危险因素。这些均提示宫颈癌组织中的DNA-PK表达与宫颈癌预后有关,可能成为检测宫颈癌患者病情以及评估宫颈癌患者预后的重要指标。
总之,DNA-PK在宫颈癌组织中高表达可能与放化疗抵抗、预后有关,但其机制尚需要更进一步的探讨,阻断DNA-PK信号传导通路有可能成为增加放化疗敏感性的方法。



