陶志清 雷玲 鲁伊 郑乐婷文静 李曦 赵铖△
(广西医科大学第一附属医院,(1.风湿免疫科;(2.检验科,广西 南宁 530021)
系统性硬化病(SSc)是一种多系统疾病,以皮肤、肺、肾脏、胃肠道和心脏大量沉积胶原蛋白和其他结缔组织成分为特征。免疫系统失调和自身抗体的产生导致血管内皮和肺泡上皮细胞损伤导致组织的纤维化,组织纤维化反映了胶原蛋白产生和降解之间的不平衡,细胞损伤和异常愈合导致细胞外基质(ECM)蛋白特别是胶原蛋白在不同器官的积累[1]。ECM的过度沉积导致组织纤维化,损害组织结构和器官功能,组织中ECM蛋白的数量是通过基质金属蛋白酶(MMPs)对其产生和降解的平衡来控制的[2]。MMPs按其结构域可分为胶原酶、明胶酶、基质蛋白酶、母系蛋白酶和膜型基质金属蛋白酶。MMP-2(明胶酶A)和MMP-9(明胶酶B)是MMPs家族的着名酶,对胶原有广泛的底物特异性。MMP-2和MMP-9对原纤化胶原在最初被胶原酶裂解后的降解有相当大的影响,这两种明胶酶具有胶原蛋白水解活性,并能够裂解其他几种ECM蛋白[3]。因此,明胶酶在纤维化疾病的ECM稳态和发病机制中起着重要的作用。本研究通过检测博莱霉素诱导的SSc小鼠模型皮肤、肺组织中MMP-2、MMP-9的表达量,分析MMP-2、MMP-9改变在SSc发生中的可能机理,为其治疗及预后提供新的途径和方法。
1 材料与方法
1.1实验动物 SPF级雌性BALB/c小鼠16只,体重25 g左右,6~8周龄,由湖南斯莱克景达实验动物有限公司提供,自由饮水、摄食,适应性喂养1周。所有实验方案及操作均符合实验动物伦理学要求。
1.2主要实验试剂 Thal(常州制药厂),BLM(浙江海正药业股份有限公司),HYP测试盒( 南京建成生物研究所) ,引物(上海生工生物公司),逆转录试剂盒、DNA 纯化试剂盒、荧光定量PCR试剂(日本TaKaRa 公司)。
1.3方法
1.3.1动物建模及分组 将16只雌性BALB/c小鼠随机分对照组与SSc组,每组8只,硫化钠溶液脱去小鼠背部中央的毛,约2.0 cm×2.0 cm。对照组于小鼠背部脱毛处中央区皮下注射PBS 0.1 mL,SSc组注射用1 mg/mL的博来霉素0.1 mL, 1次/d,连续注射3周后处死,取背部皮肤和肺进行检测。
1.3.2HE染色和Masson染色 取小鼠的皮肤、肺组织进行固定、脱水、石蜡包埋,切片,行HE染色和Masson染色,测量镜下小鼠皮肤的厚度,皮肤和肺部炎症的程度:0表示无;1表示少许;2表示轻度;3表示中度;4表示重[4]。随机选择切片区域,由两位病理科医生进行盲法阅片,按照Ashcroft 半定量进行纤维化程度评分[5]。
1.3.3羟脯氨酸含量的测定 采用样本碱水解法,检测皮肤和肺的HYP含量,按照试剂盒说明书操作。
1.3.4荧光定量PCR法(rt-qPCR)检测MMP-2、MMP-9 mRNA的表达 取小鼠左肺上叶肺组织和背部皮肤各约80 mg,应用柱式法提取总RNA,应用oligo dT引物与random引物搭配进行逆转录制备cDNA。应用SYBR GreenI染料法进行荧光定量PCR检测,以β-actin 为内参照,各样本均设3个复孔。各引物序列:β-actin:上游5’-ATCCACGAAACTACCTTCAA-3’,下游:5’-CCAAATTGTATTGCAGATGTTCCAC-3’;MMP-2引物上游序列:5’TGGCACCACCGAGGACTATGAC3’,下 游:5’ACACCACACCTTGCCATCGTTG3’;MMP-9引物序列:上游:5’GGAGCACGGCAACGGAGAAG3’,下游:5’CCTGGTCATAGTTGGCTGTGGTG3’。将所得Ct值按照2-ΔΔCt的方法进行处理。
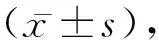
2 结 果
2.1小鼠模型皮肤、肺病理的作用 HE染色和Masson’s染色显示,对照组小鼠肺泡结构正常,无明显炎症细胞浸润,少量胶原沉积;模型组小鼠可见肺泡结构紊乱,大量炎症细胞浸润,肺泡、肺间质及支气管壁周围成纤维细胞增多并伴纤维组织增生,胶原明显增多;SSc组肺部炎症以及纤维化评分较对照组明显增加 (P<0.01)。HE染色和Masson染色显示 :SSc组小鼠皮肤组织学上基本正常,无明显炎症细胞浸润,少量胶原沉积;SSc组皮损处真皮层明显增厚,表皮萎缩,真皮层明显增厚,血管壁增厚、管腔狭窄,并伴有大量炎症细胞浸润,胶原纤维增多;SSc组皮肤厚度、炎症较对照组明显增加 (P<0.01)。见图1及图2。
2.2小鼠羟脯氨酸含量 与对照组相比,模型组皮肤和肺组中HYP含量明显增加(P<0.05)。见表1。
表1 小鼠皮肤、肺病理及羟脯氨酸含量
2.3小鼠皮肤、肺组织中的MMP-2、MMP-9 mRNA表达 与对照组比较,SSc组小鼠肺组织 MMP-9 mRNA 表达水平增加,(P<0.01),SSc组小鼠皮肤和肺MMP-2、皮肤MMP-9mRNA 表达水平增加(P<0.05)。见图3及图4。
3 讨 论
SSc是一种多系统纤维化的自身免疫性疾病。细胞损伤和细胞因子、生长因子及血管生成因子的异常持续产生导致组织修复失调。结缔组织稳态是细胞外基质(ECM)的合成和降解之间的平衡。器官组织中ECM成分的过度沉积会导致纤维化,从而破坏器官的功能[1],而ECM的降解主要受MMPs的调控。本研究结果显示,HE和Masson染色显示SSc小鼠皮肤和肺炎症及纤维化程度增加,胶原增多,皮肤增厚,HYP含量增加,这与我们的前期研究[6-7]结果一致。结果显示,SSc小鼠皮肤和肺组织中MMP-2、MMP-9 mRNA表达量升高。MMP-2和MMP-9的增加引起基底膜的破坏和成纤维细胞对肺泡的侵袭,从而有利于纤维的形成,MMP-2和MMP-9在特发性肺间质纤维化(IPF)患者中表达升高[8],这与本研究结果一致。提示MMP-2、MMP-9在SSc的纤维化发生发展起重要作用。伴有间质性肺疾病的SSc(SSc-ILD)患者与无ILD患者和健康对照组相比,支气管肺泡灌洗液中MMP-9的含量和活性均有所增加[9]。有研究[10]采用明胶酶谱法检测SSc小鼠肺组织MMP-9活性增加,但是MMP-2并没有增加,然而在皮肤组织中MMP-2、MMP-9活性增加。C.Meng等[11]研究表明,弥漫性系统性硬化病(dSSc)患者皮肤中MMP-9的表达明显低于正常组,然而MMP-9水平在局限性系统性硬化病(lSSc)患者皮肤的表达和正常组无明显差异。这些结果的差异,有待进一步研究探讨。
SSc的主要病理特征是纤维化。在研究[12]中,MMP-9的过表达导致减少的纤维化,在另一项研究[13]中认为它是促纤维化的,而研究[14]则认为它没有作用。就像许多MMPs一样,MMP-9在纤维化中作用的性质尚无定论。这些结果的差异部分可能是由于病理评估的时间造成的,纤维化过程始于损伤,炎症,修复和最终消退,后者在纤维化疾病中被破坏,有研究[15]认为,如果MMPs在疾病诱导的早期表达,它们具有促纤维化作用,但在疾病诱导的后期,它们具有抗纤维化作用。显然,评估MMP-9在纤维化中的免疫调节作用需要进一步深入研究。
MMP-2、MMP-9的表达增加,究竟是机体对博莱霉素的纤维化效应的防御反应,还是这种过表达与博莱霉素的纤维化效应有协同作用,目前尚不清楚。由于明胶酶功能的复杂性、调控机制的复杂性和动物研究的缺乏,MMP-2、MMP-9在SSc中的作用仍有许多未知之处,因此需要进一步的研究。
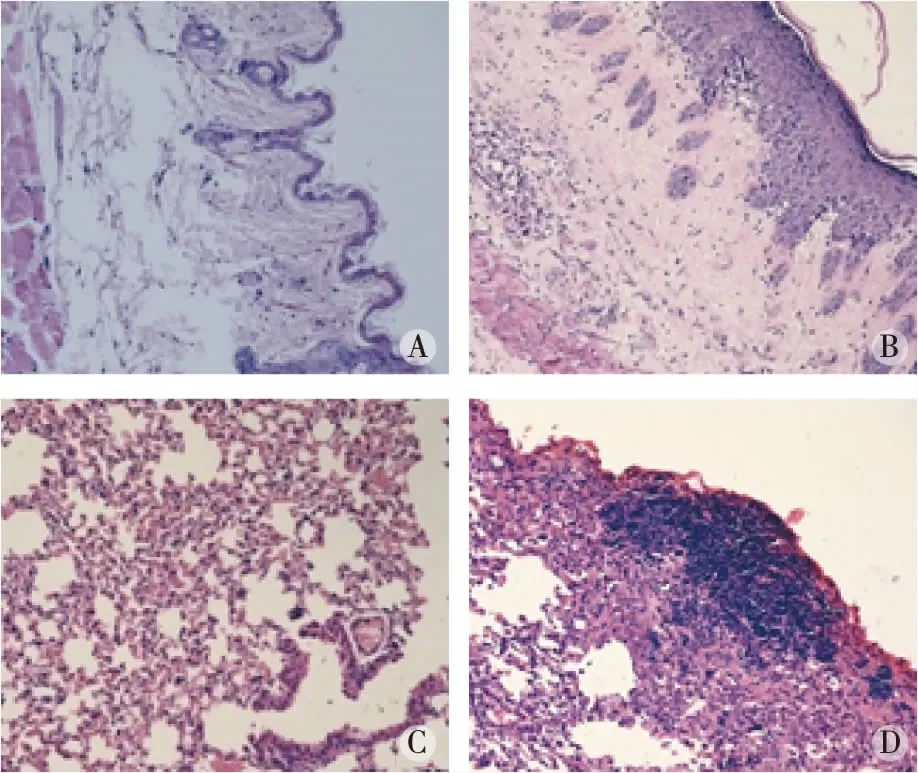
注:A、B分别为对照组、SSc组小鼠皮肤HE染色;C、D分别为对照组、SSc组小鼠肺HE染色。图1 小鼠皮肤、肺组织 HE 染色结果(×200)
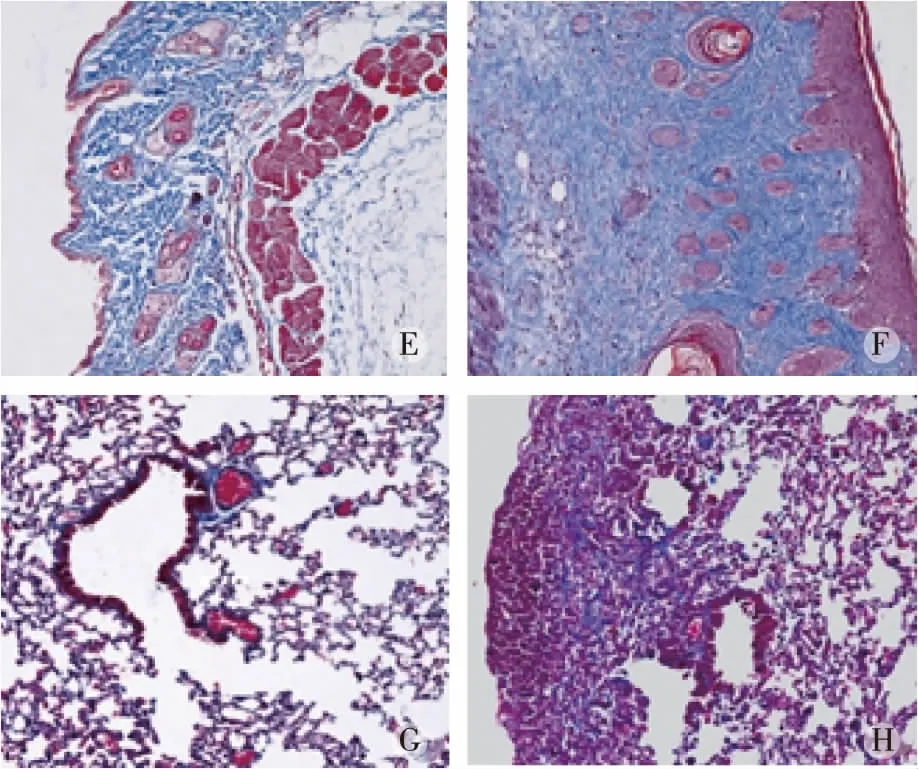
注:E、F分别为对照组、SSc组小鼠皮肤Masson染色;G、H分别为对照组、SSc组小鼠肺Masson’s染色。图2 小鼠皮肤、肺组织Masson染色结果(×200)
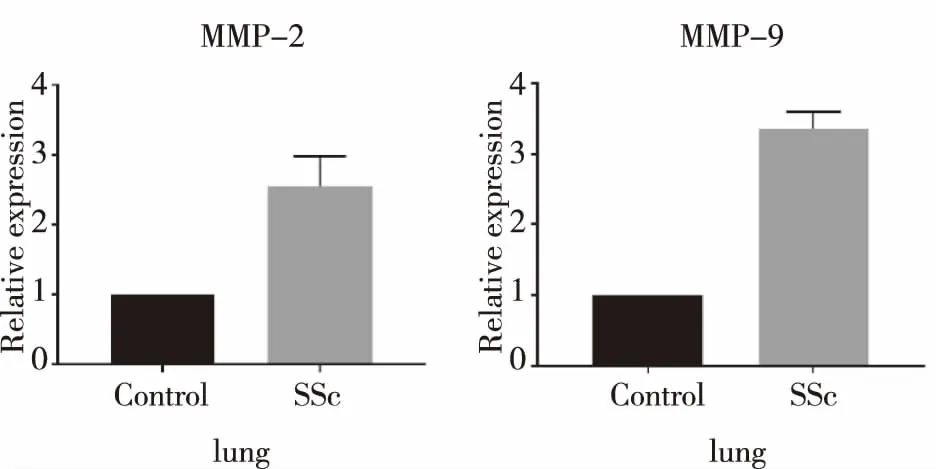
图3 两组小鼠肺MMP-2、MMP-9mRNA相对表达量
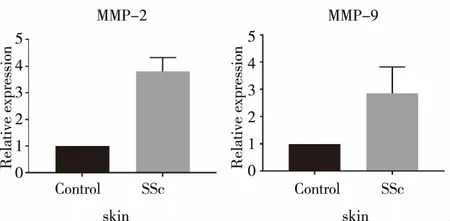
图4 两组小鼠皮肤MMP-2、MMP-9mRNA相对表达量



