蒲兴魏 欧阳北平 陆庭盛 姚书眈 崔松 罗春山
(贵州省骨科医院,贵州 贵阳 550002)
脊髓损伤(SCI)后继发的免疫及炎症反应是导致脊髓继发损伤的重要因素[1],其产生大量的促炎症介质如肿瘤坏死因子-α(TNF-α)、白介素(IL)-1β及IL-6等,能抑制神经功能的恢复,而TGF-β和IL-10等[1-3]抑炎因子具有强烈的炎症抑制活性,具有神经保护作用。卡介苗(BCG)是结核杆菌的减毒活疫苗,可诱导调节性T细胞(Treg)生成,可诱导机体产生免疫炎症反应,对机体具有免疫保护作用[8-9]。因此能否通过BCG诱导并调节机体自身免疫炎症反应,从而发挥对SCI的保护性作用,这对于SCI的早期治疗可能具有重要意义。本研究通过向SCI大鼠模型注射BCG,通过用BBB评分、HE染色及检测炎症因子变化情况以探究BCG对SCI的影响,为BCG在SCI中的应用提供基础。
1 材料与方法
1.1 实验动物及分组72只SPF级的健康成年SD大鼠(体重250~300 g),购自贵州医科大学动物实验中心,全部为雄性。随机分为假手术组、模型组和BCG治疗组,各24只。
1.2 主要试剂卡介苗佐剂(上海嘉楚生物工程有限公司);4%多聚甲醛(上海嘉楚生物工程有限公司);苏木素染液(ZLI-9610,中衫金桥);伊红染色液(G1100,Solarbio);TNF-α试剂盒、IL-1β试剂盒、IL-6试剂盒、IL-10试剂盒、TGF-β试剂盒(上海西唐生物科技有限公司)。
1.3 实验模型的制备参照Allen法制作大鼠脊髓损伤模型。用40 g/L戊巴比妥钠溶液按40 ms/kg行腹腔注射麻醉。固定四肢于手术台,定位T10棘突,剔除背部3 cm×4 cm大小周围毛发,3%络合碘消毒皮肤后,铺设洞巾,沿脊柱方向在T10水平开一长约3 cm切口,暴露背部肌肉、筋膜组织,剪开深筋膜,剥离棘突两侧肌肉显露椎板,假手术组仅去除T10椎板,显露硬膜囊大小约1 cm×0.6 cm,垫一塑料垫片,模型组和BCG治疗组用灭菌后自制的脊髓打击器—10 g重的打击杆自25 mm高度自由下落(打击杆底部直径2.5 mm),打击脊髓,观察大鼠尾巴和双下肢短暂抽搐,脊髓硬膜囊轻微肿胀,造模成功。大鼠术后麻醉清醒,模型组和BCG治疗组大鼠双后肢瘫痪,小便功能丧失,每日予以膀胱按摩并挤尿3次,直至恢复自主排尿功能。实验组大鼠于建立模型后30 min、24 h、48 h于大鼠腹腔注射BCG(105CFU),共3次,对照组大鼠腹腔注射等剂量生理盐水,注射时间同实验组,假手术组不给予干预措施。
1.4 术后大鼠后肢功能评价采用Basso,Beattie &Bresnahan locomotor rating scale-BBB评分系统。评定方法为将大鼠置于高7 cm、直径90 cm的平坦不滑的木板上,任其自由爬行,由两名熟知BBB评分的非实验人员观察记录,持续时间≥4 min,总分21分,0分表示无运动功能,21分表示运动功能正常,分别评分,取其平均值。在术后的第1、3、5、7、14天分别对各组进行BBB评分。
1.5 标本采集动物麻醉成功后。剖胸经左心室至主动脉插管,并以止血钳固定;剪开右心耳,见静脉血流出,当即从灌注针灌入PBS缓冲液约80 mL,待右心耳流出清澈液体后将灌注液体更换为4%多聚甲醛,多聚甲醛灌注速度为先快后慢,快速灌注50 mL后放慢速度,缓慢滴注维持即可,每只大鼠约需100 mL,持续灌注至大鼠四肢和全身肌肉不停抽动;将僵硬的大鼠俯卧至手术台,沿原切口打开皮肤及肌肉,见到原脊髓打击部位,去除椎管周围增生粘连组织,小心取出损伤中心上下长约1.5 cm脊髓组织,每组取16个脊髓标本予以制成脊髓匀浆,用于TNF-α、IL-1β、IL-6、TGF-β和IL-10检测;其余16个脊髓标本作HE染色用。
1.6 HE染色取出脊髓组织块用PBS反复冲洗后置于40 g/L多聚甲醛PBS(pH=7.4)中固定12 h后,梯度乙醇脱水、透明、包埋、修剪平齐后连续切片,制备3 μm组织切片、贴片、烤片,用于HE染色镜检。
1.7 免疫酶联法(ELISA)检测各组脊髓组织中炎症因子变化将所取脊髓组织放入匀浆器中,以0.1 g∶0.9 mL加入预冷的等渗盐水研磨制备脑组织匀浆液,匀浆后以800 r/min离心10 min,取上清液,为10%组织匀浆液,上清液中加入等体积三氯甲烷混匀后,以3 500 r/min离心15 min,取上清液分为3管,采用ELISA检测血清TNF-α、IL-1β、IL-6、TGF-β和IL-10水平,严格按TNF-α、IL-1β、IL-6、TGF-β和IL-10试剂盒说明书操作,匀浆中蛋白质含量用考马斯亮蓝法测定,最后标本TNF-α、IL-1β、IL-6、TGF-β和IL-10含量以ns/g蛋白质表示。
2 结 果
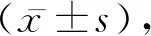
2.1 肢体功能行为学对术后两周内大鼠脊髓损伤后进行后肢运动评分,发现假手术组没有任何运动障碍,而模型组和BCG治疗组在术后均表现出后肢的瘫痪,BBB评分趋近于0,模型型组和BCG治疗组相比,前者评分显着低。见表1。
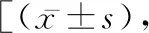
表1 不同分组实验动物术后的BBB评分比较分,n=24]
2.2 大鼠脊髓损伤的组织病理学变化通过HE染色观察大鼠脊髓损伤的组织病理学,结果显示假手术组无明显炎性细胞浸润、胶质细胞增生和细胞空泡变性;模型组可见大量细胞空泡变性和炎性细胞浸润,部分细胞核固缩;BCG治疗组可见炎症细胞减少、空洞较模型组减小,结构排列较完整。见图1。
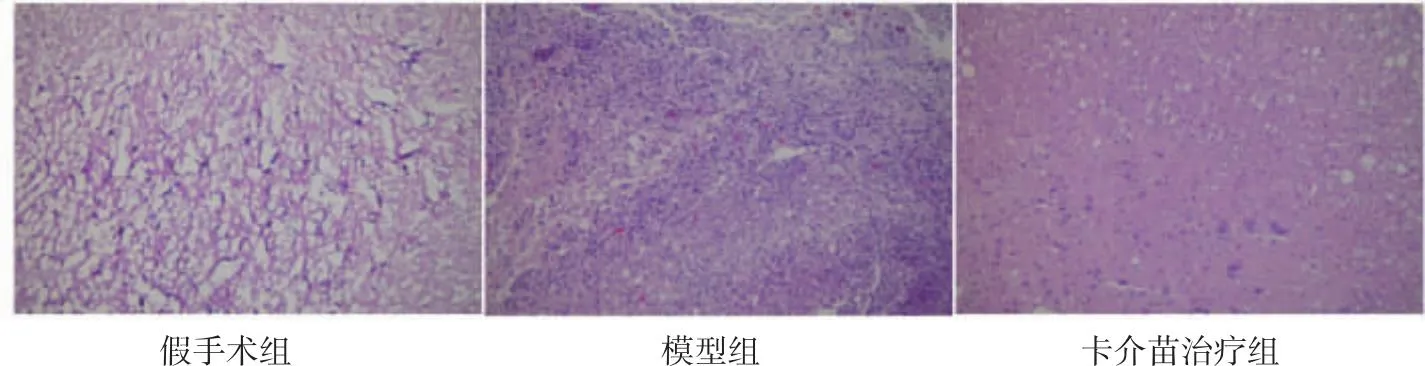
图1 HE染色观察大鼠脊髓损伤组织病理学变化(×400倍)
2.3 Elisa法检测脊髓损伤后炎症因子的表达模型组中TNF-α、IL-1β及IL-6含量高于BCG治疗组(P<0.05),TGF-β和IL-10含量低于卡介苗治疗组(P<0.05)。见表2。
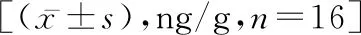
表2 各组脊髓组织中炎症因子含量比较
3 讨 论
SCI后经历了稳态被破坏、免疫炎症反应、再生及瘢痕形成和组织重塑四个阶段,免疫反应是损伤修复必经的一个病理生理过程,也是下一步组织再生的先决条件[6-7]。近些年的研究发现SCI后机体产生的免疫反应具有神经保护作用[8],主动或被动用脊髓自身抗原免疫提高动物脊髓损伤后自身免疫T细胞的数量和活性能明显增加损伤后神经元的存活和神经功能的恢复[9],调节性T细胞是一类自然产生的能控制体内自身免疫反应的T细胞亚群,对自身抗原有很高的亲和力,通过直接接触或分泌抗炎因子IL-10、TGF-β等抑制T细胞的增殖和活化[10]。相关研究表明[11-12],BCG具有非特异性免疫刺激作用,可诱导Treg生成,可诱导机体产生免疫反应,对机体具有免疫保护作用。
本研究结果显示,模型组和BCG组的促炎因子IL-1β、TNFα及IL-6均较假手术组升高,BCG组促炎因子较模型组有下降;在抑炎因子IL-10,TGFβ的表达上,模型组抑炎因子较假手术组升高,说明BCG具有免疫调节及抗炎作用,进而调节SCI后的免疫炎症反应。既往研究[3]表明,SCI后最早参与反应的是脊髓固有的小胶质细胞,活化的小胶质细胞形态由静息状态的高度分枝样变为阿米巴样,吞噬清理组织碎片,并分泌多种促炎因子,如IL-1β、TNFα、IL-6等,作用于血管内皮细胞、神经元和胶质细胞上的相应受体,刺激炎症介质的表达,募集外周血源性免疫细胞进入损伤区,同时启动并维持适应性免疫反应[13-14]。有学者研究发现SCI后给予TNF-α抑制剂或通过TNF-α的基因敲除可改善运动功能、减少细胞凋亡和组织损伤并降低与SCI有关的炎症反应[15];IL-10与其抗体结合对神经元产生保护作用[9,16-17];IL-6在创伤性中枢神经系统损伤中起重要作用,是SCI后急性和亚急性期最常见的促炎细胞因子之一[18];TGF-β细胞因子是有效的人类免疫调节剂,TGF-β信号传导可以将CD4+细胞转化为Treg ,早期应用TGF-β可拮抗TNF-α的促炎作用,减轻活化的单核巨噬细胞介导的继发性损伤[10]。研究[12]表明,BCG具有免疫调节及抗炎作用,调节炎症反应中免疫因子变化,抑制相关细胞免疫反应。本研究中,HE染色显示BCG治疗组炎症细胞较模型组减少、空洞较模型组减小,结构排列较模型组完整。术后大鼠后肢BBB评分结果也显示BCG治疗组优于模型组,充分说明BCG可能具有免疫调节及抗炎作用,进而对损伤的脊髓有保护作用。
综上所述,卡介苗可通过对调节性T细胞的表达,并进一步调节SCI后的炎症反应,可能在一定程度上对大鼠SCI具有保护作用。
利益冲突说明/Conflict of Intetests
所有作者声明不存在利益冲突。
伦理批准及知情同意/Ethics Approval and Patient Consent
本研究通过贵州省骨科医院伦理委员会批准(20220512),为动物实验,故知情同意免除。



