李加林,张嘉文,何凯伦,林建梭,吴素珍
(1.赣南医学院中药学教研室;2.赣南医学院2019级硕士研究生;3.赣南医学院2013级本科生;4.赣南医学院2014级本科生;5.赣南医学院生物化学与分子生物学教研室,江西赣州341000)
糖尿病的发病率在全球范围内有逐渐上升的趋势,根据国际糖尿病联盟(IDF)2019年的最新报告,目前全球糖尿病患者(20~79岁)约为4.63亿[1]。糖尿病是一种以血糖升高为特点的慢性代谢性疾病,糖尿病时伴有的长期高血糖将导致很多慢性并发症的产生,如糖尿病肾脏疾病(Diabetic kidney disease,DKD)、糖尿病眼病、糖尿病心血管疾病等,其中糖尿病肾病是糖尿病发展过程中出现的常见而难治的微血管并发症,是导致终末期肾脏疾病的主要因素[2-3]。
糖尿病是一种炎症性疾病,文献研究表明糖尿病时高血糖可诱导NF-κB信号通路的级联反应,产生大量的炎症介质如TNF-α、IL-6、IL-1β从而引起机体的炎症反应[4]。NF-κB信号系统是重要的炎症信号系统。NF-κB是一种在细胞浆中广泛表达的转录因子,p65-p50二聚体是其主要的存在形式。NF-κB通过与抑制性蛋白IκBα结合从而以无活性的形式存在于细胞浆中,外界因素导致IκBα磷酸化和泛素化,继而被降解,NF-κB脱离了IκBα的阻滞,可转位至细胞核,p65的核转位是NF-κB信号通路活化的重要标志[5]。
龙须藤(Bauhinia Championi)为豆科羊蹄甲属木质藤本植物,赣南地区分布广,资源丰富,赣南民间用来治疗炎症性疾病,如肠炎、风湿性关节炎等。文献报道龙须藤有抗炎、镇痛、抗感染、抗血小板凝集等作用[6-8],大量研究表明龙须藤乙醇提取物的乙酸乙酯萃取部位是龙须藤抗炎镇痛、治疗类风湿性关节炎的有效部位[9-10],但尚未见有龙须藤治疗糖尿病肾脏疾病的报道。
1 材料与方法
1.1 实验动物和试剂雄性SD大鼠,体质量为200~250 g,购于赣南医学院动物中心,动物许可证号SCXK(赣)2014-0001。龙须藤总黄酮(实验室自制,总黄酮含 量65.0%),SP试 剂 盒(Solarbio),p65抗 体(Abcam),RIPA裂解液(Solarbio),FITC标记的驴抗山羊IgG、DAPI(武汉赛维尔生物科技有限公司)。
1.2 实验方法
1.2.1 龙须藤总黄酮的提取取干燥粉碎的龙须藤茎,按药材与提取溶剂比例为1∶10(g·mL-1),加入10倍量70%乙醇,回流提取3次,每次2 h,合并提取液,抽滤,减压回收乙醇至无醇味,得到龙须藤的乙醇浸膏。将浸膏用水分散后用乙酸乙酯萃取。乙酸乙酯萃取液减压回收乙酸乙酯,得到乙酸乙酯萃取浸膏。取乙酸乙酯浸膏适量作为上样样品,进行硅胶柱层析分离。采用溶剂系统为二氯甲烷/乙酸乙酯(8∶1~4∶1),梯度洗脱,TLC跟踪分析,合并相同部位,得到龙须藤总黄酮。
1.2.2 动物模型的建立大鼠禁食不禁水12 h,然后腹腔注射55 mg·kg-1链脲佐菌素(STZ,Sigma Chemicals Co.,Ltd.,USA),STZ溶解在pH 4.2~4.5 的柠檬酸钠缓冲液中,正常对照组则注射等体积柠檬酸钠缓冲液,注射STZ 72 h后随机血糖>16.7 mmol·L-1则判断为糖尿病模型造模成功。然后将大鼠分为三组,对照组:非糖尿病大鼠灌胃等体积生理盐水;糖尿病(DM)组:糖尿病大鼠灌胃等体积生理盐水;龙须藤治疗组:糖尿病大鼠灌胃80 mg·kg-1龙须藤总黄酮。
1.2.3 免疫组化免疫组化采用SP试剂盒,包括:过氧化物酶阻断液(试剂A)、非免疫性动物血清(试剂B)、生物素标记的二抗(试剂C)、链亲和素-过氧化物酶溶液(试剂D);DAB试剂盒,包括:DAB缓冲液20×(试剂A)、DAB底物20×(试剂B)、DAB色原20×(试剂C)。免疫组化操作步骤如下:
(1)将石蜡切片置于二甲苯脱蜡2×10 min。(2)将切片浸于100%酒精、95%酒精、80%酒精、70%酒精进行梯度水化,再用0.01 M PBS漂洗3次。(3)切片放入0.01 M柠檬酸抗原修复液中,用微波进行抗原修复。(4)室温冷却后,0.01M PBS漂洗3次。(5)滴加“试剂A”,置于37℃湿盒中孵育10 min。(6)0.01 M PBS漂洗3次。(7)滴加“试剂B”,置于37℃湿盒中孵育10 min。(8)甩去多余“试剂B”,滴加一抗,置于湿盒中4℃孵育过夜,0.01 M PBS漂洗3次。(9)滴加“试剂C”,置于湿盒中37℃孵育15 min,0.01 M PBS漂洗3次。(10)滴加“试剂D”,置于湿盒中37℃孵育15 min,甩去多余液体。(11)滴加新配制的DAB显色液,光镜下控制反应时间,自来水充分冲洗以终止反应,苏木素复染,之后放入盐酸酒精分色,快速拿出,浸没时间在1~2 s内。配制DAB显色液:在小试管中先加入0.85 mL去离子水,再按试剂A、B、C顺序加入试剂各50μL,混匀即成1 mL DAB显色液,若有沉淀可过滤后使用,30 min内有效。(12)将切片顺序浸于70%酒精、80%酒精、95%酒精、100%酒精、二甲苯梯度脱水透明,中性树胶封片,于光镜下观察。
1.2.4 免疫荧光大鼠肾皮质经石蜡包埋后切片,经脱蜡、梯度酒精脱水后,进行抗原修复,然后用0.01 M PBS漂洗3次;2% BSA 37℃湿盒内封闭30 min;滴加适当稀释的特异性抗体,放在湿盒中,37℃孵育30 min,0.01 M PBS漂洗3次;FITC标记的二抗抗体37℃避光孵育30 min,0.01M PBS避光漂洗3次;DAPI染核,37℃孵育5~10 min,PBS漂洗3次;抗荧光淬灭剂封片后于荧光显微镜下观察,每个样本随机取3个视野拍片观察。
1.2.5 细胞核蛋白与细胞浆蛋白的分离及检测细胞核蛋白与细胞浆蛋白的提取与分离按试剂盒说明书操作。采用SDS-PAGE(SDS-polyacrylamide gel electrophoresis)分离样品中的蛋白成分。再将凝胶上的蛋白转印到0.45μm硝酸纤维素膜(NC膜)上,NC膜先进行封闭,与各自不同浓度的一抗进行孵育4℃过夜,洗涤后再与过氧化物酶标记的二抗室温孵育,再次洗涤,电化学发光(electrochemiluminescence,ECL)检测免疫印迹信号。
1.2.6 统计学分析采用SPSS 21.0软件进行分析,所有数据用均值±标准差(-x±s)表示,多组间比较采用单因素方差分析(ANOVA法),P<0.05为差异有统计学意义。
2 结果
2.1 免疫组化检测给予龙须藤总黄酮治疗后糖尿病大鼠肾脏中p65在胞浆与胞核中的分布情况首先建立STZ诱导的糖尿病大鼠动物模型,然后采用龙须藤总黄酮(80 mg·kg-1)灌胃糖尿病大鼠3个月后,收集大鼠肾皮质。用抗p65的抗体进行免疫组化与免疫荧光检测,结果显示给予龙须藤总黄酮治疗糖尿病大鼠3个月后,p65的核转位明显比糖尿病组少,这说明龙须藤总黄酮能够抑制糖尿病大鼠肾脏中NF-κB信号的激活,如图1所示。
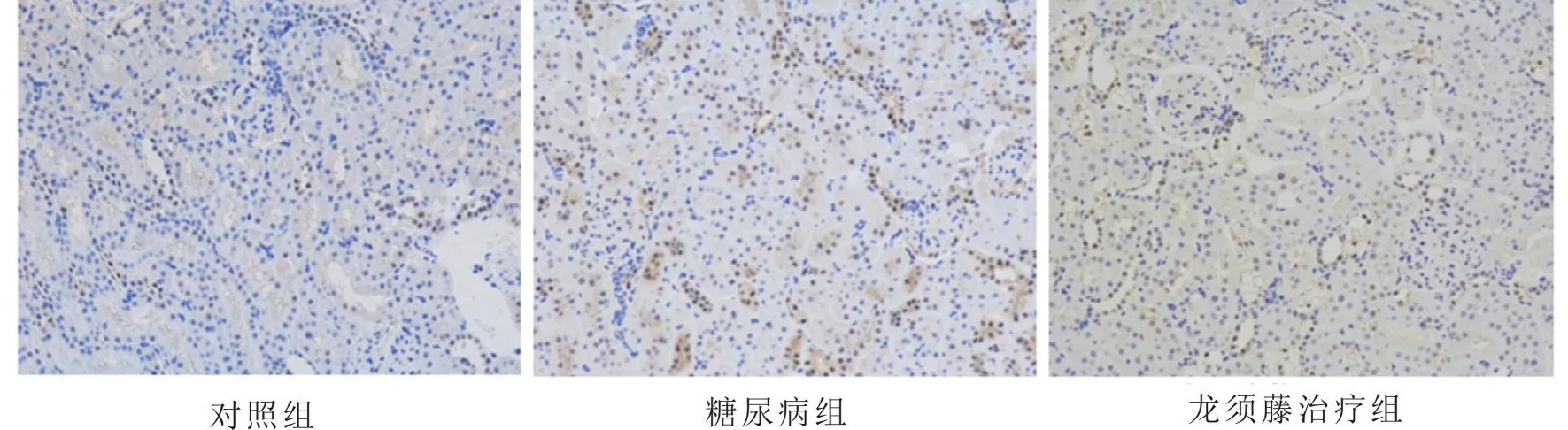
图1免疫组化检测给予龙须藤总黄酮治疗后糖尿病大鼠肾脏p65在胞浆与胞核中的分布情况(200×)
2.2 免疫荧光检测给予龙须藤总黄酮治疗后糖尿病大鼠肾脏中p65在胞浆与胞核中的分布情况建立STZ诱导的糖尿病模型,然后采用龙须藤总黄酮灌胃糖尿病大鼠3个月后,收集大鼠肾皮质。用FITC标记的二抗(绿色)识别p65抗体进行免疫荧光检测糖尿病大鼠肾皮质中p65在细胞浆与细胞核中的分布情况,用DAPI染细胞核(蓝色),结果发现糖尿病组大鼠肾皮质中被绿色荧光和蓝色荧光共同标记的细胞核明显比龙须藤总黄酮治疗组高,这表明龙须藤能够抑制糖尿病大鼠肾皮质中p65的核转位,对糖尿病大鼠肾脏中NF-κB信号通路具有抑制作用,结果如图2所示。
2.3 分离大鼠肾皮质,提取细胞浆蛋白和细胞核蛋白,免疫印迹检测p65在细胞浆与细胞核中的分布情况建立STZ诱导的糖尿病模型,然后采用龙须藤总黄酮灌胃糖尿病大鼠3个月后,收集大鼠肾皮质。然后按照试剂盒所述方法分离细胞浆蛋白和细胞核蛋白,采用Western blot的方法检测糖尿病大鼠肾皮质中p65在细胞浆与细胞核中的分布情况。结果表明,糖尿病组大鼠肾皮质中p65在胞核中的分布多于胞浆,而给予龙须藤总黄酮治疗后,p65在胞浆中的分布多于胞核(图3),这一结果再次证明了龙须藤总黄酮能够抑制STZ诱导的糖尿病大鼠肾脏中NF-κB信号通路的激活。
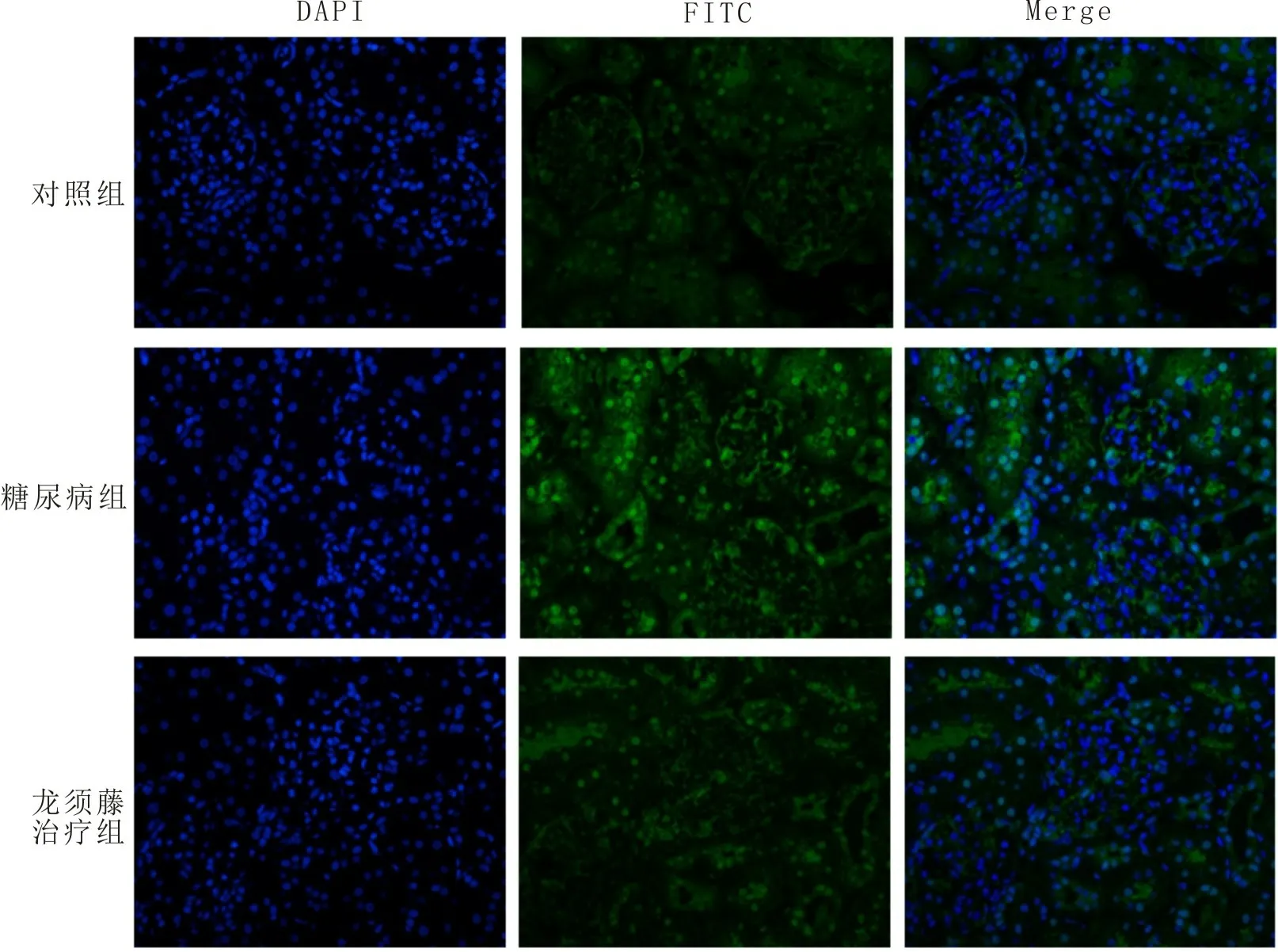
图2免疫荧光检测大鼠肾皮质中p65在细胞浆与细胞核中的分布情况(400×)
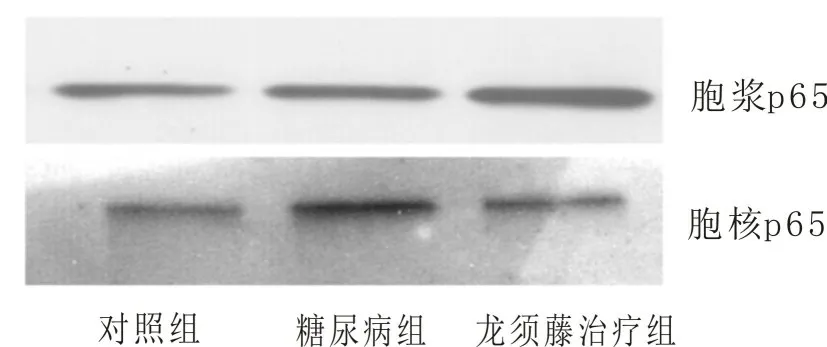
图3分离大鼠肾皮质,提取细胞浆蛋白和细胞核蛋白,免疫印迹检测p65在细胞浆与细胞核中的分布情况
3 讨论
糖尿病肾病是一种炎症性疾病,而抑制炎症反应可以有效延缓糖尿病肾病的进程。核因子-KappaB(Nuclear factor-KappaB,NF-κB)的活化在炎症反应起始及发展过程中起关键作用,在许多肾脏类疾病中NF-κB信号通路是激活的。有研究表明,NF-κB信号通路在糖尿病肾脏疾病的发展过程中起着不可忽视的作用。因此,通过调节糖尿病发生发展过程中的炎症信号通路来改善糖尿病肾脏疾病引起了科学家们的极大兴趣[11]。炎性细胞的浸润和炎性细胞因子如IL-6和TNF-α的分泌已被证明与糖尿病肾脏疾病有关[12-14]。
NF-κB信号系统是重要的炎症信号系统,NF-κB的过度激活会引起很多疾病。NF-κB是一种在细胞浆中广泛表达的转录因子,p65-p50二聚体是其主要的存在形式。NF-κB通过与抑制性蛋白IκBα结合从而以无活性的形式存在于细胞浆中,外界因素导致IκBα磷酸化和泛素化,继而被降解,NF-κB脱离了IκBα的阻滞,可转位至细胞核,p65的核转位是NF-κB信号通路活化的重要标志[15-17]。免疫组化和免疫荧光实验结果发现,糖尿病大鼠肾皮质细胞中发生了p65的核转位,而龙须藤治疗组p65的核转位与糖尿病组比明显减少,这说明糖尿病大鼠肾皮质中NF-κB信号通路是激活的,而龙须藤总黄酮能够抑制糖尿病大鼠肾皮质中NF-κB信号通路的激活。然而,龙须藤总黄酮毕竟是混合物,具体发挥作用的成分还不清楚,有待进一步研究。
4 结论
龙须藤总黄酮能够通过抑制糖尿病大鼠肾皮质中NF-κB信号通路的激活从而改善糖尿病肾脏疾病。



