郑海珍,陈彩飞
宫腔镜手术联合黄体酮冶疗子宫内膜息肉的临床效果分析
郑海珍,陈彩飞
目的评价子宫内膜息肉开展宫腔镜手术联合黄体酮治疗的疗效。方法收集子宫内膜息肉患者82例,利用随机数字表法进行分组,分别设为研究组和对照组,每组各41例。两组均行宫腔镜电切术,而研究组在此基础上给予黄体酮胶囊治疗。比较两组术前,术后第3、6、9个月末的子宫内膜厚度、子宫出血量及息肉复发率。结果两组在术前及术后3个月末的子宫内膜息肉差异差异无统计学意义(均>0.05);两组于术后3、6、9个月的子宫内膜厚度均小于术前厚度(均<0.05);术后6个月和9个月末,研究组子宫内膜息肉厚度均小于对照组(均<0.05)。两组患者术前子宫出血量差异无统计学意义(>0.05);两组术后3、6、9个月的子宫出血量均少于术前(均<0.05);术后第3、6、9个月末,研究组出血量均小于对照组(均<0.05)。研究组术后6个月复发1例,术后9个月复发1例,复发率为4.9%;对照组术后3个月复发2例,术后6个月复发2例,术后9个月复发3例,复发率为17.1%;研究组复发率低于对照组(<0.05)。结论子宫内膜息肉采取宫腔镜联合黄体酮治疗,能有效缩小子宫内膜厚度,减少子宫出血量,并降低近期息肉复发率,效果满意。
宫腔镜;黄体酮;子宫内膜息肉;复发率;出血量
子宫内膜息肉是妇产科常见病,该病好发于女性任何年龄段,主要由于体内雌激素水平升高,导致子宫内膜大量增生,引起月经淋漓不尽及月经紊乱,随着病情进展,极有可能发生恶性病变[1]。据文献报道,处于生育年龄阶段女性发生恶变概率达4.2%,而绝经后女性发生恶变概率高达10.1%[2]。随着医疗设备技术在临床上的普及,宫腔镜广泛应用于子宫内膜息肉的临床治疗,且取得了一定的临床成效。但亦有文献指明[3],该病经术后长期随访后,其复发率也呈现逐年攀升的趋势,根据其血生化指标检测,发现患者体内雌激素水平过高是该病复发的危险因素。因此,宫腔镜术后给予抗雌激素药物治疗对其预后具有极其重大的临床意义。黄体酮属于雌激素调节剂,是由卵巢黄体分泌的一种天然孕激素,在体内对雌激素激发过的子宫内膜有显着形态学影响[4]。本文旨在进一步了解宫腔镜联合黄体酮治疗子宫内膜息肉的临床成效,现将结果报道如下。
1 资料与方法
1.1 一般资料收集浙江省嵊州市人民医院于2010年4月至2013年10月收治的82例子宫内膜息肉患者,年龄24~68岁,平均(43.7±2.3)岁。所有患者入院当天均经常规白带、月经检查及宫颈刮
片活检,并联合临床症状体征,确诊为子宫内膜息肉,诊断标准参照文献[5]。纳入标准:患者不存在其他心、肝、肾等重要脏器疾患;不存在原发性或继发性痴呆;均同意接受宫腔镜治疗;对黄体酮不存在禁忌证;排除妊娠及哺乳期女性;术前3个月内未服用任何激素类药物;排除子宫功能性出血、子宫内膜癌及子宫肌瘤;不存在自身免疫系统性疾病;对本研究知悉并签署同意书。利用随机数字表法将82例患者分为研究组和对照组,每组各41例。其中对照组41例,平均年龄(42.5±2.1)岁;轻度为20例,中度为15例,重度为6例。研究组41例,平均年龄(44.9±2.5)岁;轻度为18例,中度为16例,重度为7例。两组年龄、病情方面差异均无统计学意义(均>0.05),具有可比性。
1.2 方法
1.2.1 对照组本组患者开展宫腔镜息肉切除术。患者在入院当天,由医护人员仔细询问患者既往病史,并行常规妇科检查,内容涉及血常规、尿常规、肝肾功能、动态心电图及白带常规检查,并逐一排除宫颈恶性病变及子宫内膜病变等易混淆疾病。手术时间应选择月经干净后5d进行展开。术前禁饮禁食,术前1 d晚将海藻棒于宫颈,麻醉选用硬麻外麻醉。手术操作:宫腔镜为可旋转持续灌流高级电切镜,以5%葡萄糖作为膨宫液,膨宫速度200~260 ml/min,切割电流功率80~100 W,电凝功率控制在60~70 W。患者取膀胱截石位,外阴常规消毒,将铺巾扩张宫颈至9~10mm,并将宫腔镜置入宫腔了解内部情况,并仔细查看子宫内膜息肉及蒂部。一旦发现息肉,医生应利用宫腔镜电击切除息肉基底部,切除深度应达蒂根下2~3 mm的浅肌层组织。术中,由巡回护士详细记录患者生命体征情况。术后禁食达4~6 h,患者神志恢复正常后,给予抗炎治疗2 d,并将切下组织送至病理科检查,证实为子宫内膜息肉。
1.2.2 研究组本组患者在对照组宫腔镜切除息肉的基础上,联合应用黄体酮胶囊(由浙江爱生药业有限公司生产,国药准字H20031099)治疗。研究组从术后第5天或下次月经来潮前15d给予黄体酮胶囊口服,用量为100mg/次,2次/d,10 d为1个疗程,连续服用3个疗效。
1.3 观察项目对两组患者术后均展开为期2个月的追踪随访,嘱患者分别于术后第3、6及9个月末来院复诊,检查项目包括子宫出血量、子宫内膜厚度及息肉复发率。
1.4 统计方法采取SPSS19.0统计软件进行统计学分析,计量资料以均数±标准差表示,采用检验;计数资料采用2检验。<0.05为差异有统计学意义。
2 结果
2.1 两组患者术前及术后各时间段子宫内膜厚度比较两组在术前及术后3个月末的子宫内膜息肉差异差异均无统计学意义(均>0.05);两组术后3、6、9个月的子宫内膜厚度均小于术前厚度(≥5.257,均<0.05);术后6个月和9个月末,研究组子宫内膜息肉厚度小于对照组(均<0.05)。见表1。
2.2 两组患者术前及术后子宫出血量比较两组患者术前子宫出血量差异无统计学意义(>0.05);两组于术后3、6、9个月的子宫出血量均少于术前(≥6.57,均<0.05);术后第3、6、9个月末,研究组出血量均小于对照组(均<0.05)。见表2。
2.3 两组患者子宫内膜息肉复发率比较研究组术后6个月复发1例,术后9个月复发1例,复发率为4.9%;对照组术后3个月复发2例,术后6个月复发2例,术后9个月复发3例,复发率为17.1%;研究组复发率低于对照组(2= 6.37,<0.05)。
3 讨论

表1 两组患者术前及术后各时间段子宫内膜厚度比较mm
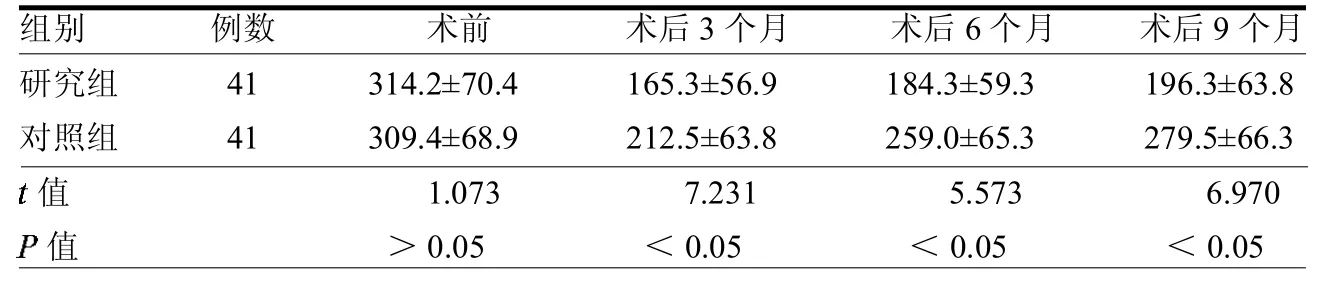
表2 两组患者术前及术后子宫出血量比较ml
子宫内膜息肉是临床上常见的女性疾患,该病不仅给患者的工作生活带来极大的困扰,更会会诱发焦虑、抑郁等消极情绪,严重降低患者的生活质量[6]。手术治疗是该病的主要治疗手段。宫腔镜电切术由于具有微创及安全性的临床优势,是当前应用最为广泛的治疗方式,但随着近年来宫腔镜检技术的提高,能够发现原先无法视察的微小息肉,导致复发检出率呈现升高趋势[7]。虽然宫腔镜电切术能有效切除息肉,但有关学者提出,由于子宫内膜不同部位雌激素水平存在显着差异,进而导致内膜不同部位的雌激素水平也有所差异,即对雌激素受体的效应会出现差异,引起局部内膜过度增生形成息肉[8];由此可见,息肉的发生发展与机体雌激素水平密切相关。因此,除了给予常规的电切术治疗外,重视患者雌激素水平的调理显得更有必要。黄体酮胶囊属于孕激素类药物,它能使处于增生状态的子宫内膜转化为分泌型,进而使增生的内膜逐渐脱落,起到抑制子宫内膜息肉复发效果。有研究将黄体酮应用于子宫内膜息肉术后可取得较为可观的临床成效[9]。
本文两组患者在术前子宫内膜厚度及子宫出血量差异均无统计学意义(均>0.05),经术后随访9个月内,两组在各个时间点内的子宫内膜厚度和子宫出血量均小于术前(均<0.05),这两组治疗方案在治疗子宫内膜息肉方面均有所成效,这与相关文献报道结果相似[10]。另外,研究组术后第6、9个月末的子宫内膜厚度和出血量均小于对照组(<0.05),这表明黄体酮胶囊配伍宫腔镜治疗的临床疗效优于单纯行宫腔镜治疗
组。宫腔镜治疗相较于传统的刮宫术,能使手术视野更加清晰,定位更为准确;具有创伤性更小、出血少、且手术时间短、术后预后康复快及患者耐受性良好等特点。然而,子宫内膜息肉虽能经电切术完全切除,但其易受雌激素刺激作用,导致内膜基底层出现局限性增生,诱发良性子宫内膜病变,进而出现子宫息肉,这也是为何电切术后患者易反复出现息肉复发的根本原因。黄体酮作为性激素调节剂,它能有效抑制血液中促卵泡素(FSH)和促黄体生成素(LH)水平,进而有效抑制雌激素生成,避免子宫内膜过度增生导致术后息肉复发[11]。本文显示研究组9个月内的息肉复发率明显低于对照组,差异有统计学意义(<0.05),但由于追踪随访时间较短,不足1年,尚不能充分确定两组之间远期复发率差异,需行远期追踪随访以进一步确定有关结论。
[1]魏勇.宫腔镜治疗复发性子宫内膜息肉2年随访疗效分析[J].中国医药导报, 2012,9(25):69-71.
[2]郭晓霞,李欢芝,曹韶娟.宫腔镜电切术联合黄体酮胶囊治疗子宫内膜息肉180例临床分析[J].中国社区医师,2012,24(14):37.
[3]郭凤莲.宫腔镜手术联合药物治疗子宫内膜息肉的疗效观察[J].中国医药指南, 2013,11(30):101-102.
[4]宫雪梅.宫腔镜电切术联合米非司酮对子宫内膜息肉的疗效分析[J].中国妇幼保健,2011,25(26):3974-3975.
[5]谢幸,苟文丽.妇产科学[M].北京:人民卫生出版社,2013:25-26.
[6]Lee S,Mun ST.Endometrial carcinoma development in anendometrialpolypwith early metaplastic bone formation in a young female patient[J].J Obstet Gynaecol, 2014,34(3):278-279.
[7]PatacchiolaF,DiStefanoL,DiFebboG,et al.Placental site trophoblastic tumor on endometrial polyp:a case report[J].Eur J Gynaecol Oncol,2014,35(1):87-90.
[8]Lasmar BP,Lasmar RB.Endometrial polyp size and polyp hyperplasia[J].Int J Gynaecol Obstet,2013,123(3):236-239.
[9]Chang-HalpennyCN,NatarajanS,Hwang-Graziano J.Early stage papillaryserous or clear cell carcinoma confined to or involvingan endometrial polyp:outcomes with and without adjuvant therapy[J].Gynecol Oncol,2013,131(3):598-603.
[10]Russell P,LynnhtunK,James D,et al.Endometrial polyp and endometriosis with atypical stromal cells[J].Pathology,2013, 45(2):191-193.
[11]Narin R,Nazik H,Aytan H,et al.A giant endometrial polyp in a postmenopausal woman[J].J Obstet Gynaecol Can,2013, 35(2):105.

10.3969/j.issn.1671-0800.2014.07.037
R711.74
A
1671-0800(2014)07-0849-03
312400浙江省嵊州,嵊州市人民医院
郑海珍,Email:12087200 94@qq.com



