沈观樵,金海勇,童海江
不同血细胞分析仪比对分析及偏差评估
沈观樵,金海勇,童海江
目的评价同一实验室不同血细胞分析仪检测结果的可比性和临床可接受性。方法按照NCCLSEP9-A2的文件要求,每天选取8例新鲜全血标本,共测定5 d。以Coulter LH750血细胞分析仪为参比仪器,Sysmex XE-2100、Mindray BC-5800仪器为比对仪器,对白细胞(WBC)、红细胞(RBC)、血红蛋白(Hb)、红细胞压积(Hct)、血小板(PLT)5个主要参数进行比较,根据美国临床实验室改进修正法案(CLIA`88)标准的1/2进行判断。结果与Coulter LH750比较,其他两台血细胞分析仪检测结果均与其有良好的相关性(>0.975),相对偏差均<1/2 CLIA`88的允许误差。结论3台血细胞分析仪主要参数的相对偏差为临床可接受范围,测定结果具有可比性。
血细胞分析仪;比对;偏倚(流行病学);质量控制
随着检验医学的发展和血常规标本量的日益增加,同一实验室配置多台血细胞分析仪的现象渐趋普遍。由于不同厂家血球分析仪使用各自的检测系统,检测原理和方法也不尽相同,使检测结果存在一定差异。虽然室内质控和室间质控在避免偶然误差和系统误差方面发挥重要作用,但是室内和室间质控却难以满足不同仪器之间的结果比对。为确保同一标本在本科室不同血细胞分析仪的检验结果准确性和可比性。按照NCCLS EP9-A2的文件要求[1]对3台血球分析仪的主要参数进行比对分析和偏差评估,确保实验室内测定结果的准确性和可比性,加强质量控制,现将结果报告如下。
1 资料与方法
1.1 一般资料选取浙江省绍兴第二医院患者当天EDTA-K2抗凝新鲜全血标本,要求室温放置时间<2 h,选择含有高、中、低浓度的标本。不选用含有小红细胞、红细胞碎片、巨大血小板、血小板聚集及高血脂等任何可能检测方法有干扰的标本。时间从2013年11月1—5日,共40个标本。
1.2 仪器与试剂美国CoulterLH750、日本Sysmex XE-2100、国产Mindray BC-5800血细胞分析仪各1台,3台仪器均选取原厂配套试剂、校正品、质控品。使用浙江康是公司EDTA-K2真空管。
1.3 方法按照美国临床化学标准化委员会(NCCLS)EP9-A2方案,每天选取8个高、中、低浓度的标本,同时用Coulter LH750、Sysmex XE-2100、Mindray BC-5800 3台血细胞分析仪按常规标本检测,标本排序按“1→8”顺序测定,再按“8→1”相反顺序重复测定,连续测试5 d。以参加省室间质量评价优秀的Coulter LH750血细胞分析仪为参比仪器,Sysmex XE-2100、Mindray BC-5800分别为比对仪器。过程中每次用原装配套质控品对试验数据进行监控。取白细胞(WBC)、红细胞(RBC)、血红蛋白(Hb)、红细胞压积(Hct)、血小板(PLT)5个项目,进行比对分析和偏差估计。
1.4 统计方法应用Excel软件先作方法内离群点检测,以4倍仪器内2次检测数据的平均绝对差为标准,再作方法间离群点检测,以4倍参比仪器与比较仪器的平均绝对差为标准,目测仪器内部离群点及仪器间离群点,如某个数据偏差超出相应平均偏差4倍时,从数据中删除,如出现两组或以上离群值,查找原因,并增加检测批次,使所有统计数据达到有效。应用SPSS 10.0统计软件进行处理,以参比仪器检测数据为轴,比对仪器检测数据为轴,作相关分析,计算回归方程=b+a,求相关系数()。按照EP9-A2文件规定,若≥0.975时即可将各个给定的医学决定水平浓度代入回归方程计算预期偏倚(SE=︱XCYC︱)和相对偏差(SE%=︱XC-YC︱/XC×100%),以美国临床实验室修正法规CLIA'88规定的相对偏差SE%小于CLIA'88规定的室间质量评价标准的1/2为临床可接受误差[2]。判断标准:WBC≤7.5%,RBC≤3%,Hb≤3.5%,HCT≤3.0%,PLT≤12.5%。
2 结果
2.1 离群值检验按照EP9-A2文件要求进行方法内和方法间离群值检查,本次试验WBC、RBC、Hb、HCT及PLT主要项目都无方法内和方法间离群值。
2.2 相关性比较XE-2100、BC-5800比对仪器与LH750参比仪器比较的五个主要项目参数均>0.975,说明所选标本浓度范围合适,见表1。
2.3 各项目在给定医学决定水平的相对偏差用回归方程以血细胞5个主要项目在医学决定水平处的数值计算相对偏差,以相对偏差SE%小于CLIA'88规定的室间质量评价标准的1/2为临床可接受误差。XE-2100和BC-5800的相对偏差均小于规定的允许误差。见表2。
3 讨论
血细胞分析是临床最常见的检测指标之一,由于不同的血球分析仪使用各自检测系统,采用的检测原理(电阻抗、光散射、高频波及细胞化学染色等技术)和试剂性质不尽相同[3],致使分析结果潜在不同程度差异,要保证不同血球分析
仪间同一检测项目结果具有可比行,除了完善的室内和室间质量检测体系,还需要建立合理的比对程序,使同一标本在不同仪器测定结果偏差控制在临床允许范围内,使测定结果在同一实验室具有可比性和连续性。
本科室的CoulterLH750血细胞分析仪进行配套原厂校准品校准,并连续参加省室间质评成绩优秀,其作为参比仪器[4]。即用可溯源的仪器CoulterLH750对本实验室其他血球分析仪Sysmex XE-2100、Mindray BC-5800进行比对。按照EP9-A2的文件要求,对血细胞分析的5个主要项目参数进行比对分析。3台仪器测试项目参数方法内和方法间均无离群点,说明3台仪器精密度比较恒定[5]。本文显示,LH750与其他2台仪器的五个测定项目结果相关密切(均>0.975)。说明X测定范围合理,回归方程的斜率和截距较为可靠,可以进一步在医学决定水平计算相对偏差。以相对偏差SE%小于CLIA'88规定的室间质量评价标准的1/2为临床可接受误差。本文还发现,5个主要参数的相对偏差均在临床可接受误差。实现了本实验不同血球分析仪检测系统中各项目结果的可比性[6]。
在检验仪器实现自动化的今天,同一标本在不同分析仪上的测定结果可能会产生临床不可接受的误差,因此实验室必须建立比对程序制度并定期进行比对[7],新鲜全血在同一实验室不同血细胞分析仪间的传递,实现了可溯源性,使各检测系统之间具有可比性。
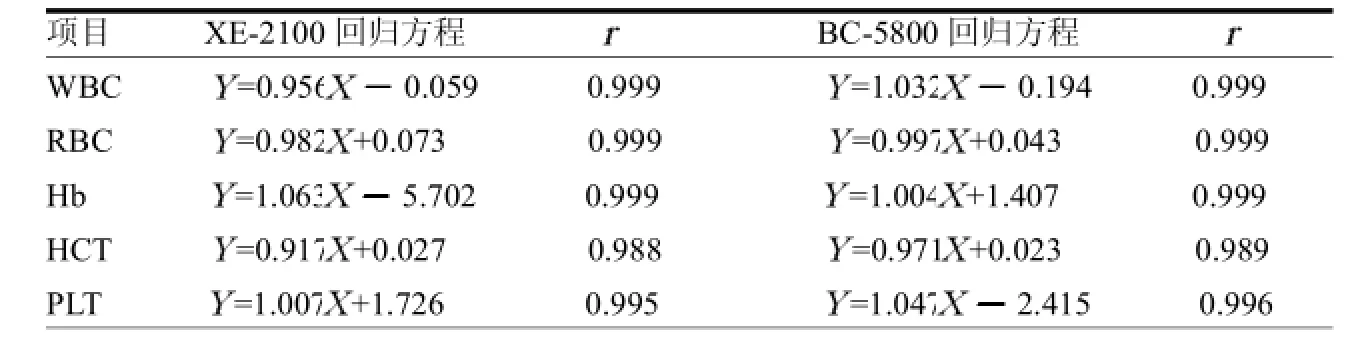
表1 两台比对仪器与LH750参比仪器的相关性比较
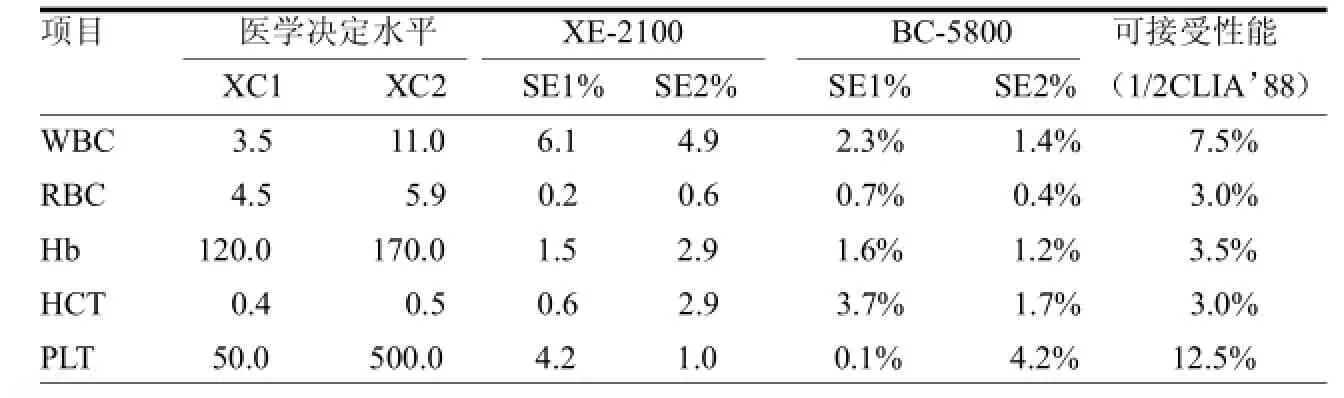
表2 两台比对仪器与LH750参比仪器各检测项目在医学决定水平处的相对偏差比较
[1]The National Committee for Clinical Laboratory Standards.Method comparison and bias estimation using patient sampale[S]. Approved Guideline,Second Edition, NCCLS,EP9-A2,2002.
[2]冯仁丰.临床检验质量管理技术基础[M]. 2版.上海:上海科学献出版社, 2007:185-203.
[3]李建华.新鲜血比对方法在血细胞分析仪中的应用[J].检验医学与临床,2011,10 (1):91-92.
[4]丰斌,毛菊珍,张莹,等.不同血细胞分析仪检测结果的可比性分析[J].中国血液流变学杂志,2012,22(3):549-550.
[5]张建萍.Sysmex不同系列血细胞分析仪比对分析及偏差评估[J].实验与检验医学,2011,29(6):623-624.
[6]周立军.血细胞检测结果的比对和临床可接受性的评价[J].实用临床医药杂志, 2012,16(22):121-123.
[7]陈丽芳,林淑仪,姚淑雯,等.多台血细胞分析仪检测结果可比性分析[J].广州医药, 2013,44(1):39-40.
10.3969/j.issn.1671-0800.2014.11.070
R446
A
1671-0800(2014)11-1448-02
312000浙江省绍兴,绍兴第二医院
童海江,Email:thjsxey@ 163.com



