王志锋,汪建华,马小龙,左长京
胰内异位副脾的CT诊断(附10例报告并文献复习)
王志锋,汪建华,马小龙,左长京
目的探讨胰内异位副脾(IPAS)的CT影像学特点,提高对本病的认识及诊断水平。方法收集10例经病理及随访证实的IPAS病例资料,结合文献分析其CT表现。结果10例IPAS均位于胰尾,5例呈类圆形,3例呈卵圆形,2例呈类三角形,最长径(2.5±0.8)cm,最短径(1.3±0.6)cm。平扫CT示10例IPAS密度均与主脾基本一致,9例副脾密度略高于胰腺,1例略低于胰腺。增强动脉期6例呈花斑状强化,4例呈均匀强化;门静脉期10例IPAS强化明显且趋向均匀;延迟期强化程度均逐渐下降。上述动态强化方式均与主脾基本一致。结论发现胰尾部边界清楚的类圆形或卵圆形结节,其CT平扫密度及各期增强表现与脾脏基本一致时,应考虑到胰腺异位副脾结节。
胰腺;副脾;体层摄影术,X线计算机
副脾是胚胎第5周时位于胃背系膜中的脾芽融合失败所致,位于正常脾脏之外,最常见于脾门,其次为胰尾[1]。胰内副脾(IPAS)为良性病变,临床上易与胰腺其它肿瘤相混淆[2]。患者多无特异性临床症状,常因体检或偶然发现。因其仅需随访复查,故影像学的准确诊断,可避免不必要的有创性检查及手术治疗[3]。目前,国内外文献有关IPAS影像学表现的报道以个案为多[3-5],本组收集10例I PAS患者完整的临床和影像资料,结合文献总结分析其CT表现特点,从而提高对本病的认识及诊断水平。现报道如下。
1 资料与方法
1.1 一般资料收集2008年7月至2015年2月宁波市中医院及宁波大学医学院附属医院共10例IPAS患者,男7例,女3例;年龄43~64岁;平均(54.5±6.3)岁;均无脾脏外伤及手术病史,未见血糖浓度和胰腺相关激素水平异常,肿瘤标志物CA-199、CA125、CEA均在正常范围内。2例患者因上腹痛行B超检查怀疑胰尾部肿瘤入院,余7例为体检或因腹部其他疾病检查时偶然发现,无明显阳性体征。本组3例经手术病理证实,7例经临床和影像随访12~40个月,根据病灶大小、形态密度等影像特征无明显改变而证实。
1.2 方法本组10例患者均行CT平扫加增强检查,检查前空腹4~6 h,至检查前20 min饮水1 000 ml充盈胃肠道。设备采用Brilliance16层螺旋CT机(飞利浦公司,荷兰),扫描参数:120kV,250 mA,重建层厚均5 mm,矩阵512×512,增强对比剂为碘海醇注射液(欧苏350 mg I/ml,扬子江药业公司),剂量1.5 ml/kg,注射速率2.5~3.0 ml/s,注射后28、60~70、120s扫描获取动脉期、门脉期和平衡期3期增强图像。
2 结果
2.1 IPAS的CT表现本组10例IPAS均位于胰尾,其中8例位于胰尾后部,边缘平直或向后缘膨出,2例占据胰尾大部,前后缘均轻度膨出;最长径1.2~3.5cm,平均(2.5±0.8)cm;最短径0.8~2.1cm,平均(1.3±0.6)cm;IPAS形态呈类圆形5例,卵圆形3例,类三角形2例。CT平扫示10例IPAS密度均匀,其CT值均与脾脏相近,9例副脾均稍高于胰腺(图1A、2A),1例副脾稍低于胰腺;三期增强扫描示10例病灶的强化方式均与主脾基本一致(图1、2);动脉期6例病灶呈花斑状强化(图1B),4例结节强化基本均匀(图2B);门脉期10例病灶强化趋于均匀(图1C、2C),此时病灶边界趋向清楚;延迟期结节强化程度均下降;与胰腺比较,除1例胰腺内副脾在增强各期强化程度与胰腺相近外,余9例在增强各期密度均高于胰腺(图1、2)。
2.2 组织病理学结果本组3例胰内副脾患者行胰尾肿瘤切除术,肿物呈暗红色,质脆,有完整纤维组织包膜,周围是正常胰腺组织包绕;镜检:胰腺组织内见脾组织,与正常脾脏结构相似,由红髓和白髓组成,异位副脾与胰腺组织分界明显,其间可见纤维组织包膜(图2D)。
3 讨论
副脾属于先天发育变异,系胚胎发育第5周时位于背侧胃系膜内胚胎脾芽的某部分融合失败所致,发生率为10%~30%[6-7];胰内副脾属于良性病变,一般无须手术。随着影像检查技术的发展和诊断能力的提高,CT检查越来越普及,已经成为体检和其它疾病系统性检查的常规手段。CT检查将可能发现越来越多的IPAS,术前的准确诊断可避免不必要的手术治疗。
分析本组病例并结合文献报道[1-10],IPAS的主要影像学特点主要有:(1)部位。IPAS多位于胰尾尖端3 cm以内[3],以胰腺背侧生长为主。(2)大小和形态。IPAS通常较小,一般大小为1~3 cm,病灶多呈类圆形或卵圆形,边界清晰,均为单发[9-10]。(3)密度。IPAS平扫CT密度大多与主脾一致,一般略高于胰腺实质,其主要原因是IPAS的组织结构、细胞成分与正常脾脏相似。(4)CT增强特征。CT动态增强表现为诊断IPAS的最重要依据。本组所有IPAS的CT动态强化模式与脾脏基本一致,这可能是由于异位脾组织供血动脉来自脾动脉分支有关[3]。与正常胰腺比较,大部分IPAS(90%)在增强各期的强化程度均高于周围胰腺实质,尤其是动脉期不均匀或花斑状强化具有特征性,这主要与血流通过红髓与白髓的速率不一致有关。本组4例病灶动脉期强化尚均匀,可能与病灶较小及动脉期延迟时间略偏长有关。总之,IPAS在增强动脉期呈花斑状强化以及动态增强方式与主脾基本一致对诊断具有重要意义。若胰尾肿瘤的强化模式与任一阶段的主脾不一致,则诊断IPAS的可能性不大。此外,少数肝硬化脾肿大、血液病等患者的异位脾组织在动脉期和胰实质期的强化程度可等或低于周围胰腺。当胰腺异位脾组织出现上述不典型影像表现时常误诊为胰腺肿瘤而行外科手术切除。(5)继发改变。IPAS较少继发其它疾病,少数可继发皮样囊肿、炎性假瘤等[11-12]。部分肝硬化患者,异位脾组织可继发肿大和含铁血黄素沉着,异位脾组织如出现继发病变,影像诊断无疑将更加困难。(6)IPAS患者脾门周围还可见其它副脾,脾组织植入腹腔其他部位者可见脾组织植入的表现。
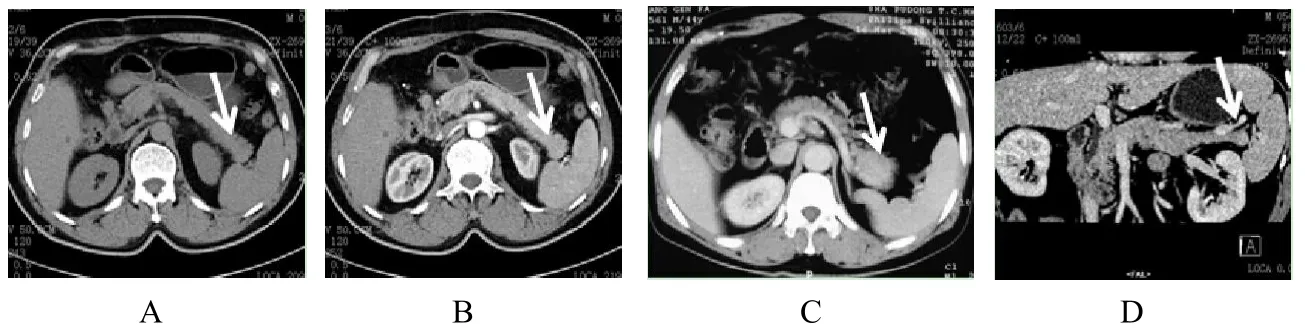
图1 胰内副脾的CT表现。A:平扫CT显示胰尾副脾(箭)密度稍高于胰腺;B:增强动脉期呈不均匀强化(箭);C:门静脉期副脾强化趋于均匀(箭),与胰腺强化程度差异明显;D:为门脉期曲面重建图,各期密度及强化程度始终与原位脾脏一致。
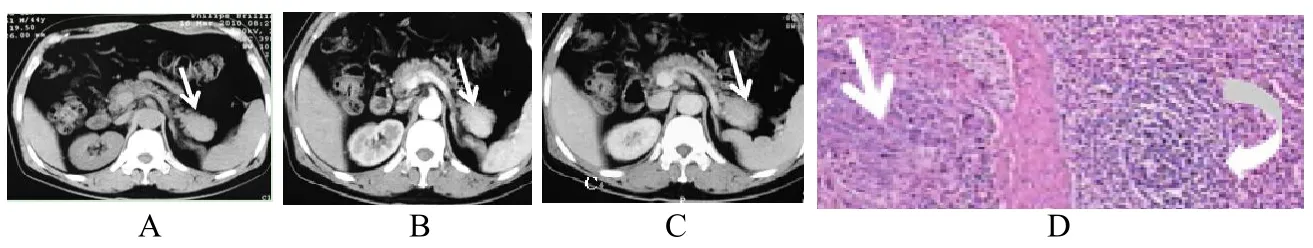
图2 A:CT平扫胰内副脾显示为胰腺尾部卵圆形结节(箭),边界清楚,向前后缘膨出,大小约3.6 cm×2.1 cm;B、C:动脉期及门脉期,病灶(箭)呈均匀明显强化,与脾脏一致;D:该肿瘤而行胰体尾+脾脏切除术,镜下病理示胰腺组织(箭)内见脾组织(弯箭),两者之间可见纤维组织分界
由于IPAS的影像征象与胰腺部分实性肿瘤表现相似,因此,影像学诊断IPAS时应与以下几种胰腺肿瘤进行鉴别:(1)胰腺实性假乳头状瘤,青年女性好发,一般体积较大,平均直径约9 cm,肿块内密度常不均匀,存在不同程度的出血、坏死或囊变,其实性部分动态增强呈渐进性强化,但各期强化程度均低于胰腺实质[12]。(2)胰岛细胞肿瘤,功能性的胰岛细胞瘤一般体积较小,动脉期强化十分显着,强化程度常显着高于脾脏,且该病患者常有明显激素分泌异常的相关临床表现。非功能性神经内分泌肿瘤常较大,常伴有囊变坏死。而IPAS常表现为体积小、密度均匀的结节[13],在动脉期常为不均匀或花斑状强化,动态增强各期密度及信号均与脾脏一致。(3)胰腺癌,好发于胰头,肿瘤为乏血供肿瘤,伴有明显的胰管扩张,结合增强扫描一般易鉴别。(4)胰腺转移瘤,胰腺转移瘤少见,乏血供转移瘤结合原发肿瘤病史及与相应原发肿瘤一致的影像特征可做出鉴别。胰腺富血供转移瘤多见于肾癌转移,Ng等[14]发现肾癌胰腺转移瘤三期动态增强扫描有一定特点,在增强动脉期与门脉期病灶强化明显,在延迟期病灶趋于等密度改变,再结合原发肿瘤病史大多可做出鉴别。(5)与其他病变的鉴别点关键在于,IPAS在增强动脉期呈花斑状强化,动态增强方式与脾脏基本一致。总之,IPAS属于少见先天变异,当CT检查发现胰尾部边界清楚的类圆形或卵圆形结节,其表现与脾脏基本一致时应考虑到本病,动态增强对IPAS诊断具有重要价值。
[1]Kim SH,Lee JM,Han JK,et al.Intrapancreatic accessory spleen:findings on MR Imaging,CT,US andscintigraphy,andthe pathologic analysis[J].Korean J Radiol,2008,9(2):162-174.
[2]Matthaei H,Schmelzle M,Braunstein S,et al.Pancreatic incidentalomas:a growing clinical challenge exemplified by an intrapancreatic accessory spleen[J].Wien KlinWochenschr,2011,123(5-6):186-188.
[3]汪建华,涂灿,王玉涛,等.胰腺异位副脾的CT与MRI检查特征[J].中华消化外科杂志,2014,13(4):310-314
[4]刘伟,吕国士,陈晓东,等.胰腺异位副脾一例[J].中国医师进修杂志,2014,37(35): 77-78.
[5]陈立斌,蒋天安.胰腺尾部内副脾内镜超声表现1例[J].中华超声影像学杂志,2013,22(3):189.
[6]Dodds WJ,Taylor AJ,Erickson SJ,et al. Radiologic imaging of splenic anomalies[J]. Am J Roentgenol,1990,155(4):805-810.
[7]Varga I,Galfiova P,Adamkov M,et al. Congenital anomalies of the spleen from an embryological point of view[J].Med Sci Monit,2009,15(12):269-276.
[8]Mortele KJ,Mortele B,Silverman SG. CT features of the accessoryspleen[J].Am J Roentgenol,2004,183(6):1653-1657.
[9]Low G,PanuA,MilloN,et al.Multimodality imaging of neoplastic and nonneoplastic solid lesions of the pancreas[J]. Radiographics,2011,31(4):993-1015.
[10]Hwang HS,Lee SS,Kim SC,et al.Intrapancreatic accessory spleen:clinicopathologic analysis of 12 cases[J].Pancreas,2011,40(6):956-965.
[11]Hu S,Zhu L,Song Q,et al.Epidermoid cyst in intrapancreatic accessory spleen: computed tomography findings and clinical manifestation[J].Abdom Imaging,2012,37(5):828-833.
[12]马小龙,汪建华,蒋慧,等.胰腺实性-假乳头状瘤的不同类型影像学表现与病理对照分析[J].中华医学杂志,2012,92(3): 170-174.
[13]Okura N,Mori K,Morishita Y,et al.Inflammatory pseudotumor of the intrapancreatic accessory spleen:computed tomography and magnetic resonance imaging findings[J].Jpn J Radiol,2012,30(2): 171-175.
[14]Ng CS,Loyer EM,1yer RB,et a1.Metastases to the pancreas from renal cell carcinoma:findings on three-phase contrastenhancement helical CT[J].Am J Roentgenol,1999,172(6):1555-1559.
10.3969/j.issn.1671-0800.2016.03.062
R816.5
A
1671-0800(2016)03-0399-03
2015-10-10
(本文编辑:陈志翔)
315010宁波,宁波市中医院(王志锋);宁波大学医学院附属医院(汪建华);第二军医大学附属长海医院(马小龙、左长京)
汪建华,Email:woxingw@ sina.com



