周海斌,金杭斌,谢璐,张筱凤,杨建锋
MUC3A在肝外胆管癌组织中的表达及临床意义
周海斌,金杭斌,谢璐,张筱凤,杨建锋
目的探讨黏蛋白3A(MUC3A)在肝外胆管癌(ECC)组织中的表达及其临床意义。方法收集手术切除的ECC癌组织标本35份(35例),以手术切缘阴性组织为正常组织标本20份(20例)。采用链霉素亲和生物素-过氧化物酶免疫组化方法(SP法)检测并对比MUC3A在胆管癌组织和正常胆管组织中的表达情况,同时收集35 例ECC患者的临床病理资料,分析MUC3A与临床病理特性之间的相关性。结果MUC3A在肿瘤组织癌巢中高表达,在肿瘤细胞的胞浆中显示出高信号,同时癌巢中的管腔内也可见到不同程度的免疫染色。MUC3A在ECC癌组织中的阳性表达率为85.7%,在正常胆管组织中的阳性表达率为35.0%,两者差异有统计学意义(<0.01)。胆管癌组织中MUC3A的表达与性别、年龄、肿瘤部位方面均无关(均>0.05);MUC3A在癌组织低分化或未分化、有淋巴结转移、有周围组织浸润、UICC分期Ⅲ~Ⅳ期中的阳性表达率均高于癌组织的中分化或高分化、无淋巴结转移、无周围组织浸润、UICC分期Ⅰ~Ⅱ期(均<0.05)。结论MUC3A在胆管癌组织中高表达,并与病理类型、淋巴结转移、肿瘤分期密切相关,MUC3A蛋白高表达提示ECC患者预后不良。
胆管肿瘤;肝外胆管癌;黏蛋白3A;临床病理;预后
胆管癌统指胆管系统衬覆上皮发生的一种恶性程度很高的肿瘤,按所发生的部位可分为肝内胆管癌和肝外胆管癌(ECC)两大类[1]。ECC对化疗、放疗等辅助性治疗普遍不敏感,手术切除肿瘤组织是唯一有效的治疗手段,然而,临床上超过2/3以上的患者明确诊断时已属于晚期而失去了手术根治的机会[1-2]。对于无法手术切除病灶的患者,其生存期通常只有6~9个月[3-4]。由此,寻找探索ECC发病以及恶化进展的相关因素及分子机制,对改善ECC患者预后及总体生存率具有重要意义。笔者前期通过抽取ECC患者胆汁进行差异蛋白质组学研究发现在ECC患者与正常人群胆汁中MUC3A表达具有明显的差异。为了更深入认识MUC3A与ECC之间的关系,笔者应用免疫组织化学方法检测在胆管癌组织中的表达情况,并分析与ECC临床病理特性的关系,现将结果报道如下。
1 资料与方法
1.1一般资料收集2012年1月至2014 年12月杭州市第一人民医院手术切除的ECC癌组织石蜡标本35份(35例患者),术前均未接受化疗或放疗等抗肿瘤治疗。其中男16例,女19例;年龄36~70岁,平均(52.6±8.9)岁。选择其中经病理学证实未发现肿瘤细胞浸润的阴性切缘标本作为正常胆管组织(20份,来自20例患者),其中男11例,女9例;年龄40~69岁,平均(58.5±9.5)岁。两组性别、年龄差异均无统计学意义(均>0.05)。
1.2研究方法采用免疫组化方法检测MUC3A在组织中的表达。(1)采用链霉素亲和生物素-过氧化物酶免疫组化方法(SP法)进行免疫组化染色,按照SP免疫组化试剂盒说明书所要求的步骤进行操作;采用双盲法、由两名高年资病理专业医师独立阅片,以已知阳性切片作阳性对照片,用PBS代替一抗作阴性对照。(2)主要实验试剂:MUC3A采用小鼠抗MUC3A抗体(LifeSpan Biosciences,美国)。(3)实验结果判断:采用半定量方法,依据阳性染色强度和阳性细胞所占百分比两个方面。其中染色强度评分标准为:细胞无着色记0分、细胞着色为浅黄色记1分、细胞着色为棕黄色记2分、细胞着色为棕褐色记3分;阳性细胞百分比评分标准为:细胞全部阴性记0分、阳性细胞比率<10%记1分、阳性细胞比率为11%~50%记2分、阳性细胞比率为51%~75%记3分、阳性细胞比率>75%记4分;然后将细胞染色强度的分值乘以阳性细胞比率的分值,依据所得数值的不同将免疫组化结果分为4个等级:0~2分记为―、3~4分记为+、6~8分记为2+、9~12分记为3+,其中0~2分定为阴性表达、3 ~12分定为阳性表达。
1.3统计方法采用SPSS 16.0统计软件包对实验数据进行统计学分析,率的比较采用2检验。<0.05为差异有统计学意义。
2 结果
2.1MUC3A在胆管癌组织和正常胆管组织中的表达MUC3A在肿瘤组织癌巢中高表达,在肿瘤细胞的胞浆中显示出高信号,同时癌巢中的管腔内也可见到不同程度的免疫染色。MUC3A在ECC癌组织中的阳性表达率为85.7%,在正常胆管组织中的阳性表达率为35.0%,两者差异有统计学意义(2=14.87,<0.01),见表1。
2.2ECC患者临床病理特征肿瘤位于肝门部13例、远端22例,分别占37.1%、62.9%;病理类型均为腺癌,其中高分化和中分化18例,低分化和未分化17例,分别占51.4%、48.6%;发生淋巴结转移者25例、无淋巴结转移者10例,分别占71.4%、28.6%;侵及周围组织器官者23例、未侵及周围组织器官12例,分别占65.7%、34.3%;UICC分期I~II期9例、III~Ⅳ期26例,分别占25.7%、74.3%。
2.3MUC3A的表达与胆管癌临床病理特征的关系以年龄60岁、肿瘤位于肝门或远端、组织分化程度是中分化和高分化或低分化和未分化、有或无淋巴结、有或无周围组织浸润、国际抗癌协会制定的胆管癌临床病理分期标准(即UICC分期)Ⅰ~Ⅱ或Ⅲ~Ⅳ为标准。胆管癌组织中MUC3A的表达与性别、年龄、肿瘤部位方面均无关(均>0.05);MUC3A在癌组织低分化或未分化、有淋巴结转移、有周围组织浸润、UICC分期Ⅲ~Ⅳ期中的阳性表达率均高于癌组织的中分化或高分化、无淋巴结转移、无周围组织浸润、UICC分期Ⅰ~Ⅱ期(均<0.05),见表2。
3 讨论
目前临床上对ECC的诊断主要依据“无痛性黄疸+胆管扩张+胆管肿物”的诊断模式,ECC早期诊断率不高,加上ECC恶性程度高,进展快,因此,超过2/3以上的患者明确诊断时已属肿瘤晚期[1-2]。本研究纳入的术前判断可行手术根治切除的35例患者中,术后发现有淋巴结转移、周围组织浸润、UICC分期Ⅲ~Ⅳ期分别高达到71.4%、65.7%、74.3%。因此,除提高早期诊断率外,有必要深入进行ECC恶化进展的相关因素及分子机制研究,为进一步提高临床治疗效果提供思路。
大量研究显示黏蛋白是许多恶性肿瘤的有效且可靠的预后判断指标,MUC3是黏蛋白的一种,位于染色体7q22上的黏蛋白簇,归类为膜相关黏蛋白,分为MUC3A和MUC3B两个亚型[5],以往MUC3A的研究多集中与胃肠道肿瘤,发现MUC3A的表达与胃癌、结肠癌的浸润深度、淋巴结转移和肿瘤分期密切相关[6-7]。Shibahara等[8]通过免疫组化检测阑尾腺癌组织MUC1、MUC2、MUC3、MUC4、MUC5AC、MUC6、MUC16和MUC17的表达,多元分析显示静脉浸润阳性、非治愈性切除和MUC3表达阳性是阑尾腺癌预后不佳的独立危险因素。

表1 MUC3A在胆管癌组织和正常胆管组织的表达例
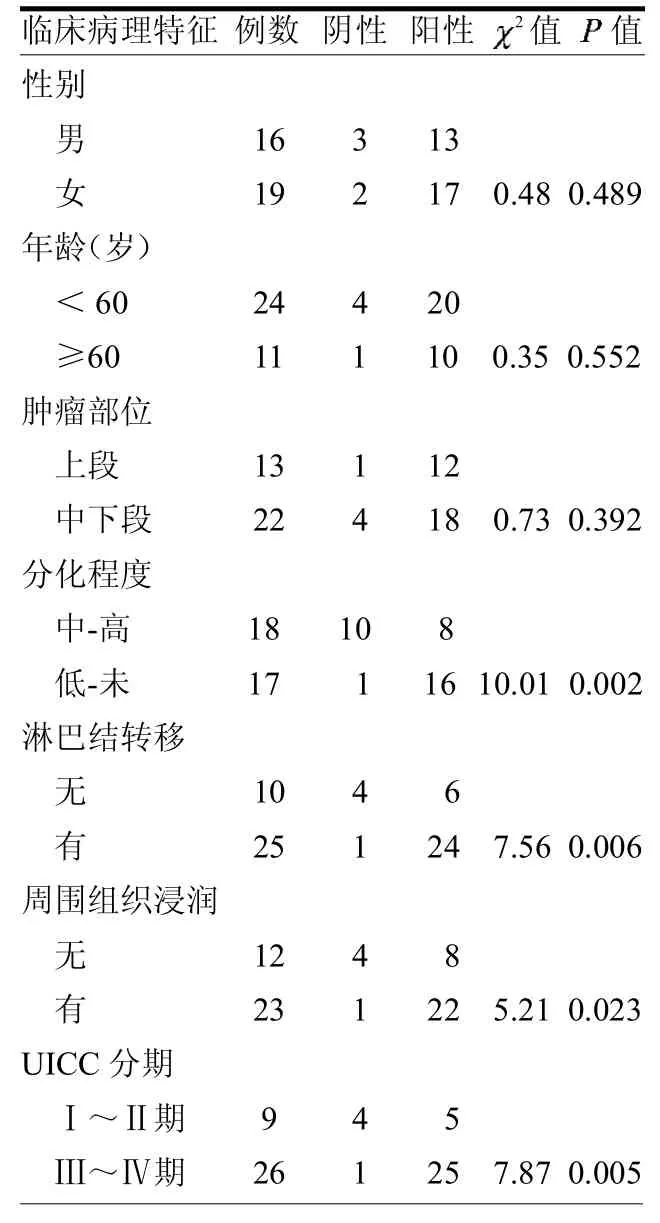
表2 MUC3A表达与胆管癌临床病理特征的关系例
有关MUC3A在肝胆管正常组织及胆管癌中表达的研究数量不多,且大多为国外研究。有研究显示肝胆管上皮细胞在出生之前主要表达MUC1,出生之后停止表达而转变为MUC3表达[9]。Sasaki等[10]报道在正常胆囊及肝内胆管组织黏蛋白基因主要表达MUC3;MUC3A在与肝硬化相关或合并肝细胞肝癌的胆管癌患者中表达是降低的[11];并通过分析19例肝门部和10例远端胆管癌发现,MUC3A的表达与肿瘤部位具有相关性,肝门部阳性率(68%)明显高于远端胆管癌(10%)[12]。但本研究结果未显示肝门部与远端胆管在MUC3A阳性率上的差异,推测MUC3A表达与肿瘤部位不具有相关性,这可能与纳入研究的人群、病理类型、分化程度及肿瘤分期等因素不同有关。
本研究结果显示MUC3A在ECC肿瘤组织癌巢中高表达,其阳性率明显高于癌旁正常组织,MUC3A在肿瘤细胞的胞浆中显示出高信号,同时癌巢中的管腔内也可见到不同程度的免疫染色,提示MUC3A可以被肿瘤细胞分泌至细胞外。MUC3A的阳性表达比例在肿瘤细胞分化低、有淋巴结转移、周围浸润和UICC分期在III~IV患者中明显升高,提示MUC3A与ECC病理类型、肿瘤分期密切相关,MUC3A的阳性表达可影响着ECC患者的预后,是预后不良的因素之一。
ECC组织学类型以腺癌最常见,本组35例患者均为腺癌。根据癌细胞分化程度将胆管癌划分为4个病理类型:高分化型、中分化、低分化及未分化型,不同组织学类型的胆管癌其发生机制和生物学行为有所不同。因样本量有限,本研究根据病理与预后的关系,将低分化及未分化型合并一组,中分化和高分化合并为一组,结果显示低分化及未分化组MUC3A阳性率明显高于中分化和高分化一组,提示MUC3A表达与ECC肿瘤细胞分化程度密切相关,MUC3A阳性率越高,肿瘤细胞分化程度越低,预后越差。与本研究结果不同,Mall等[13]通过对26例胆管癌组织标本进行黏蛋白免疫组化发现,仅6例(23.1%)患者MUC3呈强阳性表达,且MUC3在组织高分化中阳性表达率要明显高于低分化和中分化,这也可能与纳入研究的人群、肿瘤分期等因素不同有关。
手术切除是治疗胆管癌的首要方法,手术效果主要取决于肿瘤的部位和肿瘤浸润胆管的程度、手术无瘤切缘及是否有淋巴转移。UICC分期对于ECC治疗及预后判断具有重要的指导意义。本研究中将Ⅰ、Ⅱ期合并为一组,Ⅲ期和Ⅳ期合并为一组,Ⅲ期和Ⅳ期组MUC3A阳性表达率明显高于Ⅰ和Ⅱ期组,提示MUC3A阳性率与肿瘤分期密切相关,肿瘤分期越迟,MUC3A阳性表达率越高,提示预后越差。
综上所述,MUC3A在ECC肿瘤组织内高表达,并且该蛋白的表达状态与病理类型、肿瘤分期具有密切的相关性,MUC3A蛋白高表达预示着ECC患者不良的预后。笔者下一步将通过研究MUC3A对胆管癌细胞的生长、克隆增殖及细胞周期的影响,进一步探讨其在胆管癌发生和演进过程中的作用及可能分子机制。
[1]Razumilava N,Gores GJ.Cholangiocarc inoma[J].Lancet,2014,383(9935):2168-2179.
[2]GrootKB,FongY.Outcomesinbiliarymalignancy[J].JSurgOncol,2014,110(5):585-591.
[3]GattoM,Bragazzi MC,SemeraroR,et al. Cholangiocarcinoma:updateandfutureperspectives.[J]DigLiverDis,2010,42(4):253-260.
[4]Zografos GN,FarfarasA,Zagouri F,et al. Cholangiocarcinoma:principles and current trends[J].HepatobiliaryPancreat DisInt,2011,10(1):10-20.
[5]PrattWS,CrawleyS,HicksJ,etal.Multiple transcriptsofMUC3:evidencefortwogenes,MUC3AandMUC3B[J].BiochemBiophys Res Commun,2000,275(3):916-923.
[6]KitamotoS,YamadaN,YokoyamaS,et al. Promoter hypomethylation contributes to theexpressionofMUC3Aincancercells[J]. BiochemBiophys Res Commun,2010,397 (2):333-339.
[7]Cui J,Yin Y,Ma Q,et al.Comprehensive characterization of the genomic alterations inhumangastriccancer[J].IntJCancer,2015,137(1):86-95.
[8]ShibaharaH,Higashi M,YokoyamaS,et al. Acomprehensiveexpressionanalysisofmucinsinappendicealcarcinomainamulticenter study:MUC3is a novel prognosticfactor [J].PLoS One,2014,9(12):e115613.
[9]SasakiM,NakanumaY,TeradaT,etal.Biliary epithelialexpressionofMUC1,MUC2,MUC3 and MUC5/6 apomucins during intrahepatic bile duct development and maturation.An im munohistochemical study[J].Am J Pathol,1995,147(3):574-579.
[10]SasakiM,NakanumaY,KimYS.Expression ofapomucinsintheintrahepaticbiliarytreein hepatolithiasisdiffersfromthatinnormalliver andextrahepaticbiliaryobstruction[J].Hepatology,1998,27(1):54-61.
[11]SasakiM,NakanumaY,HoSB,etal.Cholangiocarcinomasarisingincirrhosisandcombined hepatocellular-cholangiocellular carcinomas share apomucin profiles[J].Am J Clin Pathol,1998,109(3):302-308.
[12]Sasaki M,Nakanuma Y,Kim YS.Characterization of apomucin expression in intra hepaticcholangiocarcinomas andtheirprecursor lesions:an immunohistochemical study[J].Hepatology,1996,24(5):1074-1078.
[13]Mall AS,Tyler MG,Ho SB,et al.The expression ofMUC mucin incholangiocarcinoma[J].PatholResPract,2010,206(12):805-809.
10.3969/j.issn.1671-0800.2016.08.033
R735.8
A
1671-0800(2016)08-1040-03
2016-05-04
(本文编辑:姜晓庆)
浙江省科技计划项目(2015C33251);浙江省医药卫生科技计划项目(2013KYB204)
310005杭州,浙江中医药大学附属杭州医院
杨建锋,Email:yjf-1976@163.com



