毛娟娟,宣浩军,俞星飞,杨红健
乳腺癌是女性常见的恶性肿瘤之一,目前已经跃居女性恶性肿瘤的首位[1]。研究表明,肥胖血脂异常与乳腺癌的发病和预后相关联[2]。同时很多研究文献也提示肿瘤标志物的重要性,认为乳腺癌的发病早期可以依据血清肿瘤标志物水平进行诊断[3]。本研究拟探讨不同乳腺癌病理及分子分型与肿瘤标志物及血脂水平的关系,报道如下。
1 资料与方法
1.1 一般资料 收集2020年1—12月浙江省肿瘤医院乳腺外科接受手术治疗的乳腺癌患者244例。纳入标准:(1)术后病理证实为乳腺癌;(2)有完整的临床病理分期及分子分型资料;(3)术前清晨空腹接受血脂指标[三酰甘油(TG)及血清总胆固醇(TC)]及肿瘤标志物水平[糖类抗原15-3(CA15-3)、糖类抗原125(CA125)、糖类抗原19-9(CA19-9)、癌胚抗原(CEA)、糖类抗原724(CA724)及细胞角蛋白19(CYFRA21-1)]检测。排除标准:(1)术前接受过化疗、放疗或内分泌治疗者;(2)长期服用降脂或降糖药物者;(3)有原发性高脂血症、甲状腺疾病、肾脏疾病和代谢综合征等影响血脂代谢的相关疾病者;(4)有其他恶性肿瘤病史者。
1.2 方法(1)肿瘤标志物及血脂水平的检测:入组患者的血清标本均采于术前,系患者空腹10 h以上于清晨采取。标本采集后立即送检,经全自动生化分析仪进行检测。CEA>5 ng/ml为阳性,CA125>35 U/ml为阳性,CA15-3>32.4 U/ml为阳性,CA19-9>37 U/ml为阳性,CA724>6.9 U/ml为阳性,胆固醇>6.1 mmol/L为阳性,TG>1.6 mmol/L为阳性。(2)乳腺癌病理及分子分型的确定:收集患者年龄、术前血脂及肿瘤标志物水平,术后收集患者的肿瘤大小(T)、淋巴结转移(N)、病理分期和分子分型特征,如雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(Her-2)及细胞增殖核抗原(Ki-67)。根据美国癌症联合委员会(AJCC)乳腺癌分期系统(7版),将患者分为I~IV期。参考中国抗癌协会乳腺癌诊治指南与规范(2019版)确定分子分型,ER、PR及Ki-67表达的判定值采用报告阳性细胞的百分比。以肿瘤细胞核阳性染色≥1%作为ER阳性的判定标准;以≥20%作为PR阳性的判定标准;以<15%、>30%作为Ki-67低高表达性的判定标准。Her-2检测结果(1+)判定为阴性,(3+)判定为阳性,(2+)患者进一步行原位杂交检测以确定阴性或阳性。分子分型为Luminal A型、Luminal B型(HER-2阴性)、Luminal B型(HER-2阳性)、Her-2阳性型(HR阴性)及三阴型。
1.3 统计方法 数据采用SPSS 21.0软件分析,采用spearman秩相关进行分析。P<0.05为差异有统计学意义。
2 结果
2.1 不同分子分型的乳腺癌与肿瘤标志物及血脂表达的关系 244例患者均为女性,其中Luminal A型41例(16.8%),Luminal B 型(HER-2阴性)98例(40.2%),Luminal B型(HER-2阳性)30例(12.3%),Her-2阳性型(HR阴性)48例(19.7%),三阴型27例(11.1%)。见表1。
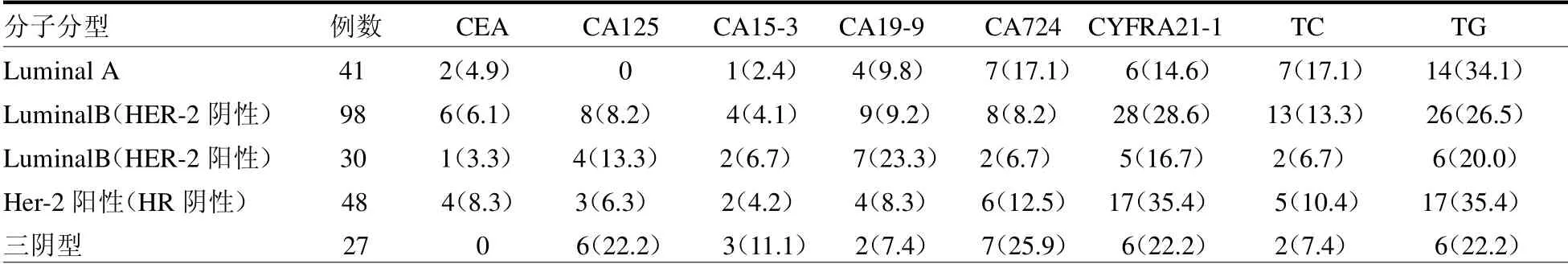
表1 不同分子分型的乳腺癌血清肿瘤标志及血脂分布情况 例(%)
2.2 不同病理分期的乳腺癌与肿瘤标志物及血脂表达的关系 病理分期为I期59例(24.2%),II期128例(52.5%),III期46例(18.9%),IV期11例(4.5%)。见表2。其中CYFRA21-1、CA125、CA15-3、CEA同病理分期呈正相关(r=0.228、0.314、0.234、0.232,均P<0.05)。
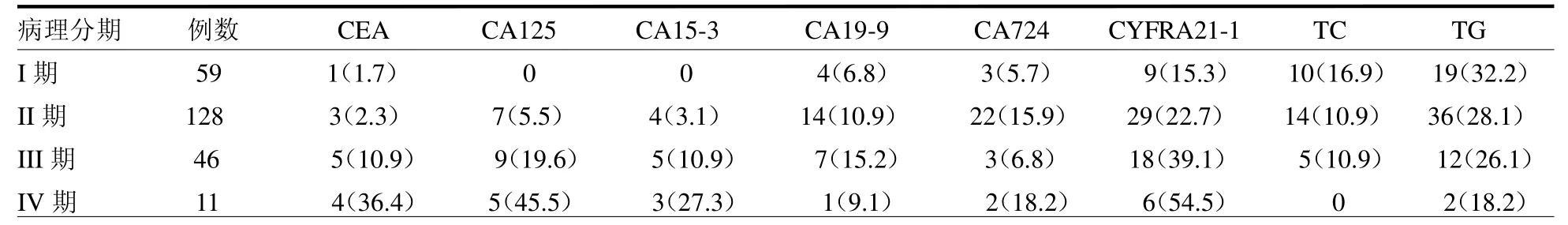
表2 不同病理分期的乳腺癌血清肿瘤标志及血脂分布情况 例(%)
3 讨论
血清肿瘤标志物检测是临床最常用的肿瘤诊断方法之一,CEA、CA125、CA15-3、CA19-9及CA724常用于乳腺癌的诊断,临床发现CYFRA21-1在乳腺癌患者中表达增高[4]。CEA是一种具有人类胚胎抗原特性的酸性糖蛋白,存在于内胚层细胞分化而来的癌症细胞表面,是细胞膜的结构蛋白。CEA是一种非特异性肿瘤标志物,临床上用于消化道恶性肿瘤,还可用于乳腺癌、胰腺癌及肺癌等的辅助诊断。CA15-3与CEA相比,特异性相似,联合应用时可使敏感性增加。CA125是一种卵巢相关抗原,在乳腺癌中的阳性率也有部分升高。CA19-9是一种胃肠道相关抗原,可检测胰腺癌、肝胆系癌、胃癌及结直肠癌等,该指标对胰腺癌较为敏感,也作为肿瘤的复发检测指标。CYFRA21-1与CEA联合应用,诊断非小细胞肺癌的符合率可达78%,在宫颈癌、膀胱癌及乳腺癌也有一定的阳性率。CA724是一种肿瘤相关的糖蛋白,同乳腺癌、胃癌及结直肠癌等相关。
本研究结果显示,分子分型中阳性率较高是CYFRA21-1,增高有62例(25.4%);CA15-3阳性率较低,增高有12例(4.9%);Luminal A型中血清CA724、CYFRA21-1及CA19-9阳性率高;LuminalB(HER-2阴性)中CYFRA21-1、CA724及CA19-9阳性率较高;Luminal B(HER-2阳性)中CYFRA21-1及CA19-9阳性率较高;Her-2型(HR阴性)中CYFRA21-1及CA724阳性率高;三阴型中CYFRA21-1、CA724及CA125阳性率高。本研究结果显示,在病理分期中,发现随着分期往后,肿瘤标志物升高比例上升。CYFRA21-1、CA125、CA15-3、CEA同病理分期呈正相关(r=0.228、0.314、0.234、0.232,均P<0.05)。I期中,有17例(28.8%)肿瘤标志物升高;II期中,有79例(61.7%)肿瘤标志物升高;III期中,有47例(102.2%)肿瘤标志物升高;IV期中,有21例(190.9%)肿瘤标志物升高。在每个肿瘤标志物分布上可以发现阳性率较高是还是CYFRA21-1,有62例(25.4%);CA15-3阳性率较低,有12例(4.9%)。说明肿瘤标志物在分期越后的乳腺癌患者中表达率越高[5]。
多项研究表明,血脂同乳腺癌的发病率存在部分相关性,脂肪组织能够分泌芳香化酶将雄烯二醇转化为雌二醇,同样的,过多的脂肪组织会增加女性体内芳香化酶的活性,进一步加强雌激素的转化。两者的结合能使肥胖患者体内的雌激素水平较正常人更高,而雌激素水平升高会刺激乳腺肿瘤细胞的生长与增殖[6]。本研究结果显示,244例患者中,29例(11.9%)患者TC水平超过正常值,69例(28.3%)TG水平超过正常值,提示控制血脂在乳腺癌的预防中具有重要意义。



