徐红余,姚麒
骨质疏松是以骨骼强度降低、骨折风险增加为特征的一类老年人常见的骨骼疾病。骨质疏松是临床病理性骨折的常见原因,也是影响人类健康的高危因素之一[1]。成骨细胞由骨髓间充质干细胞(BMSCs)分化而来,在骨形成中具有重要作用[2]。文献报道,miR-124-3p 在老年小鼠骨组织内明显上调[3]。有研究发现在人骨髓间充质干细胞(hBMSCs)的分化过程中miR-124 表达的改变可能影响hBMscs的生物学功能[4]。但miR-124-3p对BMSCs的生物学功能尚待深入。本研究主要探讨miR-124-3p 对BMSCs 细胞增殖、成骨分化的影响,并进一步研究其调控Wnt/ -catenin 信号的作用机制。报道如下。
1 资料与方法
1.1 材料
1.1.1 细胞株 BMSCs(人源)购自上海泽叶生物科技有限公司。
1.1.2 主要试剂 TrizolTM、LipofectamineTM2000 试剂(Invitrogen 公司);SYBR Green qPCR Mix、4×Reverse Transcription Master Mix(TaKaRa 公司);CCK8 试剂盒(上海碧云天生物技术有限公司);TransWell小室(上海子起生物科技有限公司);miR-124-3p 模拟物(miR-124-3p mimics)、阴性对照(mimics-NC)(上海吉玛公司);胎牛血清、DMEM 培养基(美国Gibco 公司);Wnt、-catenin 和cyclin D1 单克隆抗体、HRP标记山羊抗兔IgG 二抗(美国Abcam 公司);引物均由上海生工生物工程公司设计合成(其中miR-124-3p 引物序列:Forward:5’-GGGTATTGAG-GAAGGTGTT-3’;Reverse:5’-CAGTGCGTGTCGTGGAGT-3’;U6:Forward:5’-GCTCGCTTCGGCAGCACA-3’;Reverse:5’-AACGCTTCACGAATTTGCGT-3’)。
1.1.3 主要仪器 1658033 小型蛋白垂直电泳转印系统(武汉科昊佳生物科技有限公司),ABI 7500 荧光定量PCR 仪(美国ABI公司),美国SHELLAB 2406-2 CO2培养箱(美国SHELLAB 公司),CLARIOstar全功能多功能酶标仪(德国BMG LABTECH 公司),凝胶成像系统(美国Bio-Rad 公司)。
1.2 方法
1.2.1 细胞培养 将BMSCs 培养在含10%胎牛血清的RPMI-1640 培养基中,置于37℃、5%CO2的细胞培养箱中培养。
1.2.2 BMSCs的成骨分化 骨髓间充质干BMSCs铺板于6 孔细胞培养板生长至细胞密度为1×104个/孔,经含10%胎牛血清、50 mol/L 抗坏血酸、0.1 mol/L 二甲基亚砜(DMSO)和10 mmol/L -甘油磷酸酯的-MEM 诱导BMSCs 细胞向成骨细胞分化7 d。
1.2.3 细胞转染 分别设置miR-124-3p mimics 组与 miR-124-3p NC 组,待BMSCs细胞培养至对数生长期时,使用胰酶消化细胞,洗涤2 遍后应用完全培养基将细胞调至3.0×106个/ml,取200 l细胞液接种至corning6 孔板中培养24h。分别向3 个EP 管中加入5 l LipofectamineTM2000,5 l LipofectamineTM2000+5 l 阴性质粒miR-124-3pNC,5 l LipofectamineTM2000+5 l miR-124-3p mimics,室温静置5 min 后混合,加入不含血清的DMEM培养基调整终体积至2 ml,置于37℃、5%CO2、饱和湿度下培养6 h后,更换完全培养基继续培养,完成BMSCs细胞转染,并继续扩大培养以用于后续实验。
1.2.4 细胞内miR-124-3p的表达 细胞转染成功后,采用RT-qPCR 技术检测细胞内miR-124-3p的表达。收集细胞后,PBS 洗涤2 遍,离心取细胞沉淀,按照TrizolTMReagent 说明书提取BMSCs总RNA,依据4×Reverse Transcription Master Mix 试剂盒说明书将组织总RNA逆转录为总cDNA,按照SYBR Green qPCR Mix 试剂盒说明书操作,以cDNA为模板,进行荧光定量PCR 反应。反应条件:94 ℃2 min,94 ℃20 s,60 ℃30 s,共40 个循环。以U6 为内参,miR-124-3p基因的相对表达量以2-Ct表示。
1.2.5 细胞增殖水平 待转染后的BMSCs细胞生长至对数期时,使用胰酶消化细胞,并洗涤2遍,然后应用完全培养基将细胞调至3.0×103个/ml,每孔(96 孔板)接种100 l细胞液。分别培养24、48 及72h,加入配置好的CCK8试剂(10 l CCK8 试剂+90 l 完全培养基)孵育2 h,采用酶标仪检测450nm 波长处的吸光值(OD450)。
1.2.6 细胞克隆实验 两组细胞以200个/皿接种于60 mm的细胞培养皿(含10 ml 培养液)中,置37℃、5%CO2的培养箱中孵育,2 周后肉眼可见细胞克隆的形成。小心吸弃培养液,用PBS 洗涤2 次,将两组细胞以4%的多聚甲醛固定15 min,再用0.1%的结晶紫染色20 min,用清水清洗染液并风干,于荧光显微镜下随机选取5 个视野统计形成的细胞克隆数(>50 个克隆数为有效克隆)。
1.2.7 成骨分化相关因子测定 消化BMSCs 细胞后采用RT-qPCR 技术检测细胞内miR-124-3p的表达。收集细胞后,PBS 洗涤2 遍,离心取细胞沉淀,按照“1.2.4”项下RT-qPCR 方法测定碱性磷酸酶(ALP)、Runt 相关转录因2(RUNX2)、骨钙素(OCN)成骨分化相关因子基因表达水平。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,miR-124-3p 基因的相对表达量以2-Ct表示。各引物由上海生物工程股份有限公司合成,引物序列见表1。

表1 实时荧光定量PCR 引物序列
1.2.8 miR-124-3p 对BMSCs 细胞Wnt/-catenin 信号的调控作用 按照1∶10的比例加入放射免疫沉淀(RIPA)裂解液,按二辛喹酸(BCA)蛋白定量试剂盒说明书方法测定所提取的各组细胞的总蛋白含量,以确保每组样本之间的上样量相同。裂解、提取各组蛋白后,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)分离,转至硝酸纤维素(PVDF)膜,将转好的PVDF 膜于5% 脱脂奶粉溶液中室温封闭2 h,Tris-HCl 缓冲盐+Tween(TBST)洗涤液漂洗3~4 次。加入一抗,4℃孵育过夜。再漂洗3~4 次,加入辣根过氧化物酶(HRP)标记的二抗体,室温孵育2 h,漂洗3~4 次。化学发光检测底物电化学发光(ECL)工作液显色,采用Image J 图像分析系统对蛋白显影图进行灰度分析,以GAPDH 为内参,分析并比较两组Wingless/Integrated(Wnt)、-连环蛋白(-catenin)和细胞周期素D1(cyclin D1)蛋白相对表达水平。
1.3 统计方法 采用SPSS 19.0 统计软件进行分析,计量资料以均数±标准差表示,应用LSD-检验。<0.05 为差异有统计学意义。
2 结果
2.1 转染后BMSCs细胞miR-124-3p的表达及其对细胞增殖的影响 BMSCs细胞转染miR-124-3p 后,miR-124-3p 相对表达高于miR-124-3pNC 组(=9.512<0.05)。miR-124-3pmimics 组转染48h和72 h的OD450 值均低于miR-124-3p NC组(=14.781,17.247,均<0.05),见图1。
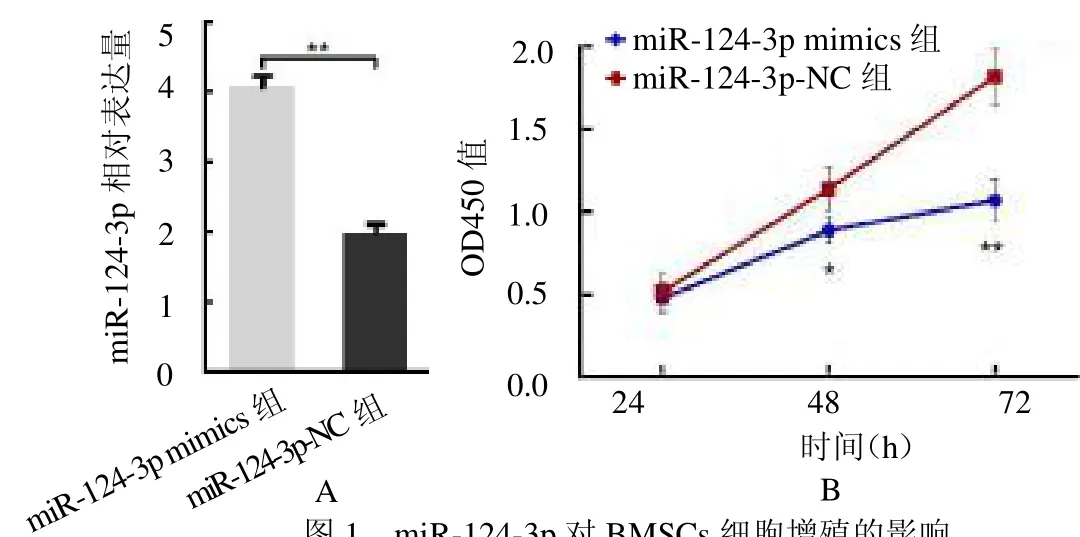
图1 miR-124-3p 对BMSCs 细胞增殖的影响
2.2 miR-124-3p 对BMSCs细胞克隆的影响 miR-124-3p mimics 组细胞克隆形成数为61.8±5.3,低于miR-124-3p NC组的142.7±18.2,差异有统计学意义(=19.743<0.05)。见图2。

图2 miR-124-3p 对BMSCs 细胞克隆的影响
2.3 miR-124-3p 对BMSCs细胞成骨分化相关因子表达的影响 miR-124-3p mimics 组ALP、RUNX2 和OCN 水平均低 于 miR-124-3p NC 组(=9.641、17.264、14.361,均<0.01)。见表2。

表2 转染后两组成骨分化相关因子水平比较
2.4 miR-124-3p 对BMSCs 细胞Wnt/-catenin 信号的影响 miR-124-3p mimics 组Wnt/ -catenin 信号中关键靶点Wnt、-catenin 和cyclin D1 蛋白相对表达均低于miR-124-3p NC 组(=9.517、18.204、7.353,均<0.01)。见图3。
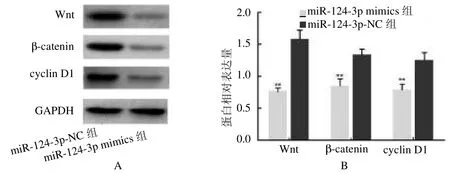
图3 miR-124-3p 对BMSCs 细胞Wnt/ -catenin 信号的影响
3 讨论
骨质疏松的发病率在超50 岁人群中逐渐升高,且女性发病率高于男性,发病后严重影响生活质量[5-6],故寻找新的药物靶点已成为近年的研究热点。miRNA 可通过调控BMSCs 细胞增殖、凋亡和成骨分化,在成骨过程中扮演重要角色,影响骨代谢,可作为其生物学特性、病因学的分子标志物[7-8]。
miR-124-3p在老年小鼠中表达上调,具有对hBMSCs向成骨细胞分化的负性调控作用[3]。但国内关于miR-124-3p 与成骨分化的发生发展及相关机制的研究较少。本研究显示miR-124-3p mimics组miR-124-3p 高表达;转染48 h 后,miR-124-3p mimics 组细胞增殖低于miR-124-3p NC组,细胞克隆形成数低于miR-124-3p NC 组。这提示miR-124-3p可抑制BMSCs 细胞增殖。研究指出,成骨细胞的分化过程同时受到一系列蛋白调节,如ALP、RUNX2、OCN[8-9]。与健康人相比,骨质疏松患者的ALP、RUNX2和OCN 等成骨相关因子通常较低。此外,RUNX2 在调节成骨细胞和软骨细胞分化中起关键作用[10]。故ALP、RUNX2 和OCN 可作为骨质疏松或成骨分化的生物标志物。本研究显示,miR-124-3pmimics 组ALP、RUNX2和OCN水平低于miR-124-3p NC 组,可见miR-124-3p 可抑制BMSCs的成骨分化,从而影响骨代谢过程。
目前,Wnt/ -catenin 是常见信号转导通路,参与控制多种生物现象。成骨细胞分化已被证实受Wnt/ -catenin 途径的调节。先前研究已经证明Wnt/ -catenin途径在骨质疏松的发病和进展中具有关键作用,也被认为是治疗骨质疏松的靶点[11]。而探讨成骨细胞分化过程中Wnt/ -catenin 经典信号与相关调节蛋白的相互关系较少[12]。本研究显示miR-124-3p mimics 组Wnt/ -catenin 信号中关键靶点Wnt、-catenin 和cyclin D1 蛋白相对表达均低于miR-124-3p NC组。这提示miR-124-3p 可抑制Wnt/ -catenin信号,从而阻止BMSCs向成骨分化。
综上所述,miR-124-3p 可阻碍BMSCs增殖,逆转成骨分化,可能与抑制Wnt/ -catenin 信号有关。为进一步研究miR-124-3p调控骨代谢的作用奠定基础,并为骨质疏松的基因靶点治疗提供参考。



