王玲玲,应亚君,张建民,林义
黏液炎性纤维母细胞性肉瘤(MIFS)是好发于肢端的纤维母细胞性肉瘤,较少见,因其好发于四肢肢端,称为肢端MIFS,但临床发现其不仅发生于肢端,亦发生于其他部位。本文对2例较罕见的非肢端MIFS进行分析,结合其临床相关资料及文献,复习MIFS 的临床病理特征、鉴别诊断及影像学表现特征,报道如下。
1 病例
病例1:患者男,72 岁,半年前因发现右侧背部肿块行肿块切除术,半年后术区又发生2 枚肿块并逐渐增大,突出皮肤,一枚质硬,边界模糊,活动度一般,无压痛,伴右肩部间歇性疼痛。影像学表现:CT 显示右侧肩背部皮下多发类囊状稍低密度影,边缘欠清,周围见渗出密度影,增强后不均匀强化,呈持续强化,见图1。B 超显示右侧背部皮下见两个低回声,其一大小78 mm×48 mm×16 mm,边界欠清,形态尚规则,内血流信号稍丰富;另一大小75 mm×52 mm×17 mm,边界欠清,形态欠规则,内见少许血流信号。病理巨检:(背部)组织一块,大小17 mm×9 mm×3 mm,切面灰白灰红,有光泽,多结节状,半透明黏液状,质中,未见明确包膜,肿块一侧覆皮肤13 cm×2 cm。镜检:肿瘤位于皮下,呈多结节状,与周围组织分界不清,侵犯皮下脂肪组织。低倍镜下肿瘤形成较明显的明暗分区,由黏液样变区、炎症区和玻璃样变区混合构成,并移行,无明显界限,见图2。高倍镜下不同区域细胞成分及特点如下:(1)黏液样区以淡蓝染的黏液样物质为背景,肿瘤细胞呈条索样,并见假脂母样细胞。炎症区肿瘤细胞呈多形性,以肌纤维母细胞样为主,胞质嗜酸,少数为大多角形或畸形大细胞、上皮样、类似节细胞样或病毒样细胞,细胞核仁清晰、明显;可易见双核细胞,类似于霍奇金淋巴瘤中的R-S 细胞;并有多核花环样杜顿细胞,偶见病理核分裂;间质可见急慢性炎症细胞弥漫浸润,以淋巴细胞和浆细胞为主,并形成生发中心;伴泡沫样组织细胞反应,局灶小血管增生和灶性红细胞外渗。透明变区肿瘤细胞异形性较小,呈片状分布伴玻璃样变,炎症细胞和黏液均少见。免疫组化:瘤细胞Vim(+)、Ki-67(+,5%~10%)、EMA 少量细胞(+)、Caldesmon 区域(+)、CD68(部分细胞+)。病理诊断:(背部)梭形细胞软组织肉瘤伴黏液变和炎细胞浸润,符合MIFS。
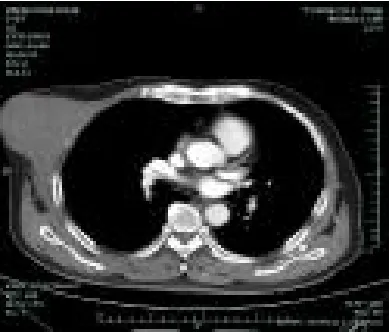
图1 肿瘤侵犯骨质

图2 移行区(HE 染色,×40)
病例2:患者男,75 岁,1 年半前无明显诱因下出现右胸壁肿物,约鸭蛋大小,于外院行手术切除,病理不详,后右胸壁肿块穿刺示急慢性炎伴组织细胞集聚和纤维组织增生和硬化,免组染色未有特异性。后肿块逐渐增大,行肿块切除。CT 显示右胸壁肿块术后复查,右前胸壁见软组织密度肿块,密度均匀,呈分叶状改变,周围脂肪间隙稍模糊,右侧第5 肋骨骨质破坏改变。B 超显示右胸壁皮下见低回声95 mm×68 mm,边界尚清,可见丰富的血流信号。病理巨检:(胸壁)梭皮一块:10.5 cm×6 cm×10 cm,皮下见一灰黄灰白结节:9.5 cm×8 cm×8.5 cm,质中,切面有光泽,区域呈半透明,与周围界线欠清;镜下表现同病例1;免疫组化:ALK 散在胞质(+)、CD68 弥漫(+)、S-100 散在(+)、CD138(+)、Vim(+)、desmin 灶弱(+)、Ki67(+,2%)、CD45(+)、EMA 灶性(+)、CD10(+)、CD68(+)、Calponin(+)。诊断:(胸壁)MIFS。
2 讨论
1998 年由Meis-Kindblom 等[1]和Montgomery等[2]首先报道了一组类似病变,并命名为含有病毒样或RS样细胞的肢端炎症性黏液透明样变肿瘤,因该病好发于四肢肢端,称为肢端MIFS。而近来发现更多非肢端部位的特殊病例。WHO(2002)将其纳入纤维母细胞/肌纤维母细胞类肿瘤中,命名为黏液炎症性纤维母细胞肉瘤[3]。在WHO(2013)[4]及WHO(2020)也将其归入交界性纤维母细胞性肿瘤,并定义MIFS 为一浸润性纤维母细胞性肿瘤,典型发生于肢体远端,其特征为有巨大核仁的多形性纤维母细胞位于黏液透明变背景中,伴不同程度的炎细胞浸润。
2.1 临床表现 MIFS 以成年人多见,偶见于未成年人,年龄17 ~83 岁,无明显性别差异。多数为缓慢生长的无痛性和界限不清的肢端肿块,手足背侧面多见,少数患者位于肘部膝部和腘窝,极少数发生于上臂、大腿、颈部头皮躯干(包括胸壁部及背部),病程长短不等,偶有外伤史,在肢体肿瘤常被临床认为是腱鞘囊肿和腱鞘滑膜炎。MRI 发现为非诊断性,但典型显示界限不清的肿块累及下方腱鞘。MIFS预后较好,少数患者可见复发或转移。
2.2 病理发现(1)巨检:MIFS 为多结节性,界不清,有广泛黏液变,切面有明显的胶样区,肿瘤直径1 ~8 cm,平均3 ~4 cm。(2)病理学特征:肿瘤常位于皮下,为多结节性,界不清,常累及下方腱鞘或邻近关节滑膜,有些患者累及真皮,其他的局灶浸润骨骼肌及骨质,倍镜下炎症区、黏液样区和透明变区[5]浸润程度不一;有些肿瘤主要由少细胞的黏液带组成,而有些仅局灶黏液改变,透明变区有少量炎细胞和瘤细胞稀疏混合,类似炎性肌纤维母细胞瘤的透明变区带,可明显含铁血黄素沉着,较富细胞的区带显示在黏液样或透明变间质中,有奇异的不典型细胞;肿瘤细胞有中度的核不典型性,常伴有空泡核、巨大核仁和突出的嗜酸性胞浆,类似病毒细胞或RS 细胞,尽管显着的核不典型性,但核分裂很少,典型者少于2/50HPF,神经节样细胞类似增生性筋膜炎中的细胞,多核巨细胞包括杜顿型,偶可见。此外,常有良性核特点,少量嗜双色胞浆的圆形单核细胞,坏死可罕见存在。高级别的细胞体现在细胞增多显着核异型,核分裂象活跃(>10/HPF)。2 例镜下形态较典型,肿瘤细胞弥漫表达Vimentin、CD68、灶性表达CK、SMA、Caldesmon、S-100,Ki-67 增殖指数不高。病例2 发生部位罕见,影像学检查提示存在骨质破坏,提示预后可能不良。
2.3 免疫表型 MIFS 无特异性免疫表型,诊断靠排除其他肿瘤,文献报道肿瘤细胞阳性表达vimentin、CD34、CD68、D2-40 和SMA,偶尔表达CK、S-100,不表达CD30[5]。
2.4 遗传学特点 早期报道MIFS 存在两种遗传学学说:t(l;10)基因易位和3pll-12 扩增[6]。Lambert 等学者首先发现其存在t(l;10)(P22;q24)基因易位[5]。Eclo 等[7]后报道MIFS 伴有3 号染色体扩增。后通过FISH 检测可检出TGFBR3 和MGEA5 的不平衡重排[8]。但这些遗传学特征不具特异性,后有新近报道提示可能有BRAF 基因扩增[9]。
2.5 鉴别诊断 肿瘤又有梭形瘤细胞、黏液样变和透明变区域,需与一些软组织肿瘤和瘤样病变鉴别。(1)结节性筋膜炎:是一种自限性疾病,多发生于青壮年,好发于上肢,位于前臂屈侧,极少发生于肢端,存在MYH9-USP6 融合基因,镜下表现病变主要纤维母/肌纤维母细胞组成,异型性小,核分裂象易见,可见黏液样变及红细胞外溢。(2)腱鞘巨细胞瘤:位于肢端,可有突出的炎性成分、多核巨细胞和含铁血黄素,腱鞘巨细胞瘤常为诊断考虑,但瘤细胞多为小的卵圆核细胞,其中树突细胞desmin 阳性。(3)黏液样纤维肉瘤:与黏液样纤维肉瘤鉴别最为困难,其可发生于任何部位,好发肢体的近端,极少位于手足部位,具有特征性的曲线形薄壁血管,一般无明显的炎性细胞区,看不到淋巴细胞聚集现象,无R-S样细胞或畸形大细胞。(4)炎性肌纤维母细胞瘤:与黏液炎性纤维母细胞肉瘤相重叠的组织学特点,但无肌纤维母细胞的超微结构和免疫组化特点,肢端不是炎性肌纤维母细胞肿瘤的好发部位,此外约50%的患者表达ALK,无TGFBR3 和MGEA5 基因重排。特别是发生在腹部者,应考虑一些良性和恶性黏液样病变,但良性黏液性病变中无R-S 样细胞。(5)霍奇金淋巴瘤:有R-S 样细胞亦提示霍奇金淋巴瘤的可能,霍奇金淋巴瘤的R-S 细胞表达CD15 和CD30,但MIFS 的特征性R-S 样细胞CD15 和CD30 阴性。(6)浅表性CD34 阳性纤维母细胞性肿瘤:位于真皮,有黏液变和畸形细胞,但梭形细胞密度较MIFS 高,且弥漫CD34阳性,无TGFBR3 和MGEA5 的不平衡重排。
2.6 治疗与预后 MIFS 为交界性肿瘤,易复发(与手术是否完整切除有关),可发生转移。MIFS 治疗以完全手术切除,切缘阴性是理想的治疗,远端病变需考虑截肢;术后密切随访并予以放疗,有助于局部控制。文献报道其不良预后因素有:肿瘤直径≥3cm、肿瘤细胞异形性及是否完整切除肿瘤[10]。本研究患者术后半年随访,患者均行术后放疗,目前尚未复发。
利益冲突 所有作者声明无利益冲突



