刘 霞,冯 婷,赵继敏,李 沛,黄幼田,杨洪艳,赵明耀,董子明
(郑州大学基础医学院病理生理教研室,河南 郑州 450052)
众多生物分子能引起正常细胞恶变,参与肿瘤细胞的浸润、转移、抗凋亡等重要的生物学过程。理解这些分子的作用及相互影响有助于提高肿瘤的诊断率和治疗率。柯萨奇-腺病毒受体(coxsackie and adenovirus receptor,CAR)因为腺病毒载体基因治疗的兴起而备受重视。研究表明,CAR不仅具有同种抗原黏附、白细胞游出、蛋白转运、细胞的生长调节等生理功能,而且在肿瘤发生和侵袭转移过程中也扮演着很重要的角色[1]。近年来研究表明,腺病毒作为溶瘤病毒或基因治疗的载体用于恶性肿瘤的治疗,其临床疗效在很大程度上受CAR的影响,上调CAR可以增强治疗效果。然而,肿瘤细胞中的CAR常常呈现低表达或者缺失,因此,人们尝试用各种方法提高肿瘤细胞表面CAR表达。Rauen等[2]研究表明细胞E-cadherin的表达情况与RAS激活细胞外信号调节激酶(ERK1/2)MAPK通路激活状态有关,而在临床肿瘤组织中CAR的表达模式又与E-cadherin的表达相似。在本研究中,作者用一定浓度的抑制剂抑制 Raf-M EK-ERK信号传导途径,观察食管癌EC9706细胞膜表面CAR的表达。
1 材料与方法
1.1 材料与试剂 人食管癌细胞EC9706由郑州大学病理生理教研室提供,RPMI-1640培养基购自美国 Hy Clone公司,胎牛血清购于杭州赛乐生物科技有限公司,胰蛋白酶购于美国Hykelone公司,RT-PCR试剂盒购自TaKaRa公司,总 RNA提取试剂T rizol购自Invitrogen公司,琼脂糖购自 BIO BASIC公司,兔抗人CAR单克隆抗体购自美国Santa Cruz公司,p44/42(137F5)ERK(1/2)兔抗人单抗购自美国,Cell Signaling Technology公司,FITC标记的羊抗兔 IgG(H+L)购自北京鼎国生物公司。
1.2 细胞培养及分组 将食管癌EC9706细胞置于RPMI-1640培养液(含10%胎牛血清,青霉素100 u/m L,链霉素100 u/m L)中37℃、5%CO2孵箱内贴壁培养,2~3 d传代一次,取对数生长期的细胞进行实验。待细胞汇合至80%时,更换新鲜培养基并分组。实验组分为10、20、40μmol/L单纯ERK抑制剂PD98059处理组,对照组为等体积的RPMI-1640培养基,作用24 h收集细胞。
1.3 免疫荧光检测EC9706细胞CA R表达 用磷酸盐缓冲液(phosphate buffered sodium,PBS)清洗长有细胞的盖玻片3次,轻轻吸去残余液体;室温用40 g/L多聚甲醛(溶于0.01 mol/L PBS,p H为 7.2~7.4)固定细胞 30 min,PBS冲洗细胞3次,每次5 min;用含 50 g/L牛血清清蛋白(bovine serum albumin,BSA)的封闭液封闭非特异性结合位点,室温静置30 min;用含50 g/L BSA的PBS稀释一抗,吸净盖玻片的液体,勿洗,将稀释后的一抗滴加至盖玻片上,湿盒中静置,4℃过夜,PBS代替一抗作阴性对照。PBS冲洗细胞 3次,每欠5 min;用含50 g/L BSA的PBS稀释FITC标记的二抗,滴加二抗稀释液至玻片上,室温避光孵育1 h,荧光下显微镜观察。以胞膜上出现绿色荧光颗粒为阳性细胞,应用 Biosens Digital Imaging System灰度扫描分析其阳性面积百分比及阳性区平均灰度,检测CAR的表达水平。
1.4 RT-PCR检测EC9706细胞CAR m RNA的表达 严格参照Trizol试剂盒说明书从分组并处理好的EC9706细胞中提取总 RNA。以随机六合引物1μL做逆转录引物,2μL RNA在AMV的作用下合成cDNA第一链,以逆转录产物3 μL做PCR模板进行检测。检测PCR表达的上游引物为TTC AGG TGC GAG ATG TTA,下游引物为 GAA TGA TTA C TG CCG ATG。PCR反应条件:95 ℃、30 s,54 ℃、30 s,74℃、1 min,30个循环,最后 72℃延伸 10 min。PCR产物各 2 μL在1.5%琼脂糖凝胶中电泳。凝胶成像仪扫描分析电泳结果,检测CAR m RNA的表达水平。
1.5 Western blot检测 EC9706细胞 CAR、ERK、p-ERK(1/2)的表达 参照《分子克隆实验指南》提取EC9706细胞总蛋白,测定浓度后,在标准蛋白曲线下算出50μg蛋白上样量,以β-actin为内参照,Western blot检测 EC9706细胞表面CAR、ERK、p-ERK(1/2)的表达。50μg上样量蛋白分别用 8%、12%SDS-聚丙烯酰胺凝胶进行垂直电泳分离后,“三明治法”转移至PVDF膜上,用含50 g/L BSA摇床封闭3 h,加入1∶1000 p44/42(137F5)MAP Kinase兔抗人一抗,4℃过夜。用TBS T洗涤3次后加入1∶5000稀释的二抗孵育1 h后,再用化学发光法进行X线胶片曝光显影,在完成对ERK的化学发光检测后将该膜在蒸馏水中漂洗5 min,加入适量的Western一抗、二抗去除液,漂洗5 min后加入1∶1000稀释的 p44/42(137F 5)ERK(1/2)兔抗人单抗,4℃孵育过夜,用 TBST洗涤3次后加入 1∶5000稀释的二抗孵育 1 h后,再用化学发光法进行X线胶片曝光显影进行p-ERK(1/2)检测,用同样方法将一抗换成兔抗人CAR单克隆抗体进行CAR检测,用Gel-Doc图像分析软件检测各条带的灰度值,将不同浓度处理组的灰度值与对照组灰度值进行比较分析。每组至少重复3次。
1.6 统计学方法 多样本均数采用单因素方差分析,S PSS10.0统计软件处理。以P<0.05为差异有统计学意义。
2 结 果
2.1 免疫荧光检测不同浓度处理组EC9706细胞CAR的表达 封2图 1显示,与对照组比较,10μmol/L PD98059组与对照组绿色荧光颗粒CAR蛋白的表达差异无统计学意义;而20、40μmol/L PD98059组绿色荧光颗粒CAR蛋白的表达明显增加,差异有统计学意义(P<0.05),随着抑制剂浓度的增加,绿色荧光颗粒CAR蛋白的表达明显增加,差异有统计学意义(P<0.05),并且随着抑制剂浓度的增加CAR蛋白的表达明显上调。
2.2 RT-PCR检测不同浓度处理组EC9706细胞CAR m RNA的表达 图2显示,与对照组比较,10μmol/L PD98059组CAR m RNA的表达差异无统计学意义,而20、40μmol/L PD98059组表达明显增加,差异有统计学意义(P<0.05),且随着抑制剂浓度的增加CAR m RNA的表达明显上调。
2.3 抑制ERK(1/2)的磷酸化引起EC9706细胞CAR蛋白表达上调 图3显示,与对照组比较,Western-blot检测 10 μmol/L PD98059组EC9706细胞p-ERK(1/2)和CAR蛋白的表达差异无统计学意义,但 20、40μmol/L PD98059组EC9706细胞p-ERK(1/2)表达明显下降,而CAR蛋白的表达显着提高,且随着抑制剂浓度的增加EC9706细胞p-ERK(1/2)的表达越发下降,而CAR蛋白的表达提高更加显着(P<0.05)。
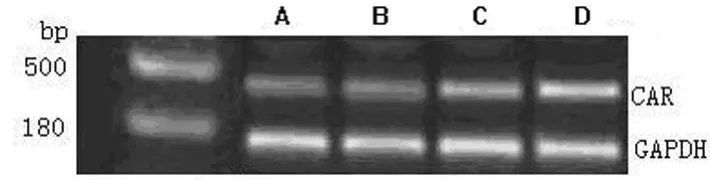
图2 RT-PCR检测PD98059作用于EC9706细胞后CAR的表达
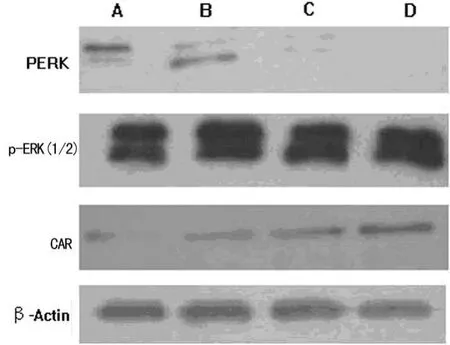
图3 Western-blot检测 PD98059作用于EC9706细胞后p-ERK(1/2)和CAR的表达
3 讨 论
随着基因治疗理论和技术的发展,腺病毒作为溶瘤病毒或基因治疗的载体已被广泛用于恶性肿瘤的治疗。复制选择性腺病毒(replication-selective adenoviruses)以其独特的优势成为肿瘤病毒治疗研究最为广泛的病毒之一。它是通过遗传工程改造使其能通过特异性在肿瘤细胞中复制、裂解肿瘤细胞、而对正常的细胞无杀伤力的溶瘤病毒。作为基因导入载体最常用的是Ad2和Ad5,而CAR是 Ad5和 Ad2的受体[3],它在不同组织来源肿瘤细胞中的表达水平很不相同,甚至在同一组织来源的肿瘤细胞中的表达也差异极大。尽管CAR真正的生物学功能还不十分清楚,但有关CAR表达的调节在以Ad载体为基础的基因治疗应用却非常广泛。基因治疗是通过替代有功能缺陷的关键基因或矫正缺陷基因,从而改变细胞的恶性表型以达到治疗疾病的目的,重组Ad载体具有转染效率高,携带外源基因容量大等优点,但许多研究表明腺病毒载体的感染效率受到靶细胞表面CAR蛋白表达水平的限制[4-8]。若细胞CAR的表达水平低于一定阈值时,腺病毒的转染能力就会受到影响,导致腺病毒基因治疗效果下降甚至无效。为解决这些缺陷,通过各种方法增强肿瘤细胞表面CAR的表达成为增加腺病毒感染效率的重要手段[9-12],找到有效调节CAR的方法,就可解决基因治疗过程中某些肿瘤组织Ad转导效率低下的难题。近年研究表明CA R表达的缺失至少部分是通过癌基因信号传导途径[13-15],蛋白 E-cadherin和 ZO-1的表达缺失可以通过抑制Ras激活ERK信号转导通路引起表达上调,而同样作为细胞黏附分子的CAR是否也能通过该通路的改变引起表达的上调呢?已报道Raf-MEK-ERK信号传导途径与许多病毒感染有关,病毒感染靶细胞可激活该信号传导途径;Raf-MEK-ERK信号传导途径活化后又可进一步促进病毒的复制增殖,调节细胞的增殖、分化和存活。作为多种生长因子(EGF、NGF、PDGF等)的下游蛋白,ERK 信号途径在肿瘤侵袭和转移过程中起中介和放大信号的作用,一方面接受大量来自生长因子、丝裂原、环境刺激等的信号,另一方面通过ERK信号级联反应作用于核转录因子如AP-1、NF-κB等,调控基因表达。许多受体Tyr蛋白激酶及与G蛋白耦联的细胞因子受体都可激活胞内Ser-Thr蛋白激酶,即MAPKs(mitogen-activated Protein kinases),而CAR胞内域也存在 Tyr磷酸化位点。因此,本文尝试通过抑制Raf-MEK-ERK信号传导途径来上调食管癌EC9706细胞CAR表达。总之,食管癌EC9706细胞表面CA R的表达可通过抑制Raf-MEK-ERK信号传导途径而上调,但具体抑制剂的浓度和抑制效果与细胞类型有关
[1]Bruning A,Runnebaum IB.The coxsackie adenovirus receptor inhibits cancer cell migration[J].Exp cell Res,2004,298(2):624.
[2]Rauen KA ,Sudilovsky D,Le JL,et al.Expression of the coxsackie adenovirus receptor in normal prostate and in primary and metastatic prostate carcinoma:potential relevance to genetherapy[J].Cancer Res,2002,62(13):133812.
[3]Douglas JI,Kim ,Sumerel LA ,et al.Efficient oncolysis by a replicating adenovirus(ad)in vivo is critically dependent on tumor expression of primary adreceptors[J].Cancer Res,2001,61(3):813.
[4]范良生,陈刚,马丁.柯萨奇-腺病毒受体在肿瘤发生发展机制中的研究进展[J].癌症,2009,28(3):333.
[5]M anabu Y ,Asami I,Kenji K ,etal.Expression of coxsackie and adenovirus receptor reduces the lung metastatic potential of murine tumor cells[J].Int J Cancer,2007 ,121:1690.
[6]Glasgow JN ,Bauerschmitz GJ,Curiel DT ,etal.T ransductionaland transcriptionaltargeting ofadenovirus for clinical applications[J].Curr Gene Ther,2004 ,4(1):1.
[7]Okegaw a T,Nutahara K,Pong RC ,et al.Enhanced transgene expression in urothelial cancer gene therapy with histone deacetylase inhibitor[J].J Urol,2005,174(2):747.
[8]Watanabe T ,Hioki M,Fujiwara T ,et al.Histone deacetylase inhibitor FR901228 enhances theantitumor effect of telomerase specific replication selective adenoviralagent OBP2301 in human lungcancercells[J].Exp Cell Res,2006,312(3):256.
[9]Krom YD,Gras JC ,Frants RR,et al.Efficienttargeting of adenoviral vectors to integrin positive vascular cells utilizing a CAR cyclicRGD linker protein[J].Biochem Biophys Res Commun,2005 ,338(2):847.
[10]吴赟,郑辉,陈宏新,等.CAR的表达调节对肝癌基因治疗中腺病毒载体感染效率的影响[J].中国肿瘤生物治疗杂志,2008,24(3):205.
[11]王仕忠,王勇,关乃富,等.肺癌细胞表面CAR表达水平与腺病毒转基因治疗的可能性研究[J].现代肿瘤医学,2008,17(6):947.
[12]Krasnykh V ,Dmitriev I,Navarro JG ,etal.Advanced generation adenoviral vectors possess augmented gene transfer efficiency based upon coxsackie adenovirus receptor independent cellular entry capacity[J].Cancer Res,2000,60(4):578.
[13]Hemminki A ,Kanerva A,Liu B ,et al.M odulation of Coxsackie-Adenovirus receptor expression for increased adenoviral transgene expression[J].Cancer Res,2003,63:847.
[14]Anders M ,Christian C,McMahon M ,et al.Inhibition of the Raf/MEK/ERK pathway up-regulates expression of the coxsackievirus and Adenovirus receptor in cancercells[J].Cancer Res,2003 ,63:2088.
[15]Wilcox ME ,Yang WQ ,Senger D,etal.Reovirus as an oncol yticagent against experimental human malignant gliomas[J].J NatlCancer Inst,2001,93(12):903.



