王 彦,吴 奎,毕玉田,王长征
(第三军医大学新桥医院全军呼吸疾病研究所,重庆400037)
支气管哮喘是由多种炎性细胞参与的气道慢性炎症性疾病。过去认为,Th1/Th2比例失衡导致Th2细胞过度活化是哮喘的主要发病机制。但是,目前研究认为,单纯的Th1/Th2比例失衡并不能完全解释哮喘的发病,免疫耐受缺陷和(或)异常可能是哮喘发病的重要机制[1-2]。Fas/FasL系统在诱导外周免疫耐受、保护免疫豁免组织逃避机体免疫系统的攻击和维持免疫系统平衡,甚至肿瘤免疫逃逸中均起重要作用[3]。近年来,将FasL基因转染树突状细胞(dendritic cell,DC)获得可以诱导T细胞凋亡的“杀手DC”(FasL-DC),在诱导免疫耐受的研究中已越来越受到重视[4-5]。屋尘螨是哮喘患者的常见过敏原。因此,如果构建屋尘螨主要抗原Der p2和FasL基因共表达载体并转染DC,有望诱导机体对屋尘螨过敏原产生特异性免疫耐受,从而达到防治哮喘的目的。在本实验中,作者构建FasL和屋尘螨变应原Der p2双基因共表达载体,并检测了它们在小鼠骨髓来源的DC中的表达情况,为下一步研究奠定实验基础。
1 材料与方法
1.1 实验动物和主要试剂 C57BL/6小鼠15只,雌雄不拘,体质量20~30 g,6~8周龄,购自重庆医科大学实验动物中心;pIRES2EGFP质粒购自Clontech公司;plambd-Der p2质粒购自美国HESKA公司;PCR引物用DNAstar软件设计并订购于赛百盛公司;重组小鼠粒细胞巨噬细胞集落刺激因子(rmGM-CSF)购自Peprotech公司;高保真RT-PCR试剂盒购自Toyobo公司;限制性内切酶购自Takara公司;脂质体转染剂LipofectamineTM2000购自Invitrogen公司;质粒提取试剂盒购自Omega公司;TRI reagent购自M RC公司;RPMI-1640培养基和胎牛血清(FBS)购自Hyclone公司;小鼠抗Der p2单抗购自英国 IB公司;兔抗小鼠FasL一抗、HRP标记或 cy3标记的羊抗兔IgG二抗分别购自Santa Cruz和中山公司。
1.2 PCR扩增Der p2基因 以plambd-Der p2为模板扩增Der p2质粒,引物如下,Der p2引物:扩增片段为426 bp(Der p2全长基因 396 bp+酶切位点+保护碱基),上游:5′-CTG CAG AAC CAC AAC CAT GGA TCA AGT CGA TGT CAA AGA-3′(BstXⅠ);下游:5′-ATA AGA A TG CGG CCG CT T TAA TCG CGG AT T TTA GCA TGA G-3′(NotⅠ)。反应条件:95 ℃、4 min→95 ℃、0.5 min→66 ℃、1 min→68 ℃、1 min。后3步进行35个循环,循环完成后68℃、5 min终止。经1%琼脂糖凝胶电泳后,胶回收Der p2产物。
1.3 pIRES2EGFP-Der p2重组载体的构建及鉴定 BstXⅠ和NotⅠ双酶切 pIRES2EGFP和 Der p2,切除 pIRES2EGFP中位于 IRES序列下游的 EGFP片段,切胶回收线性pIRES2EGFP载体片段和Der p2基因,在T4DNA连接酶作用下进行连接反应(16℃、16 h),将 Der p2基因片段克隆入pIRES2EGFP原 EGFP片段位置得 pIRES2EGFP-Der p2。将pIRES2EGFP-Der p2转化 E.coli DH5α感受态细菌,氨苄青霉素(Kan)抗性筛选,阳性菌落扩增后抽提重组质粒,采用 NotⅠ和BstXⅠ双酶切和PCR鉴定。
1.4 pIRES2EGFP-FasL-Der p2重组载体的构建及鉴定BamHⅠ和SalⅠ双酶切 pMD18T-FasL和 pIRES2EGFP-Der p2,从pMD18T-FasL质粒双酶切获得FasL片段,切胶回收876 bp FasL条带和线性pIRES2EGFP-Der p2载体片段,在T4DNA连接酶作用下进行连接反应(16℃、16 h),将FasL基因克隆入pIRES2EGFP-Der p2的IRES序列上游多克隆位点区获得FasL和Der p2双基因共表达重组载体pIRES2EGFPFasL-Der p2。将 pIRES2EGFP-FasL-Der p2转化 E.coliα DH5感受态细菌,氨苄青霉素(Kan)抗性筛选,阳性菌落扩增后抽提重组质粒,用NotⅠ和BstXⅠ双酶切,BamH Ⅰ和SalⅠ双酶切分别鉴定Der p2和FasL,并将鉴定正确的重组质粒测序。
1.5 pIRES2EGFP-FasL-Der p2转染树突状细胞 无菌条件下取C57BL/6小鼠完整的股骨、胫骨,离断干骺端,以RPM I-1640培养液1 mL冲洗髓腔,获得单细胞悬液,2 000 r/min离心 10 min,弃上清液,重悬于 RPMI-1640培养基,加入重组小鼠粒细胞巨噬细胞集落刺激因子(rmGM-CSF)至终浓度为20 ng/mL,继续培养10 d后收获细胞,用流式细胞仪(FACS)鉴定DC相对特异性表面分子CD11c表达后,进行下一步实验。pIRES2EGFP-FasL-Der p2重组质粒与 LipofectamineTM2000按1 μ g∶3 L混合于50 μ L培养基,室温下放置 30 min,形成转染液复合物,加入培养在6孔板的DC中,常规培养24 h后,细胞换液并加入G418至200 μ g/mL,48 h后进行下一步实验(FasL-Der p2-DC组)。以未转染质粒和转染空白质粒的DC为对照,每组5个样本(n=5)。
1.6 RT-PCR检测基因表达 合成FasL、Der p2和GAPDH共 3对 PCR引物:FasL引物(446 bp)上游:5′-GGG CTC CTC CAG GGT CAG TT T T-3′;下游:5′-TCC AGA GAT CAG AGC GGT TCC ATA-3′。Der p2 引物 2(234 bp)上游:5′-CGA AGC CAA CCA AAA CAC AA-3′;下游:5′-CAG GCC AAA ACA CCA TCA TC-3′。GAPDH(311 bp)上游:5′-CCT CTG GAA AGC TGT GGC G-3′;下游 :5′-GGT GGA AGA GTG GGA GTTG-3′。用 TRI reagent以一步法提取各组DC(107)总 RNA,取RNA 2 g进行cDNA合成:70℃、5 min→42℃、60 min→70℃、10 min→冰上;PCR扩增:(1)FasL(33循环)和GAPDH(27循环):94℃预变性 1.5 min→94℃、0.25 min→55 ℃、0.5 min→68℃、1 min→68℃延伸 5 min;(2)Der p2(33循环)和 GAPDH(27循环):将 PCR管置于PCR仪中,95 ℃、4 min→95 ℃、0.25 min→50 ℃、0.5 min→68 ℃、1 min。后3步进行33个循环,PCR产物以1.5%琼脂糖凝胶电泳1~1.5 h后,图像扫描,用GAPDH为内参照进行分析。
1.7 Western Blot检测蛋白表达 用T RI reagent提取各组细胞蛋白质。取蛋白质20 μ g以 10%SDS-PAGE电泳分离;半干电转移蛋白到PVDF膜,5%脱脂奶粉封闭,加一抗[兔抗小鼠FasL(1∶500)或小鼠抗Der p2单抗(1∶500)或兔抗小鼠GAPDH(1∶500)]4℃杂交过夜,二抗(HRP标记的羊抗兔IgG或FITC标记羊抗小鼠二抗)室温孵育1 h,二氨基联苯胺(DAB)染色。扫描蛋白条带,以GAPDH为内参照进行分析。
2 结 果
2.1 重组 pIRES2EGFP-Der p2的鉴定 采用 NotⅠ、BstXⅠ双酶切法和PCR法鉴定重组pIRES2EGFP-Der p2。NotⅠ和BstXⅠ双酶切后,可得396 bp Der p2片段和4 585 bp线性pIRES2EGFP载体片段(图1)。以pIRES2EGFP-Der p2质粒为模板,采用 PCR扩增Der p2,可扩增得426 bp的Der p2片段(图1)。表明 pIRES2EGFP-Der p2构建成功。
2.2 pIRES2EGFP-FasL-Der p2的鉴定 采用双酶切鉴定和测序法鉴定。NotⅠ和BstXⅠ双酶切后,可得396 bp Der p2片段和5 440 bp线性 pIRES2EGFP-FasL-Der p2载体片段(图2);BamHⅠ和SalⅠ双酶切后,可得 876 bp FasL片段和4 960 bp线性 pIRES2EGFP-FasL-Der p2载体片段(图2)。经测序后表明pIRES2EGFP-FasL-Der p2中所含有的Der p2基因和FasL基因与Genbank中的Der p2基因(AF276239)和FasL基因(NM_010177)的编码区序列完全一致。表明pIRES2EGFP-FasL-Der p2构建成功,Der p2和FasL基因序列完全正确。
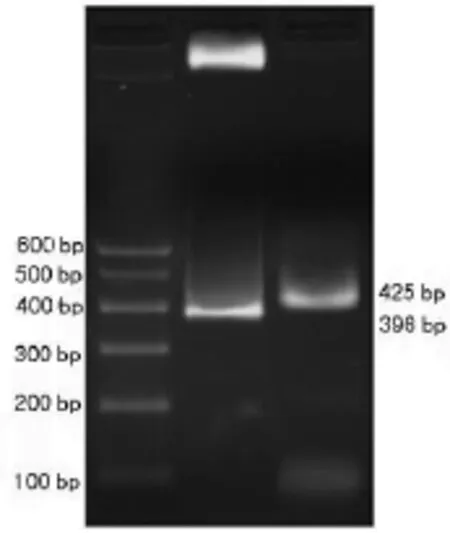
图1 pIRES2EGFP-Der p2质粒酶切和PCR鉴定

图2 pIRES2EGFP-FasL-Der p2双酶切鉴定
2.3 pIRES2EGFP-FasL-Der p2重组质粒功能鉴定 FACS检测表明,第10天培养细胞表达CD11c(DC特异性表面分子)阳性率为79.63%,提示大多数骨髓细胞已分化为DC。
2.3.1 RT-PCR检测重组质粒转染DC后FasL和Der p2 mRNA表达 RT-PCR分别检测转染48 h后基因转染DC表达FasL和Der p2 mRNA情况。结果显示,3组均可见311 bp的GAPDH条带。pIRES2EGFP-FasL-Der p2转染DC组(FasL-Der p2-DC)可见明显的446 bp的FasL条带和234 bp Der p2条带(图3、4),而未转染DC组、转染空质粒DC组均未见FasL和Der p2条带。提示FasL-Der p2-DC能表达FasL和Der p2 mRNA,目的基因FasL和Der p2在FasL-Der p2-DC中能有效地翻译转录。
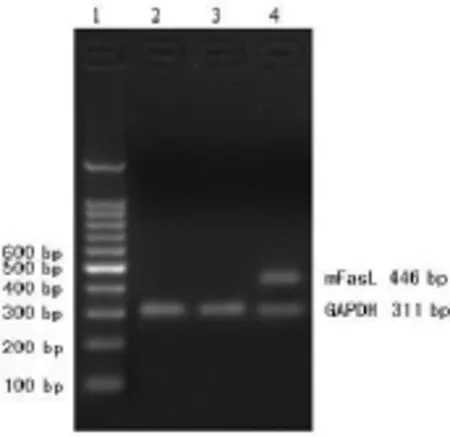
图3 pIRES2EGFP-FasL-Der p2转染DC(FasL-Der p2-DC)的FasL mRNA表达

图4 pIRES2EGFP-FasL-Der p2转染DC(FasL-Der p2-DC)的Der p2 mRNA表达
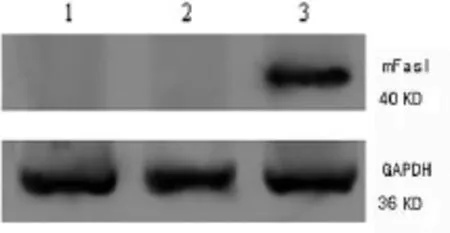
图5 pIRES2EGFP-FasL-Der p2转染DC(FasL-Der p2-DC)的FasL蛋白表达
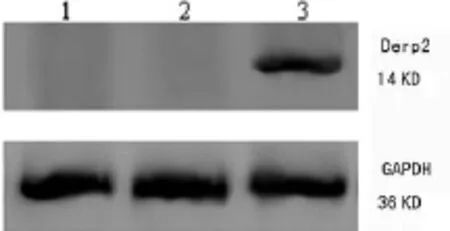
图6 pIRES2EGFP-FasL-Der p2转染DC(FasL-Der p2-DC)的Der p2蛋白表达
2.3.2 Western Blot检测重组质粒转染DC后FasL和Der p2蛋白表达 Western Blot检测基因转染DC中FasL和Der p2蛋白的表达情况。结果表明,各组在36 KD处皆显现明显的GAPDH内参照蛋白印迹。未转染DC组和转染空质粒DC组无FasL和Der p2蛋白条带。FasL-Der p2-DC可见明显的40 KD FasL蛋白条带和14 KD Der p2蛋白条带(图5、6)。提示pIRES2EGFP-FasL-Der p2转染DC能表达FasL和Der p2蛋白。
3 讨 论
FasL分子属于肿瘤坏死因子家族成员,Fas/FasL介导的T细胞凋亡是机体维持对自身抗原免疫耐受(外周免疫耐受)的重要机制[6]。有研究发现,FasL基因转染的同种异体DC能够通过抑制同种混合淋巴细胞反应,从而导致机体对同种异体抗原的低反应性;将FasL基因转染的供者DC注入受者腹腔后进行异位心血管移植,虽然不能完全阻止排斥反应的发生,但能显着提高移植物的存活期[7]。FasL基因转染的DC注入卵蛋白(OVA)特异性Th2细胞诱导的哮喘小鼠体内后可以诱导OVA特异性T细胞凋亡,显着抑制气道高反应性和气道变应性炎症[8]。表明FasL基因转染的DC在诱导免疫耐受中有重要作用。
屋尘螨是过敏性哮喘患者常见的过敏原,最重要的是Ⅰ类(Der p1)和Ⅱ类(Der p2)变应原[9]。编码 Der p1、Der p2质粒DNA疫苗能有效抑制屋尘螨提取液诱导的气道变应性炎症[10-11]。将DNA疫苗质粒转染DC能增强DNA疫苗的治疗作用。若DC能同时独立表达FasL和Der p2,DC在将Der p2抗原呈递给T细胞的同时,亦将FasL信号传递给T细胞,则可能诱导屋尘螨过敏原特异性T细胞凋亡,而诱导抗原特异性免疫耐受,为哮喘的治疗提供新的方法。为了使DC能同时独立表达两种蛋白,本研究成功构建了FasL和Der p2双基因共表达的真核载体。
利用基因间以内部核糖体结合位点(internal ribosome entry site,IRES)序列连接构建多顺反子载体,其能将多个基因在单一启动子控制下转录形成单一mRNA,避免了在转录调控水平对基因表达的影响。IRES元件代替内部启动子克服了采用启动子间的相互抑制现象,是近年来多基因共表达载体构建的重要方法[12]。IRES序列来源于某些病毒和细胞的mRNA 5′端的一段非翻译区,具有内部核糖体结合位点功能[13]。IRES的优点是在上游启动子的控制下,与IRES相连的非相关基因可同时转录成一条单链mRNA,但翻译是各自独立的,其以不依赖帽的方式启动远端mRNA的翻译,从而在同一转录本上翻译出各自独立的蛋白[14]。IRES连接的2个开放阅读框,其转录产物在翻译时核糖体能同时进入并起始翻译IRES上游和下游的2个转录子。其中,IRES上游mRNA的翻译起始遵循一般的真核生物基因的翻译起始规律,IRES下游的mRNA的翻译起始由核糖体直接进入IRES位点后起始翻译。
[1]Dahl M E,Dabbagh K,Liggitt D,et al.Viral-induced T helper type 1 responses enhance allergic disease by effects on lung dendritic cells[J].Nat Immunol,2004,5(3):337.
[2]Cui J,Pazdziorko S,Miyashiro JS,et al.TH1-mediated airway hyperresponsiveness independent of neutrophilic inflammation[J].J Allergy Clin Immunol,2005,115(2):309.
[3]覃玉桃,王仁生.Fas/FasL系统与肿瘤免疫逃逸[J].广西医学,2002,24(5):663.
[4]Kusuhara M,Matsue K,Edelbaum D,et al.Killing of naive T cells by CD95L-transfected dendritic cells:in vivo study using killer DC-DC hybrids and CD4+T cells from D011.10 mice[J].Eur J Immunol,2002,32(4):1035.
[5]Matsue H,Matsue K,Walters M,et al.Induction of antigen-specific immunosuppression by CD95L cDNA-transfected′killer′dendritic cells[J].Nat Med,1999,5(8):930.
[6]刘安民,钟志光,邓跃飞,等.Fas系统在星形细胞瘤的表达及其与细胞凋亡的关系[J].广东医学,2000,21(9):735.
[7]Min WP,Gorczynski R,Huang XY,et al.Dendritic cells genetically engineered to express Fas ligand induce donor specific hyporesponsiveness and prolong allograft survival[J].J Immunol,2000,164(1):161.
[8]Chuang YH,Suen JL,Chiang BL.Fas-ligand-expressing adenovirus-transfected dendritic cells decrease allergenspecific T cells and airway inflammation in a murine model of asthma[J].J Mol Med,2006,84(7):595.
[9]林霞,邢英梅.变应原皮试在哮喘诊断中的应用[J].海南医学,2003,14(4):19.
[10]Jacquet A,Magi M,Haumont M,et al.Absence of immunoglobulin E synthesis and airway eosinophilia by vaccination with plasmid DNA encoding ProDer p1[J].Clin Exp Allergy,2003,33:218.
[11]Li GP,Liu ZG,Qiu J,et al.DNA vaccine encoding Der p2 allergen generates immunologic protection in recombinant Der p2 allergen-induced allergic airway inflammation mice model[J].Chin Med J(Engl),2005,118(7):534.
[12]晏霆,朱满洲.基因治疗与基因载体[J].安徽医药,2002,6(4):72.
[13]李朵璐,阚全程,余祖江.丙型肝炎病毒IRES基因T载体克隆及序列分析[J].医药论坛杂志,2009,30(23):4.
[14]M′hadheb-Gharbi MB,Kean KM,Gharbi J.M olecular analysis of the role of IRES stem-loop V in replicative capacities and translation efficiencies of Coxsackievirus B3 mutants[J].Mol Biol Rep,2009,36(2):255.



