陈传新,石怡珍,杨 仪,唐 军,刘增礼△,徐巧玲
(1.苏州大学附属第二医院核医学科,江苏苏州251004;2.江苏省无锡市第四人民医院核医学科 214062)
1981年McDonald等[1]从猪的胃组织中分离出胃泌素释放肽(gastrin releasing peptide,GRP),并发现GRP存在于原发性肺癌尤其是小细胞肺癌(SCLC)中。1994年Miyake等[2]研究证实胃泌素释放肽前体(pro-gastrin-releasing peptide,ProGRP)在血浆中含量稳定,能代表GRP水平和GRP基因表达。近年来,有关ProGRP的研究十分活跃[3-12]。
本课题组前期对利用基因重组的ProGRP(31-98)作为抗原免疫Balb/c小鼠所制备的单克隆抗体E-B5进行了较为详细的研究[9-10]。现对另一株抗 ProGRP(31-98)单克隆抗体 D-D3的131I标记方法及在健康昆明小鼠体内生物学分布进行了初步研究,报道如下。
1 材料与方法
1.1 材料 抗ProGRP(31-98)单克隆抗体D-D3(5 mg/m L)由中国辐射防护研究院惠赠;Na131I溶液由中国核动力研究院生产;昆明小鼠由苏州大学动物实验中心提供;氯胺-T为Sigma公司产品;Sephadex G50葡聚糖凝胶柱由Pharmacia公司生产;放射性活度仪为美国Capintec公司产品。
1.2 方法
1.2.1 NCI-H 446细胞株中ProGRP表达的检测 收集传代培养的人SCLC NCI-H446细胞,加入0.1%的Triton-X100预孵,然后以D-D3作为一抗,FITC-羊抗鼠单克隆抗体为二抗,用流式细胞仪检测NCI-H446细胞PrGRP的表达。以肺腺癌细胞株A 549作为对照。
1.2.2131I标记 D-D3单抗 采用氯胺-T法用131I标记单克隆抗体D-D3。利用纸层析法测定标记率,支持物为新华1号层析纸,展开剂为生理盐水,131I-D-D3的Rf=1/10,131I的Rf=1。
表1 健康昆明小鼠尾静脉注射131 I-D-D3不同时间点各脏器的百分注射剂量率(±s,%ID/g)
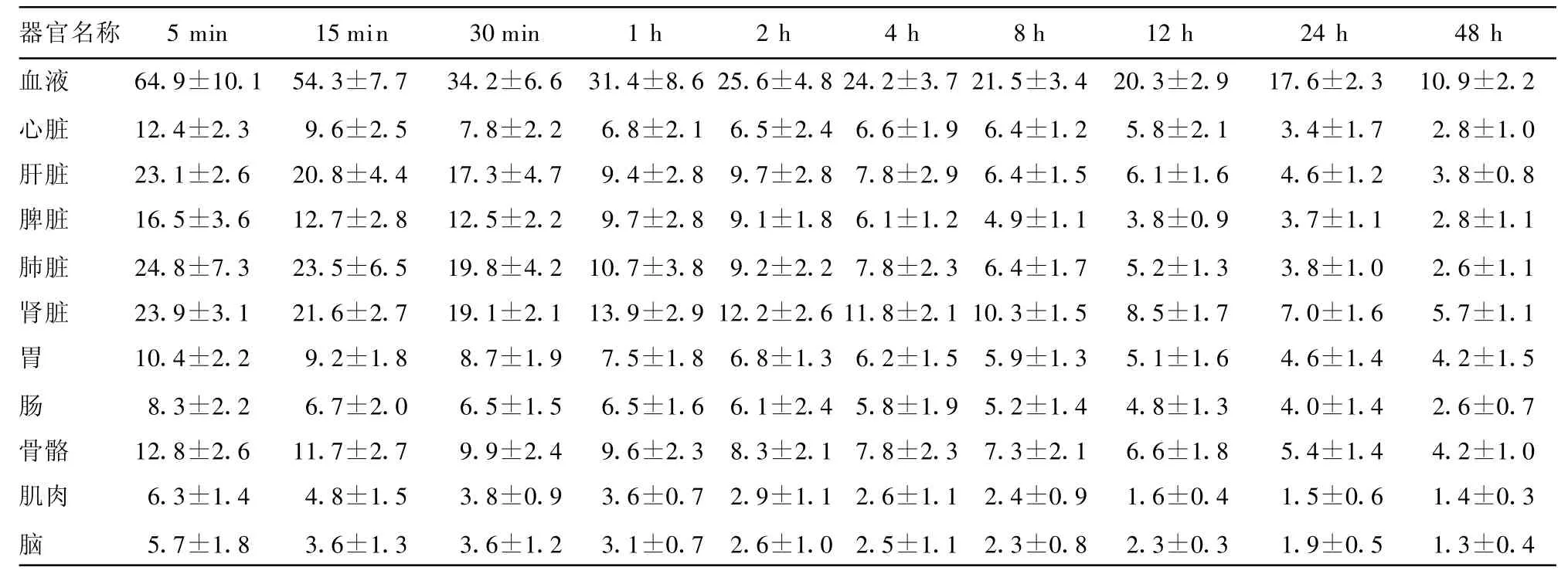
表1 健康昆明小鼠尾静脉注射131 I-D-D3不同时间点各脏器的百分注射剂量率(±s,%ID/g)
器官名称 5 min 15 min 30 min 1 h 2 h 4 h 8 h 12 h 24 h 48 h血液 64.9±10.1 54.3±7.7 34.2±6.6 31.4±8.6 25.6±4.8 24.2±3.7 21.5±3.4 20.3±2.9 17.6±2.3 10.9±2.2心脏 12.4±2.3 9.6±2.5 7.8±2.2 6.8±2.1 6.5±2.4 6.6±1.9 6.4±1.2 5.8±2.1 3.4±1.7 2.8±1.0肝脏 23.1±2.6 20.8±4.4 17.3±4.7 9.4±2.8 9.7±2.8 7.8±2.9 6.4±1.5 6.1±1.6 4.6±1.2 3.8±0.8脾脏 16.5±3.6 12.7±2.8 12.5±2.2 9.7±2.8 9.1±1.8 6.1±1.2 4.9±1.1 3.8±0.9 3.7±1.1 2.8±1.1肺脏 24.8±7.3 23.5±6.5 19.8±4.2 10.7±3.8 9.2±2.2 7.8±2.3 6.4±1.7 5.2±1.3 3.8±1.0 2.6±1.1肾脏 23.9±3.1 21.6±2.7 19.1±2.1 13.9±2.9 12.2±2.6 11.8±2.1 10.3±1.5 8.5±1.7 7.0±1.6 5.7±1.1胃 10.4±2.2 9.2±1.8 8.7±1.9 7.5±1.8 6.8±1.3 6.2±1.5 5.9±1.3 5.1±1.6 4.6±1.4 4.2±1.5肠8.3±2.2 6.7±2.0 6.5±1.5 6.5±1.6 6.1±2.4 5.8±1.9 5.2±1.4 4.8±1.3 4.0±1.4 2.6±0.7骨骼 12.8±2.6 11.7±2.7 9.9±2.4 9.6±2.3 8.3±2.1 7.8±2.3 7.3±2.1 6.6±1.8 5.4±1.4 4.2±1.0肌肉 6.3±1.4 4.8±1.5 3.8±0.9 3.6±0.7 2.9±1.1 2.6±1.1 2.4±0.9 1.6±0.4 1.5±0.6 1.4±0.3脑5.7±1.8 3.6±1.3 3.6±1.2 3.1±0.7 2.6±1.0 2.5±1.1 2.3±0.8 2.3±0.3 1.9±0.5 1.3±0.4
1.2.3131I-D-D3的分离纯化 将标记液加于处理好的Sephadex G50葡聚糖凝胶柱的上端,用 0.05 mol/L、p H 7.5的PB液洗脱,洗脱液收集到离心管中,每管0.5 m L,利用放射性活度仪测量每管的放射性计数(cpm)。达到第1个放射性高峰的样品为131I-D-D3,第2个放射性高峰的样品为游离131I。用纸层析法计算样品的放化纯度、比活度。纯化后的标记抗体经0.22μm滤膜除菌后待用。
1.2.4131I-D-D3稳定性的测定 将纯化的131I-D-D3置于37℃水浴箱中,分别在标记后 1、2、4、6、8、12、24、48 h 测定其放化纯度。取多只鼠血清充分混合,吸出100μL置于离心管中,加入50μL纯化131I-D-D3,充分混匀后放置于37℃水浴箱中,分别在混合后的2、6、12、24 h测定其放化纯度。
1.2.5131I-D-D3在健康昆明小鼠体内分布研究 选择健康5周龄昆明小鼠50只,雌雄各半,体质量30 g左右,随机分成10组,每组5只。每只小鼠自尾静脉注射131I-D-D31.48 k Bq/100 μL(4μCi/100μL),各组小鼠分别于注射后的5、15、30 min及1、2、4、8、12、24、48 h 剪断颈动脉处死 ,取血液、心脏、肝脏、脾脏、肺脏、肾脏、胃、小肠、骨骼(右下肢)、肌肉(右下肢)和脑组织,其中血液均做复管(每管100μL)并即刻测重,其余各组织和器官用生理盐水漂洗后晾干,准确称质量,并在放免γ测量仪上测量每管的每分钟cpm,同时测量标准源的总cpm。计算每克组织在不同时间点的百分注射剂量率(%ID/g)。利用Origine软件将血液各时间点的百分注射剂量率进行多指数曲线拟合,计算药物动力学参数。
2 结 果
2.1 ProGRP的表达 以D-D3作为一抗,利用流式细胞仪测得处于对数生长期的NCI-H446、A549细胞ProGRP的表达率分别为88.63%、15.56%。
2.2131I-D-D3标记率及稳定性 经测量计算,131I-D-D3的标记率为(86.56±3.8)%,比活度为(2.25±0.05)MBq/μg,纯化后即刻131I-D-D3的放化纯度为(99.27±0.6)%,在 37℃水浴箱放置24 h后放化纯度为(93.5±0.5)%,48 h后的放化纯度仍高达(88.38±0.4)%。与鼠血清充分混合后24 h的放化纯度为(64.43±0.7)%。
2.3131I-D-D3在健康昆明小鼠体内生物学分布131I-D-D3在体内主要通过肾脏和肝脏代谢,血液清除较快,脑、肌肉、心脏等组织摄取较少,各时间点小鼠不同脏器的百分注射剂量率见表1。131I-D-D3在健康昆明小鼠体内的代谢过程符合一级血药动力学二室模型,经拟合回归计算得其代谢公式为c=50.234e-2.793t+26.128e-0.018t,快相清除半衰期T1/2α为 37.89 h,慢相清除半衰期 T1/2β为37.89 h。
3 讨 论
单克隆抗体D-D3是针对ProGRP(31-98)片断的完整抗体,与本课题组前期研究的另一株抗ProGRP(31-98)单克隆抗体EB5所不同的是它属于IgG1亚型[13-14]。本研究中使用D-D3作为一抗,利用流式细胞仪分别对培养的人SCLC NCI-H446细胞株和肺腺癌A 549细胞株的ProGRP表达率进行了测定,检测过程中加入的Triton-X 100是一种表面活性剂,能够增加细胞膜的通透性。结果显示NCI-H44细胞ProGRP的表达率高达88.63%,而A549细胞ProGRP的表达率仅为15.56%。表明SCLC有ProGPR抗原的高表达,而且D-D3对ProGPR有良好的特异性,这为利用抗ProGRP(31-98)单克隆抗体D-D3鉴别诊断SCLC和肺腺癌奠定了理论和实验基础。
氯氨-T是一种氧化剂,其水溶液可使阴离子碘氧化成碘分子,这种活性碘分子可取代肽链上酪氨酸苯环上羟基位的一个或两个氢,使之成为含有放射性的碘化酪氨酸多肽链。氯氨-T法标记单克隆抗体效率高,重复性好,试剂便宜易得,是目前使用最多的碘标记单克隆抗体方法。本实验采用氯胺-T法用131I标记单克隆抗体 D-D3,131I-D-D3的标记率达到(86.56±3.8)%,纯化后产品的放化纯度为(99.27±0.6)%,比活度为(2.25±0.05)MBq/μg,在体外37℃水浴中放置48 h后的放化纯度仍高达(88.38±0.4)%,与鼠血清充分混合后在体外37℃水浴中放置24 h其放化纯度仍可达(64.43±0.7)%。表明131I-D-D3在体外及模拟体内环境下都保持了较好的稳定性,有利于利用其开展相应的放射免疫显像及放射免疫治疗研究。
本研究体内分布结果表明,131I-D-D3在健康昆明小鼠的体内代谢过程符合一级血药动力学二室模型,注射后5 min时,131I-D-D3在各主要器官的每克组织百分注射剂量率以血液为最高,其次是肝脏、肾脏、脾脏和肺脏;随后,血液百分注射剂量率很快下降,而肾脏和肝脏、脾脏、肺脏与骨组织则下降较慢;脑、肌肉、心脏百分注射剂量率始终保持在较低水平。肝脏、脾脏、肺脏的巨噬细胞和骨组织中的破骨细胞等都属于单核吞噬细胞系统,具有吞噬异物作用,并且肝脏和肾脏是蛋白质和多肽类物质的代谢场所[15],因而在对血液中的一些标记单克隆抗体或及其断裂片段进行清除时,可以引起这些器官的放射性计数升高和下降缓慢。虽然脑组织可以分泌 Pro-GRP[16],但脑组织内131I-D-D3百分注射剂量率却始终保持在较低水平,表明131I-D-D3不易通过血脑屏障。
本研究结果表明,131I-D-D3在体内主要通过肝脏和肾脏代谢,血液清除较快,肠道、脑、肌肉等组织摄取少,为进一步利用其开展相应的放射免疫显像和治疗研究工作奠定了实验基础。
[1] McDonald TJ,Ghatei MA,Bloom SR,et al.A qualitative comparison of canine plasma gastroenteropancreatic hormone response to bombesin and the porcine gastrin-releasing peptide(GRP)[J].Regul Pept,1981,2(5):293-304.
[2] Miyake Y,Kodama T,Yamaguchi K,et al.Progastrin-releasing peptide(31-98)is a specific tumor marker in patients with small cell lung carcinoma[J].Cancer Res,1994,54(8):2136-2140.
[3] Yamaguchi H,Soda H,Kitazaki T,et al.Serum progastrin-releasing peptide levels followed by whole-body positron emission tomography detects early recurrence of small-cell lung cancer[J].Respirology,2007,12(1):137-139.
[4] Nordlund MS,Fermer C,Nilsson O.et al.Production and Characterization of Monoclonal Antibodies for Immunoassay of the Lung Cancer Marker proGRP[J].Tumour Biol,2007,28(2):100-110.
[5] Molina R,AugéJM,Bosch X,et al.Usefulness of serum tumor markers,including progastrin-releasing peptide,in patients with lung cancer:correlation with histology[J].Tumour Biol,2009,30(3):121-129.
[6] Nordlund MS,Warren DJ,Laerdahl JK,et al.Studies on multiple forms of proGRP in serum from small cell lung cancer patients[J].Tumour Biol,2009,30(5-6):265-275.
[7] Holdenrieder S,Von Pawel J,Dankelmann E,et al.Nucleosomes,ProGRP,NSE,CYFRA 21-1,and CEA in monitoring first-line chemotherapy of small cell lung cancer[J].Clin Cancer Res,2008,14(23):7813-7821.
[8] Panigone S,Nunn AD.Lutetium-177-labeled gastrin releasing peptide receptor binding analogs:a novel approach to radionuclide therapy[J].Q J Nucl Med Mol Imaging,2006,50(4):310-321.
[9] Winther B,Paus E,Reubsaet JL.Determination of the small cell lung cancer associated biomarker pro-gastrinreleasing peptide(ProGRP)using LC-MS[J].J Sep Sci,2007,30(2):234-240.
[10]Satoh H,Kagohashi K,Kurishima K,et al.Comparison of neurone-specific enolase and pro-gastrin releasing peptide in the prognostic evaluation of small cell lung cancer patients[J].Clin Oncol(RColl Radiol),2006,18(9):720.
[11]Nordlund MS,Fermer C,Nilsson O,et al.Production and Characterization of Monoclonal Antibodies for Immunoassay of the Lung Cancer Marker proGRP[J].Tumour Biol,2007,28(2):100-110.
[12]Dumesny C,Patel O,Lachal S,et al.Synthesis,expression and biological activity of the prohormone for gastrin releasing peptide(ProGRP)[J].Endocrinology,2006,147(1):502-509.
[13]徐巧玲,周小林,石怡珍,等.抗ProGRP(31-98)单克隆抗体E-B5的131I标记及体内生物分布研究[J].中华核医学杂志,2009,29(4):274-278.
[14]石怡珍,周小林,徐巧玲,等.131I-抗 ProGRP(31-98)单克隆抗体E-B5放射免疫显像及放射免疫治疗实验研究[J].中华核医学杂志,2010,30(2):110-115.
[15]鄢永胜.蛋白多肽类药物的药代动力学[J].咸宁医学院学报,2004,24(3):100-104.
[16]Spindel ER,Gibson BW,Reeve JRJr,et al.Cloning of cDNAs encoding amphibian bombesin:evidence for the relationship between bombesin and gastrin-releasing peptide[J].Proc Natl Acad Sci USA,1990,87(24):9813-9817.



