于向荣,张威江,徐南飞,李 薇
(江苏省无锡市第二人民医院:1.影像科;2.神经内科 214002)
脑桥中央髓鞘溶解症(central pontine myelinolysis,CPM)是以脑桥基底部对称性髓鞘脱失,而轴索、神经相对完好为特征的少见而又致命的疾病。CPM起病迅速,功能改变往往先于形态学改变,因此患者早期出现临床症状后常规影像学检查(CT、MRI)多呈阴性表现。
CPM的早期诊断有赖于新型影像检查技术,M R扩散加权(diffusion weighted imaging,DWI)与传统M RI相比是个全新的领域。DWI是从分子水平观察人体组织的空间组成信息和病理生理状态下各组织成分功能变化的影像学检查方法,组织含水量的改变可通过测定表观扩散系数(apparent diffusion coefficient,ADC)值进行量化分析。DWI在脑梗死的早期诊断方面已得到充分肯定[1],但对CPM的研究报道很少。作者通过1例脑桥中央髓鞘溶解症的临床诊疗资料及DWI表现,并结合文献报道,从分子水平探讨CPM发病机制。
1 临床资料
患者,男,58岁,冠状动脉搭桥术18 d后因乏力、上腹部不适、恶性呕吐1 d入院。入院查体无明确异常。实验室检查:血Na+99.8 mmol/L,Cl-73.7 mmol/L,K+4.23 mmol/L。临床诊断:水电解质紊乱,低钠血症。予补钠治疗,5 d后血钠恢复正常,但患者出现明显精神活动异常如情绪不稳,有时伤感,有时激动,表情怪异,幻觉,被害妄想,口齿不清,右侧额纹、鼻唇沟变浅,四肢轻瘫,双侧巴氏征阳性,双侧指鼻不准。
影像检查结果:当日头颅CT检查阴性。2 d后行1.5 T MR(GE Signa excite HD)头颅扫描,包括轴位 T1WI、T2WI、增强、DWI扫描及M R血管造影。DWI采用单次激发自旋平面回波序列(SE-EPI)轴位扫描,TR 6 000 ms,TE 90 ms,视野(FOV)24 cm ×24 cm,层厚 5 mm,层距1 mm,NEX 4次,扩散敏感梯度方向数为3,扩散敏感因子(b)值取0和 1 000 s/mm2。T1WI示脑桥区稍低信号,T2WI呈稍高信号,增强扫描病灶未见明显强化。M R血管造影检查阴性。DWI示脑桥中央对称性高信号,ADC值为 0.784×10-3mm2/s(图1),邻近正常区ADC值位0.925×10-3mm2/s。
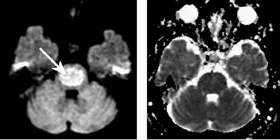
图1 CPM患者发病2 d后DWI检查
临床予甲基强的松、甲钴胺、奥氮平及支持治疗,患者症状未见明显好转。10 d后MRI复查,病灶T2WI仍呈高信号,DWI呈三叉形低信号,ADC值为1.480×10-3mm2/s,周边高信号环绕,ADC值为0.624×10-3mm2/s(图 2)。
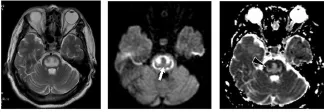
图2 CPM患者治疗10 d后M RI复查
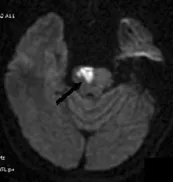
图3 脑桥急性期梗死DWI图
2 讨 论
CPM的发病机理目前尚不十分清楚,多数学者认为本症为血钠、血糖等快速升高引起的内皮细胞渗透损伤所致,特别是低钠血症快速纠正(>12 mEq·L-1·d-1)被认为是诊断CPM较可靠的指标之一[2-3]。其机制可能是由于渗透压改变导致内皮细胞损伤,富含血管的灰质在局部释放大量髓鞘毒性因子和(或)形成血管源性水肿引起渗透性刺激。而脑桥为灰白质交替的网状结构,因此局部的髓鞘毒性物质作用于白质,使其发生髓鞘溶解[3-4],病变主要位于脑桥基底部的中央,背盖部多不受累,向上可累及中脑,但向下达延髓者罕见。
常规MRI扫描在CPM诊断上有延迟效应,一般临床症状出现1~2周后M RI方可以明确诊断,并且其影像表现与临床症状的严重程度之间无相关性[5-7],使得CPM的早期诊断困难,预后评估差。
DWI可直接反映组织分子的微观运动,能检测出与组织含水量改变有关的形态学和生理学早期改变。Ruzek等[8]报道1例CPM在发病24 h内 DWI上出现脑桥异常高信号,ADC值明显降低,说明水分子扩散受限以及细胞内水分增多。这一表现支持“细胞内低渗”的假说,即低钠血症快速纠正导致细胞内低渗状态,水分子由细胞外间隙向细胞内转移,细胞外自由水分子减少,扩散受限;同时细胞内水分子增加使得细胞肿胀,细胞外间隙变窄、迂曲,进一步限制水分子扩散,DWI出现异常高信号,有利于病变的早期发现。本例CPM在症状出现后2 d行M RI检查,病灶DWI成像呈高信号,ADC值较邻近正常区轻度降低,可能此时形成血管源性水肿,血管内皮细胞渗透性损伤,细胞膜完整性破坏,少量大分子物质及水分子外渗出细胞外间隙成为游离水,病变区组织含水量轻度增加,水分子扩散程度增大,但仍低于正常值。
本例CPM治疗10 d后症状未见明显好转,MRI复查显示T2WI呈高信号,而DWI则呈低信号,ADC值明显升高,推测可能是由于血管内皮细胞渗透性损伤加重,使得富含血管的灰质在局部释放大量髓鞘毒性物质,作用于脑桥白质,使其发生髓鞘溶解、髓鞘脱失,细胞皱缩,水分子大量外渗出细胞外间隙,扩散程度明显增大[8],与临床预后相符。而病灶周边高信号可能是水肿挤压邻近细胞,由于T2穿透效应(shine-through effect)所致[9]。
Cramer等[6]报道的2例 CPM中,1例与本例相似,诊断时为非急性期,ADC值轻度减低[(0.62±0.11)×10-3mm2],患者预后差,于四肢瘫痪发生21 d后死亡;另一例为急性期,ADC值明显减低[(0.39±0.14)×10-3mm2],治疗后临床症状好转,21 d后复查时ADC值恢复正常,而T2WI高信号持续存在,10周后才基本消失。分析其最初T2高信号是水肿和(或)髓鞘脱失所致,症状好转后的T2仍呈高信号则可能是纤维胶质增生引起。Dervisoglu等[7]报道 1例CPM 治疗6 d后症状逐渐恢复,ADC值的恢复同临床症状的恢复基本是平行的,而T2WI上高信号持续存在,4个月后异常高信号才基本消失,提示DWI更有助于预测CPM的预后。
同时DWI有助于CPM与脑桥区其他中枢神经系统疾病相鉴别,如脑肿瘤、急性播散性脑脊髓炎和多发性硬化等,其ADC值均有不同程度的增高[10],而神经精神症患者的ADC值基本正常。脑桥急性期梗死虽然DWI呈显着高信号,ADC值明显减低,与急性期CPM相似,但梗死病灶范围常位于脑桥的一侧(图3),与CPM 病灶对称性分布不同;并且结合有无高血压、TIA及基底动脉血栓等临床病史,两者不难鉴别。
综上所述,DWI成像在描述CPM早期病变范围和提示预后方面更具优越性。不但能够从形态学角度观察病变,而且可以从分子微观水平对病变的功能代谢方面进行深入研究,从而能更好地指导临床诊治,以提高治愈率,改善生活质量。
[1] Warach S,Boska M,Welch KM.Pitfalls and potential of clinical diffusion-weighted M R imaging in acute stroke[J].Stroke,1997,28(3):481-482.
[2] McKee AC,Winkelman MD,Banker BQ.Central pontine myelinolysis in severely burned patients:relationship to serum hyperosmolality[J].Neurology,1988,38(8):1211-1217.
[3] Niehaus L,Kulozik A,Lehmann R.Reversible central pontine and extrapontine myelinolysis in a 16-year-old girl[J].Childs Nerv Syst,2001,17(4-5):294-296.
[4] Musana AK,Yale SH.Central pontine myelinolysis:case series and review[J].WMJ,2005,104(6):56-60.
[5] 邓榕,陈胜利,周杰,等.脑桥中央和脑桥外髓鞘溶解症1例报道[J].重庆医学,2009,38(2):245-246.
[6] Cramer SC,Stegbauer KC,Schneider A,et al.Decreased diffusion in central pontine myelinolysis[J].Am J Neuroradiol,2001,22(8):1476-1479.
[7] Dervisoglu E,Yegenaga I,Anik Y,et al.Diffusion magnetic resonance imaging may provide prognostic information in osmotic demyelination syndrome:report of a case[J].Acta Radiol,2006,47(2):208-212.
[8] Ruzek KA,Campeau NG,Miller GM.Early diagnosis of central pontine myelinolysis with diffusion-weighted imaging[J].Am J Neuroradiol,2004,25(2):210-213.
[9] Provenzale JM,Engelter ST,Petrella JR,et al.Use of MR exponential diffusion-weighted images to eradicate T2“shine-through” effect[J].Am J Roentgenol,1999,172(2):537-539.
[10]Schaefer PW,Grant PE,Gonzalez RG.Diffusion-weighted M R imaging of the brain[J].Radiology,2000,217(2):331-345.



