李翠花,慕江兵△,刘新宇
(辽宁医学院:1.研究生学院;2.第一附属医院 121000)
脂肪栓塞综合征(fat embolism syndrome,FES)是脂肪颗粒阻塞血管腔而引起一系列病理生理改变的临床综合征。多见于创伤,尤其是长骨或骨盆骨折的严重并发症,发病率为3%~33%,病死率为5%~15%。其主要症状为呼吸困难、低氧血症、无头部创伤的神经症状和皮肤黏膜出血点。至今其确切发病机制仍未完全明了。目前的学说有:机械阻塞理论、“生物化学”理论、炎症反应理论、凝结理论、细胞凋亡理论[1]。无特异性有效治疗手段,多以积极预防及对症治疗为主。现将本研究选用丹参注射液山莨菪碱联合应用预防FES的实验结果报道如下。
1 材料与方法
1.1 材料及仪器 选择雄性健康SD大鼠100只,体质量(280±20)g,购自辽宁医学院实验动物中心;油酸(oleic acid,OA,国药集团化学试剂有限公司);丹参注射液10mL/支(四川开和制药);山莨菪碱每支10mg(天津药业焦作有限公司);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒(武汉博士德);血气分析仪、Varian3700气相色谱仪。
1.2 FES大鼠模型制作 按随机数字表法将大鼠分为丹参注射液组、山莨菪碱组、丹参注射液及山莨菪碱联用组、模型组,每组25只,用10%水合氯醛溶液(0.3mL/100g)腹腔注射麻醉。麻醉后,将大鼠俯卧固定于手术板上,OA 0.2mL/kg从尾静脉注入。丹参注射液组、山莨菪碱组、联用组在给予OA注射的同时分别给予丹参注射液0.4mL/kg,山莨菪碱2mg/kg、丹参注射液0.2mL/kg加山莨菪碱1mg/kg药物的静脉注射。静脉注射药物前及注射药物后1、2、3、4h各组随机抽取5只大鼠处死并留取血及肺组织标本。
1.3 指标检测 (1)PaO2测定:各时间点颈动脉置管取血0.5mL肝素抗凝,胶塞封闭针头,用AVL995自动血气分析仪测定;(2)血清游离脂肪酸(free fatty acid,FFA)测定:自股静脉抽取肝素抗凝静脉血1.0mL,高速离心后,分离出血浆0.4 mL,行血浆FFA分析(气相色谱法);(3)各个时间点采取静脉血用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELSA)法测定TNF-α含量;(4)肺组织形态学观察:各组取栓塞前及用药后4h的肺组织用10%甲醛浸泡,逐级组织脱水后,石蜡包埋,行HE染色,光镜下观察。
1.4 统计学处理 应用SPSS17.0统计软件进行统计学数据处理,计量资料以±s表示,组间比较采用ANOVA方差分析,以P<0.05为差异有统计学意义。
2 结 果
4组大鼠脂肪栓塞造模前、后PaO2变化、血浆TNF-α及血清FFA见表1~3。
表1 4组大鼠脂肪栓塞造模前、后PaO2变化(±s,mm Hg)
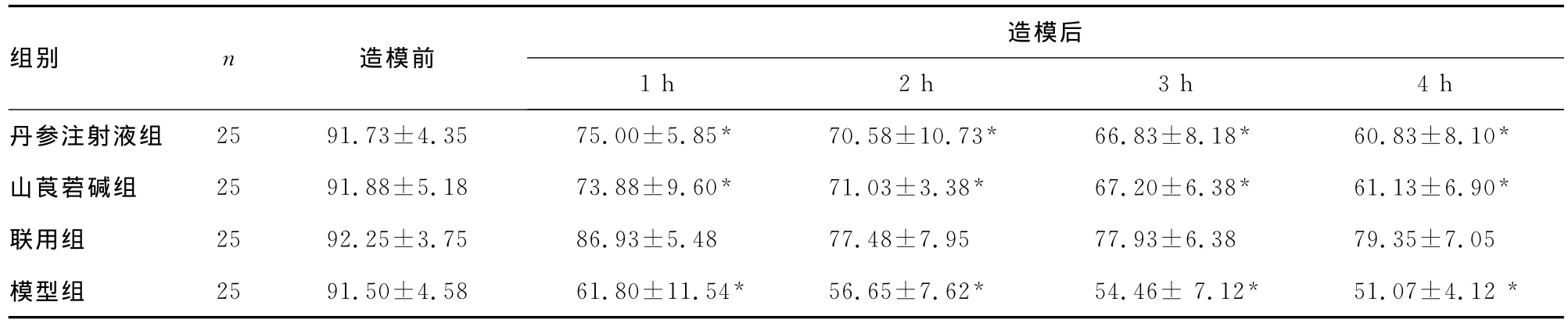
表1 4组大鼠脂肪栓塞造模前、后PaO2变化(±s,mm Hg)
*:P<0.05,与联用组同时点比较。
造模后组别 n 造模前1h 2h 3h 4h丹参注射液组 25 91.73±4.35 75.00±5.85* 70.58±10.73* 66.83±8.18* 60.83±8.10*山莨菪碱组 25 91.88±5.18 73.88±9.60* 71.03±3.38* 67.20±6.38* 61.13±6.90*联用组 25 92.25±3.75 86.93±5.48 77.48±7.95 77.93±6.38 79.35±7.05模型组 25 91.50±4.58 61.80±11.54* 56.65±7.62* 54.46±7.12* 51.07±4.12*
表2 4组大鼠脂肪栓塞造模前、后血浆TNF-α的变化(±s,mg/L)
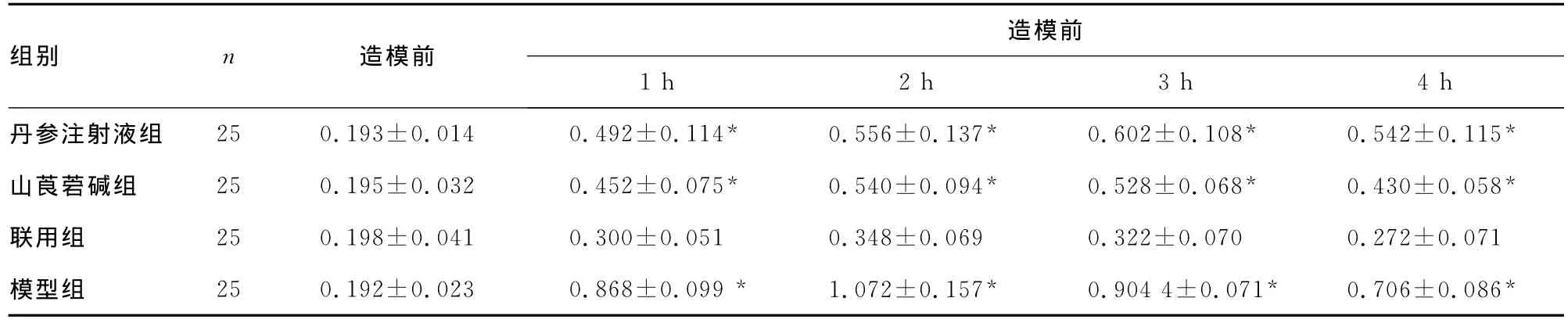
表2 4组大鼠脂肪栓塞造模前、后血浆TNF-α的变化(±s,mg/L)
*:P<0.05,与联用组同时点比较。
造模前组别 n 造模前1h 2h 3h 4h丹参注射液组 25 0.193±0.014 0.492±0.114* 0.556±0.137* 0.602±0.108* 0.542±0.115*山莨菪碱组 25 0.195±0.032 0.452±0.075* 0.540±0.094* 0.528±0.068* 0.430±0.058*联用组 25 0.198±0.041 0.300±0.051 0.348±0.069 0.322±0.070 0.272±0.071模型组 25 0.192±0.023 0.868±0.099* 1.072±0.157* 0.904 4±0.071* 0.706±0.086*
表3 4组大鼠脂肪栓塞造模前、后血清FFA的变化(±s,υg/mL)
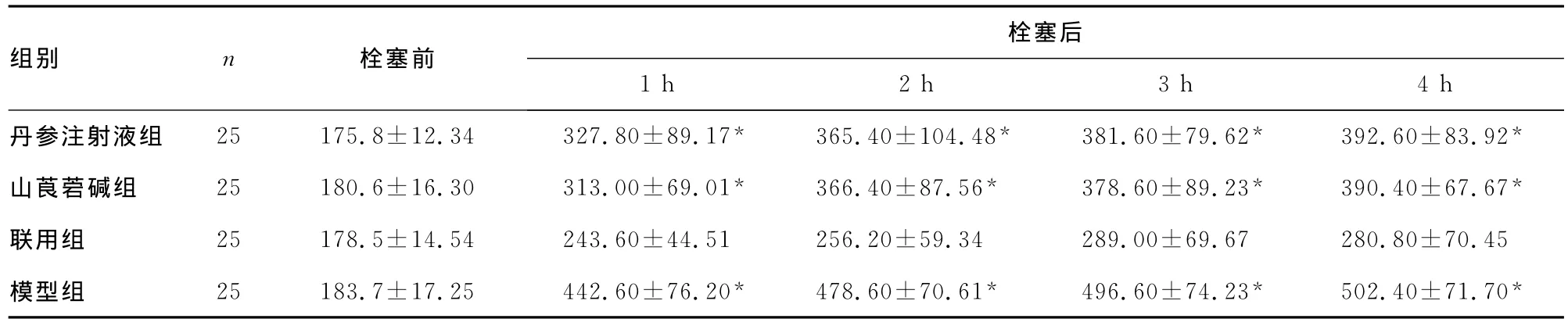
表3 4组大鼠脂肪栓塞造模前、后血清FFA的变化(±s,υg/mL)
*:P<0.05,与联用组同时点比较。
栓塞后组别 n 栓塞前1h 2h 3h 4h丹参注射液组 25 175.8±12.34 327.80±89.17* 365.40±104.48* 381.60±79.62* 392.60±83.92*山莨菪碱组 25 180.6±16.30 313.00±69.01* 366.40±87.56* 378.60±89.23* 390.40±67.67*联用组 25 178.5±14.54 243.60±44.51 256.20±59.34 289.00±69.67 280.80±70.45模型组 25 183.7±17.25 442.60±76.20* 478.60±70.61* 496.60±74.23* 502.40±71.70*
3 讨 论
油酸在医学动物实验中常被用于制作脂肪栓塞综合征、急性肺损伤和急性呼吸窘迫综合征(acute respiratory distress syndrom,ARDS)模型。用油酸复制大鼠的FES模型组织病理学改变与人相似,是一种较成熟、可靠的方法。本实验注入OA量的选择参考了蔡贤华等[2]的研究,选择了0.2mL/kg为注入量。注射OA前PaO2为(91.50±4.57)mm Hg、注射OA后1h时PaO2降为(61.80±11.54)mm Hg,说明PaO2变化明显。结合病理学检查见栓塞肺毛细血管内皮肿胀,血管壁增厚,肺间质和肺泡出现明显充血、水肿,大量炎症细胞及吞噬细胞浸润等改变,与陈阳等[3]报道家兔脂肪栓塞后肺部病理变化相符,提示本实验FES动物模型复制成功。
FES的病变主要在肺部,表现为急性肺损伤,进一步发展为ARDS,临床表现以低氧血症为主。因此,目前大多数学者公认,PaO2是早期诊断FES的可靠且敏感指标之一,减轻肺组织损伤提高PaO2是治疗FES的关键[4]。FFA可发生于任何创伤和应激性疾病,具有化学毒作用,可影响肺Ⅱ型细胞产生表面活性物质。Nakata等[5]研究发现,主要由中性粒细胞介导FFA可使肺毛细管通透性升高,因而发生水肿、出血、肺不张和纤维蛋白沉积,形成肺实变,使低氧血症发生恶性循环。本研究显示,脂肪栓塞后血PaO2急剧下降,血FFA浓度明显增加。各用药物组较模型组能不同程度地减小血PaO2的下降趋势和降低血FFA浓度,差异有统计学意义(P<0.05)。联用组的效果要明显好于丹参注射液组和山莨菪碱组。组织学检查结果与之相对应,即各用药组均能降低FES引起的肺部病理改变,联合用药组肺部病变最轻。丹参注射液、山莨菪碱对FES均有一定的疗效,此结果与文献报道一致[6-7]。可能是两种药物均能改善微循环,进而减轻脂肪栓在微血管区局部聚集及分解为FFA而产生毒性作用。复方丹参注射液能抗氧自由基、阻止钙离子向细胞内流动、扩张血管[8],抑制巨噬细胞产生前列腺素E2及血栓素B,降低全血黏度、抑制血小板和中性粒细胞黏附凝集作用,促进纤维蛋白降解[9];山莨菪碱具有扩张微血管,稳定溶酶体膜的作用,还能改善FES受损的血管张力,降低脂质过氧化物,从而降低肺毛细血管内通透性。此外,研究报道细胞水通道蛋白对肺水肿的形成起重要作用,水通道蛋白1(aquaporin 1,AQP1)存在于大鼠肺泡Ⅱ型细胞膜上,可减轻压力性肺水肿的程度[10],AQP5主要发现在肺泡Ⅰ型细胞的顶膜面及气道分泌腺细胞上[11],与肺泡Ⅰ型上皮细胞跨膜水分子转运关系密切,参与肺泡腔内液体的重吸收。丹参可调节AQP1表达[12],山莨菪碱调节增加AQP1、AQP5的表达量[13],加强了细胞膜的水通透性,减轻肺间质水液潴留状态及胶原纤维增生等病理改变,减轻肺水肿,改善机体缺氧状态。
Park等[4]研究发现,FES患者肺内的促炎介质、炎症介质受体及其拮抗剂均增加。即FES患者可以出现全身性炎症反应综合征[14-15]。因此,清除血液中参与全身性炎症反应综合征发生、发展的炎症因子,成了目前关注的治疗热点。本研究显示,脂肪栓塞后TNF-α较栓塞前大量释放,各用药组均能抑制TNF-α的释放,与模型组比较差异有统计学意义(P<0.05),联用组效果优于丹参注射液组和山莨菪碱组。TNF-α主要由巨噬细胞分泌,能诱导中性粒细胞、单核巨噬细胞分泌IL-8、IL-6、IL-1等炎症介质并能协同扩大其生物学效应,是介导机体炎症反应的关键因子。简文等[16]研究山莨菪碱可抑制肺泡巨噬细胞中核因子κB的活化,下调TNF-αmRNA的转录及蛋白的合成,巨噬细胞中核因子κB是一种具有多向性转录调节作用的蛋白质因子,能与多种炎症递质基因启动子或增强子中存在的κB序列结合,启动和调节其基因转录。丹参注射液中的有效成分丹参酮也有一定的抗炎、抗白细胞趋化和聚集等作用[17],能降低炎症反应时循环中 TNF-α的浓度[18-19]。
综上所述,丹参注射液、山莨菪碱均具有一定的预防大鼠FES作用,联合用药组改善微循环和炎症反应综合征的作用更明显。可能与脂肪栓塞综合征发病机制多因素有关,两种药物联用有相加或协同的效应,阻断了FES发生的多个病理环节。其机制有待进一步研究证明。
[1]陆慰萱,王辰.肺循环病学[M].北京:人民卫生出版社,2007:514-518.
[2]蔡贤华,吴璐锋.低分子右旋糖酐与地塞米松预防脂肪栓塞综合征的实验研究[J].创伤外科杂志,2011,13(5):434-437.
[3]陈阳,焦传军.家兔肺脂肪栓塞后超微病理学观察[J].法医学杂志,2011,27(3):174-177.
[4]Park WY,Goodman RB,Steinberg KP,et al.Cytokine balance in the lungs of patients with acute respiratory distress syndrome[J].Am J Respir Crit Care Med,2001,164(10):1896-1903.
[5]Nakata Y,Dahms TE.Triolein increases microvascular permeability in isolated perfused rabbit lungs:role of neutrophils[J].J Trauma,2000,49(2):320-326.
[6]顾章平,马承宣,张伯勋.丹参注射液在脂肪栓塞综合征防治中的作用[J].中华外科杂志,1994,32(11):692-695.
[7]周智勇,赵学琴,高富贵,等.山莨菪碱对脂肪栓塞综合征的防治作用[J].中华急诊医学杂志,2004,13(11):742-744.
[8]罗礼容,汤军,李丽,等.复方丹参注射液对家兔油酸性急性肺损伤的防治作用[J].临床和实验医学杂志,2008,7(4):48-49.
[9]秦彩玲,刘婷,张毅,等.复方丹参方对正常家兔血浆血小板粘聚性及TXA2、PGI2的影响[J].中国实验方剂学杂志,2002,8(3):18-20.
[10]李涛平,申海燕,刘琳.油酸肺损伤时肺泡Ⅱ型上皮细胞钠水通道的研究[J].南方医科大学学报,2006,26(7):918-935.
[11]Ito K,Mizutani A,Kira S,et al.Effect of Ulinastatin,a human urinary trypsin inhibitor,on the oleic acid-induced acute lung injury in rats via the inhibition of activated leukocytes[J].Injury,2005,36(3):387-394.
[12]李敏,李锋,胡波,等.丹参对大鼠急性肺损伤的保护作用[J].中药材,2007,30(4):442-444.
[13]王石生,颜春松,饶伟华,等.山莨菪碱增加急性肺损伤大鼠肺组织AQP1和AQP5表达[J].基础医学与临床,2009,29(10):1110-1112.
[14]Pape HC,Zelle BA,Hildebrand F,et al.Reamed femoral nailing in sheep:does irrigation and aspiration of intramedullar contents alter the systemic response[J].Bone Joint Surg Am,2005,87(11):2515-2522.
[15]Stroud MH,McCarthy RE,Parham DM,et al.Fatal pulmonary fat embolism following spinal fusion surgery[J].Pediatr Crit Care Med,2006,7(3):263-266.
[16]简文,樊爱琳,尹文,等.山莨菪碱治疗兔创伤性急性肺损伤分子生物学机制的实验研究[J].第四军医大学学报,2008,29(11):985-987.
[17]沈鹰,黄清春,接力刚,等.复方丹参治疗类风湿性疾病的研究[J].华南国防医学杂志,2007,21(6):15-18.
[18]罗友根.丹参对油酸引起的急性肺损伤治疗作用的实验研究[J].河南职工医学院学报,2005,17(6):328-329.
[19]曹春水,黄亮.复方丹参对早期急性肺损伤炎症介质的影响[J].江西医药,2007,42(3):208-211.



