张晓飞,杨 康,苏先旭
(四川省都江堰市人民医院胸外科 611830)
胃癌是中国常见的恶性肿瘤之一,根治性手术是可切除胃癌的首选治疗方法,但术后5年生存率为20%~50%,分析原因主要是因为胃的多种淋巴引流途径使得术中淋巴结清扫术实施难度较大,这就导致胃癌术后有很高的局部复发率和转移率[1-2]。术后化疗是预防复发和转移的主要方法,但是效果仍不能令人满意,因此选择有效的化疗方案特别重要。本研究应用奥沙利铂联合替吉奥对比XELOX方案治疗行R0切除术、D2淋巴结清扫术的胃癌患者,现报道如下。
1 资料与方法
1.1 一般资料 选取本院2008年1月30日至2010年5月30日行全胃或胃大部R0切除术、D2淋巴结清扫术的患者81例,年龄34~82岁,平均(63.3±4.2)岁。应用随机数字表法将患者分为治疗组和对照组,其中治疗组41例,对照组40例。具体入组标准:(1)所有患者经病理证实为胃腺癌,经影像学检查排除远处转移;(2)治疗前心电图正常,白细胞超过3.5×109/L,中性粒细胞超过1.5×109/L,血小板超过100×109/L,肌酐小于上限正常值1.5倍;(3)卡氏评分(KPS)≥70分,预计生存时间大于或等于6个月;(4)患者或家属签署治疗知情同意书;(5)治疗方案经医院伦理委员会批准。两组患者一般资料比较差异无统计学意义(P>0.05)。
1.2 治疗方法 奥沙利铂联合替吉奥方案:奥沙利铂(生产厂家江苏恒瑞医药股份有限公司,批号H20000337)130mg/m2,加入5%葡萄糖注射液250mL,静脉滴注180min,每3周用1次。替吉奥胶囊(生产厂家大鹏药品工业株式会社德岛工厂)40mg/m2口服,1天2次,连用14d。
XELOX方案具体为:奥沙利铂(生产厂家江苏恒瑞医药股份有限公司,批号H20000337)130mg/m2加入5%葡萄糖注射液250mL中,静脉滴注180min,每3周用1次。卡培他滨(生产厂家上海罗氏制药有限公司,批号H20073024)1 000 mg/m2口服,1天2次,连用14d。
治疗组患者行“奥沙利铂联合替吉奥”方案化疗,对照组接受XEOLX方案化疗,所有患者均接受6~8个周期的化疗。化疗过程中同时给予抑酸、保肝、止吐等对症治疗,如出现不良反应,则对症处理。每化疗2个周期行影像学检查评价疗效,如疾病进展则退出本研究,可入组其他临床试验或接受其他治疗或最佳支持治疗。
1.3 评价标准 观察患者的无复发生存期(recurrence free survival,RFS)、总生存期(overall survival,OS)及不良反应。RFS指化疗结束第1天至首次出现复发或转移或失访患者的末次联系日期的时间,OS指化疗结束第1天至死亡日期或失访患者的末次联系日期的时间。随访方法:患者放疗结束后第1年每3个月,第2年每4个月复查CT或MRI。不良反应按美国癌症研究所常见毒性判定标准(NCI-CTC)3.0版进行评定。
1.4 统计学处理 采用SPSS 13.0统计软件进行数据处理,率和构成比的比较采用χ2检验,生存分析采用Kaplan-Meier法。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者化疗完成情况 治疗组41例共完成304个周期化疗,对照组40例患者共完成298个周期化疗。两组患者的完成情况差异无统计学意义(P>0.05)。
2.2 生存分析 随访截至2012年5月30日,所有患者均随访2年,其中治疗组失访2例,对照组失访1例,随访率为96.3%。治疗组与对照组的1年和2年RFS分别为51.3%和61.5%,25.6%和20.5%。1年和2年OS分别为64.1%和69.2%,30.8%和25.6%,两组患者的1年和2年RFS、OS比较差异无统计学意义(P>0.05),见表1。
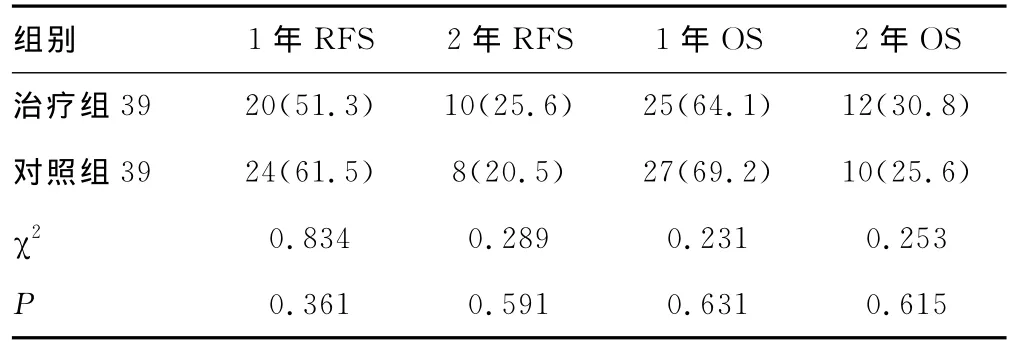
表1 治疗组和对照组患者的RFS和OS比较[n(%)]
2.3 不良反应 治疗组和对照组的不良反应主要表现为骨髓抑制(白细胞下降、血小板下降和贫血)、胃肠道反应(恶心、呕吐及腹泻)、手足综合征、口腔黏膜炎、末梢神经毒性及肝、肾功能损伤。但不良反应主要为1级和2级,4级不良反应少见,所有不良反应经对症治疗后均好转,未出现治疗相关性死亡。对照组手足综合征的发生率明显高于治疗组,差异有统计学意义(P=0.001),见表2。
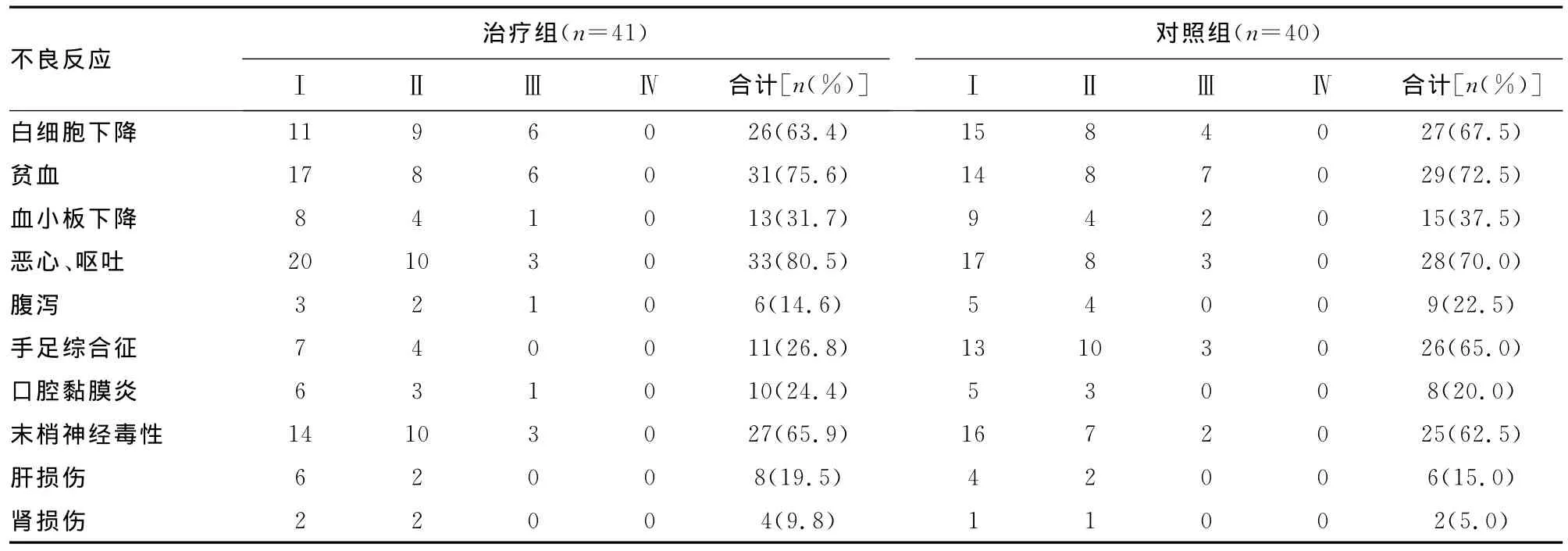
表2 治疗组和对照组不良反应比较(n)
3 讨 论
目前胃癌患者即使行根治性手术,术后的转移和复发仍是导致患者生存率不高的主要原因。虽然大部分学者认为术后辅助化疗可以提高生存率,但是仍有一些研究得出了不同的结论。Zhao等[3]对15个随机对照组研究进行回顾性分析发现,术后辅助化疗相对于单纯手术而言,5年生存率无明显优势,同时比较6个化疗方案在胃癌术后辅助化疗中的作用无明显区别。但是近年的两项荟萃分析[4]显示,胃癌术后辅助化疗可以提高3年和5年生存率,改善无疾病生存(DFS),并降低复发率,但这些荟萃分析在采用的方法、选择的化疗方案存在诸多的差异,因此尚不能确定标准的辅助化疗方案及胃癌术后辅助化疗的效果如何。那么胃癌术后该如何治疗?如果是术后行化疗,那么该选择哪种化疗方案比较合适呢?
最近日本的ACTS-GC研究[5]选取行D2切除的1 059例胃癌患者,随机分为术后单药替吉奥化疗组和观察组,随访3年总生存率化疗组和观察组分别为80.1%和70.1%,替吉奥组患者死亡风险下降了32.0%,3年无复发生存率为72.0%,而观察组为59.6%,这一令人鼓舞的结果首次肯定了单药在胃癌术后辅助化疗中的地位。Sun等[6]对12项随机对照研究进行荟萃分析显示,对于行D1以上根治术后的胃癌患者,行术后辅助化疗能使死亡风险较单纯手术者降低22%,由于该研究剔除了仅含T1期或仅行D0手术的研究,且纳入标准严格,故结果较为可信,更具有指导意义。
既然术后辅助化疗意义确定,那么该如何选择化疗方案呢?长期以来,5-氟尿嘧啶和顺铂是胃癌化疗最常用的治疗方案之一,二者联合应用对胃癌有很好的协同作用,但其有效率仅为30%~50%。影响5-FU疗效的药物浓度与时间关系中,时间是主要因素,静脉注射后可在短时间内获得较高的血药浓度,但存在半衰期短,脂溶性低,不良反应增加,且顺铂的胃肠道不良反应较大,对于行胃癌根治术的患者更容易加重恶心、呕吐等胃肠道不良反应,患者耐受性下降,严重时不能完成化疗[7]。奥沙利铂是继顺铂、卡铂之后的第3代铂类抗肿瘤药物,能迅速与DNA牢固结合,作用更强,且其与顺铂和卡铂无交叉耐药,具有更广谱的抗癌活性,与卡铂、顺铂比较,奥沙利铂的骨髓抑制和消化道反应和肝肾毒性发生率较低,虽然奥沙利铂有神经毒性,但是停药后即可恢复。
卡培他滨与替吉奥都属于5-FU前体药物,希罗达能够模拟持续输注5-Fu抗肿瘤作用,在肝脏内转化为5-DFCR,在肝脏和实体瘤内被高度表达的胞苷脱氨酶转化为5-DFUR,最后5-DFUR进入肿瘤组织被含量较高的胸腺嘧啶磷酸化酶(TP)转化为具有抗肿瘤活性的5-FU,这就提高了癌细胞内药物浓度而达到高效的靶向治疗目的,且明显减少了全身的毒性作用[8]。替吉奥由替加氟、吉美嘧啶(CDHP)及奥替拉西钾(OXO)按一定比例构成,其中CDHP能抑制二氢嘧啶脱氢酶,阻止5-FU被降解,使半衰期长达12h,而OXO能够特异性抑制肠道黏膜细胞内乳清酸核糖转移酶,阻断5-FU的磷酸化,使5-FU的磷酸化产物降低而减少其胃肠道不良反应[9]。本研究中应用奥沙利铂联合替吉奥和奥沙利铂联合卡培他滨方案辅助治疗胃癌术后患者,结果总生存期和无复发生存期均无明显差异,但是奥沙利铂联合替吉奥组的手足综合征的发生率明显下降。这说明两药在胃癌术后辅助化疗中的效果相当,但是仍需进一步的研究,选择更为有效的方案,为胃癌的术后辅化疗提供依据。
[1] Zhang J,Chen RX,Zhang J,et al.Efficacy and safety of neoadjuvant chemotherapy with modified FOLFOX7regimen on the treatment of advanced gastric cancer[J].Chin Med J,2012,125(12):2144-2150.
[2] Vasilescu C,Popa M,Tudor S,et al.Robotic surgery of locally advanced gastric cancer-an initial experience[J].Acta Chir Belg,2012,112(3):209-212.
[3] Zhao SL,Fang JY.The role of postoperative adjuvant chemotherapy following curative resection for gastric cancer:a meta-analysis[J].Cancer Invest,2008,26(3):317-325.
[4] Liu TS,Wang Y,Chen SY,et al.An updated meta-analysis of adjuvant chemotherapy after curative resection for gastric cancer[J].Eur J Surg Oncol,2008,34(11):1208-1216.
[5] Sakuramoto S,Sasako M,Yamaguchi T,et al.Adjuvant chemotherapy for gastric cancer with S-1,an oral floropyrimidine[J].N Engl J Med,2007,357(18):1810-1820.
[6] Sun P,Xiang JB,Chen ZY.Meta-analysis of adjuvant chemotherapy after radical surgery for advanced gastric cancer[J].Br J Surg,2009,96(1):6-33.
[7] Unek IT,Unek T,Oztop I.Bimonthly regimen of highdose leucovorin,infusional 5-fluorouracil,epirubicin and cisplatin(Modified ECF)as adjuvant chemotherapy in resected gastric adenocarcinoma[J].Chemotherapy,2012,58(3):233-240.
[8] Chen S,Feng X,Li Y,et al.Efficacy and safety of XELOX and FOLFOX6adjuvant chemotherapy following radical total gastrectomy[J].Oncol Lett,2012,3(4):781-786.
[9] Liu B,Ying J,Luo C,et al.S-1combined with oxaliplatin as first line chemotherapy for chinese advanced gastric cancer patients[J].Hepatogastroenterol,2012,59(114):649-653.



