曾 源,杨 威,张小强,李 斌,董 啸
(南昌大学医学院第二附属医院心胸外科,江西南昌 330006)
前B细胞克隆增强因子(PBEF)是一种具有调控炎症、糖脂代谢、氧化应激和细胞凋亡等多种作用的分子,并参与内皮血管形成、心脏保护效应、炎症和免疫应答等[1-2]。PBEF通过抑制中性粒细胞凋亡、介导炎症因子产生、调控肺血管上皮细胞和内皮细胞的通透性等途径在急性肺损伤中起到非常重要的作用[3-4]。本研究建立大鼠模型以分析PBEF在体外循环(CPB)术后肺血管内皮通透性增加中的机制,现报道如下。
1 材料与方法
1.1 动物模型和分组 动物模型由南昌大学心血管病研究所提供,成熟雄性昆明种小鼠,体质量250~300g。进行动物分组,每组10组,对照组:大鼠只进行麻醉、CPB插管,不行CPB转流;A组:大鼠行慢病毒AD-PBEFshRNA转染;B组:大鼠进行30min深低温停循环;C组:大鼠行慢病毒AD-PBEF-shRNA转染后,再进行30min深低温停循环。
1.2 方法
1.2.1 组织标本采集 大鼠处死后取右肺前叶用于肺组织湿干重比的测定,右肺中后叶固定于4%甲醛溶液中,乙醇脱水,石蜡包埋,切片成4μm厚。组织脱蜡后,用苏木精和伊红染色供病理观察。取左肺等分置于两个冻存管中,放入-80℃液氮中急冻保存,留待 Western blotting和酶联免疫吸附试验(ELISA)检测。
1.2.2 Western blotting和ELISA检测 Western blotting检测:取出-80℃保存左肺组织,提取细胞总蛋白,电泳转膜,进行一抗和二抗结合反应,避光室温振摇孵育1h,洗膜,荧光系统扫描,以β-actin作为内参照,计算机记录每个条带的灰度积分值,以样品积分值/内参照积分值比值进行统计学分析。检测包括PBEF表达,磷酸化P38MAPK、磷酸化ERK、磷酸化MLC、磷酸化VE-cadherin、磷酸化FAK表达。ELISA检测:取大鼠外周血标本5mL,3000r/min离心10min,取上清液储于-80℃冰箱保存。取出血清并稀释,再用浓缩洗涤液稀释,加入底物显示液,在酶标板上与单抗结合,在相应的波长处测各孔吸光度(A)值,求平均值。检测包括MMP2/9和VEGF表达水平。
表1 PBEF、P38MAPK、ERK、MLC、VE-cadherin和FAK表达结果(,n=10)
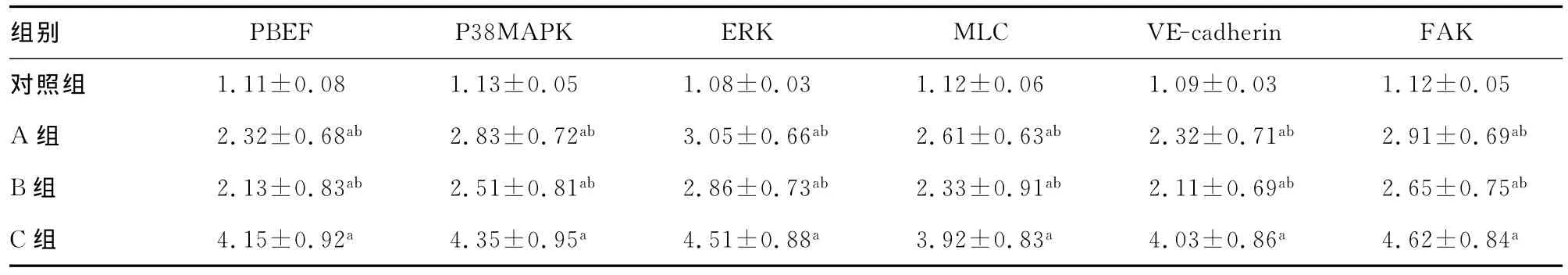
表1 PBEF、P38MAPK、ERK、MLC、VE-cadherin和FAK表达结果(,n=10)
a:P<0.05,与对照组比较;b:P<0.05,与C组比较。
组别9±0.03 1.12±0.05 A组 2.32±0.68ab 2.83±0.72ab 3.05±0.66ab 2.61±0.63ab 2.32±0.71ab 2.91±0.69ab B组 2.13±0.83ab 2.51±0.81ab 2.86±0.73ab 2.33±0.91ab 2.11±0.69ab 2.65±0.75ab C组 4.15±0.92a 4.35±0.95a 4.51±0.88a 3.92±0.83a 4.03±0.86a 4.62±0.84 PBEF P38MAPK ERK MLC VE-cadherin FAK对照组 1.11±0.08 1.13±0.05 1.08±0.03 1.12±0.06 1.0 a
1.2.3 肺组织湿干重比(W/D) 右肺前叶肺组织称湿重后,置入70℃烤箱内,烘烤24h至恒重,称干重,计算W/D比值。
1.3 统计学处理 应用SPSS13.0统计软件进行处理,计量资料以表示,采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 PBEF、P38MAPK、ERK、MLC、VE-cadherin和FAK表达结果 A、B组的PBEF、磷酸化P38MAPK、磷酸化ERK、磷酸化MLC、磷酸化VE-cadherin、磷酸化FAK表达与对照组和C组比较差异有统计学意义(P<0.05);C组的PBEF、磷酸化P38MAPK、磷酸化ERK、磷酸化 MLC、磷酸化 VE-cadherin、磷酸化FAK表达与对照组比较差异有统计学意义(P<0.05)。见表1。
2.2 VEGF、MMP2、MMP9和 W/D表达结果 A、B组的MMP2、MMP9与对照组和C组比较差异有统计学意义(P<0.05);A组的VEGF、W/D与对照组和C组比较差异有统计学意义(P<0.05);B组的VEGF、W/D与C组比较差异有统计学意义(P<0.05)。见表2。
表2 VEGF、MMP2、MMP9和 W/D表达结果(,n=10)
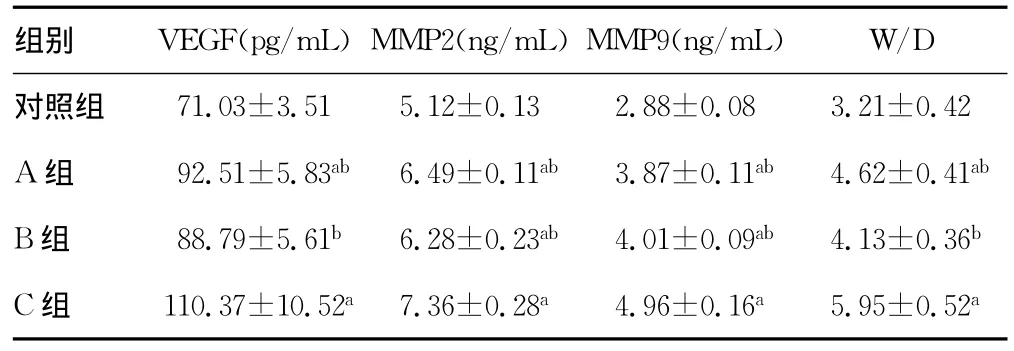
表2 VEGF、MMP2、MMP9和 W/D表达结果(,n=10)
a:P<0.05,与对照组比较;b:P<0.05,与C组比较。
组别 VEGF(pg/mL)MMP2(ng/mL)MMP9(ng/mL) W/D 71.03±3.515.12±0.132.88±0.083.21±0.42 A组 92.51±5.83ab 6.49±0.11ab 3.87±0.11ab 4.62±0.41ab B组 88.79±5.61b 6.28±0.23ab 4.01±0.09ab 4.13±0.36b C组 110.37±10.52a7.36±0.28a4.96±0.16a5.95±0.52对照组a
2.3 病理结构改变 病理结果显示,光镜下对照组大鼠肺组织结构清晰,无中性粒细胞浸润,肺泡壁薄。C组可见严重肺组织病理损害,肺损伤程度重,肺间质高度充血,大量中性粒细胞浸润,小支气管和小静脉上皮细胞脱落,大部分肺泡间显着增宽,肺泡腔部分萎缩,部分融合成肺大泡,腔内有红细胞,形成微血栓,而且会随着时间的延长逐渐加重。A、B组较C组有不同程度的减轻,A组的程度是最低的。
3 讨 论
CPB技术是开展心脏外科心内直视手术的必备条件,但是CPB带来的CPB术后肺功能障碍是人们不得不面对的一个难题[5-7]。肺缺血再灌注损伤的发生以及全身炎症反应是目前公认的主要的CPB术后肺损伤发生机制。研究CPB术后肺损伤的分子机制有利于开发新的治疗策略和新的防治药物,减少CPB术后肺功能障碍的发生。
PBEF是B细胞早期分化的一种生长因子,具有促进前B细胞向B细胞转化的能力。研究表明炎症细胞因子会促进细胞内PBEF的表达,应用RNAi技术抑制PBEF表达能够完全消除炎症细胞因子对中性粒细胞的抗凋亡作用[8-9]。报道指出在急性肺损伤动物模型的血清、肺组织及支气管肺泡灌洗液中PBEF的基因表达明显增加[10]。通过降低PBEF蛋白表达可以减少内皮细胞的跨膜电阻,减少肌球蛋白轻链磷酸化和形成肌动蛋白,减少钙离子的流动,从而改善凝血酶刺激造成的内皮细胞屏障功能障碍,减少急性肺功能损伤的发病率。PBEF过表达会延长炎症反应时间,增加肺泡上皮细胞核肺血管内皮细胞的通透性,释放炎症因子引发肺损伤。李洁[11]研究发现重症急性胰腺炎发生相关肺损伤时,PBEF过表达而启动白细胞介素(IL)-8、IL-1β和肿瘤坏死因子-α(TNF-α)等炎性细胞因子大量表达,在急性肺损伤中发挥重要作用。本研究制备模型大鼠并分组检测,发现C组的PBEF、磷酸化P38MAPK、磷酸化ERK、磷酸化MLC、磷酸化VE-cadherin、磷酸化FAK表达与A、B组和对照组比较差异有统计学意义(P<0.05),可见PBEF高表达影响了磷酸化P38MAPK、磷酸化ERK、磷酸化MLC、磷酸化VE-cadherin、磷酸化FAK表达。P38MAPK、ERK是增殖信号通路中的关键分子,PBEF可能通过这些分子诱导VEGF和MMP2/9的表达。本研究中C组VEGF、MMP2、MMP9与A、B组和对照组比较差异有统计学意义(P<0.05)。有研究[12-15]报道VEGF在肾综合征出血热发病中的作用发现患者血管通透性增高可能与休克期VEGF高表达有关。本研究病理结果显示,C组肺组织病理损害严重,A、B组较C组有不同程度的减轻。
综上所述,PBEF通过P38MAPK、ERK等途径调控磷酸化MLC、磷酸化VE-cadherin、磷酸化FAK表达,而且依赖MAPK/PI3K-Akt/VEGF信号转导通路来诱导VEGF 和MMP2/9的表达,增加CPB术后肺血管内皮通透性。
[1]李斌,董啸.PBEF基因的分子生物学特征及其在急性肺损伤中作用的研究进展[J].山东医药,2011,51(3):111-112.
[2]路强,崔巍,高伟,等.PBEF及CD31在增殖性糖尿病视网膜病变视网膜前膜中的表达[J].内蒙古医学杂志,2011,43(12):1409-1411.
[3]Li Calzi S,Neu MB,Shaw LC,et al.Endothelial progenitor dysfunction in the pathogenesis of diabetic retinopathy:treatment concept to correct diabetes-associated deficits[J].EPMA J,2010,1(1):88-100.
[4]彭倩宜,艾宇航,张丽娜.前B细胞集落增强因子在炎症相关性疾病中的作用[J].国际病理科学与临床杂志,2012,32(4):335-342.
[5]Park JW,Kim WH,Shin SH,et al.Visfatin exerts angiogenic effects on human umbilical vein endothelial cells through the mTOR signaling pathway[J].Biochim Biophys Acta,2011,1813(5):763-771.
[6]明广峰.PBEF在重症急性胰腺炎并发急性肺损伤中的作用机制研究[D].长沙:中南大学,2012.
[7]毕静.梓醇和前B细胞克隆增强因子的神经保护作用[D].大连:大连理工大学,2011.
[8]李斌,董啸,徐建军,等.无血预充大鼠深低温停循环模型的建立[J].中华实验外科杂志,2011,28(1):129.
[9]郑伟浩,赵英萍,莫红缨,等.辛伐他汀对脂多糖诱导肺损伤大鼠的肺血管通透性的影响[J].中华临床医师杂志:电子版,2011,5(21):6451-6453.
[10]Eyileten T,Sonmez A,Saglam M,et al.Effect of reninangiotensin-aldosterone system(RAAS)blockade on visfatin levels in diabetic nephropathy[J].Nephrology(Carlton),2010,15(2):225-229.
[11]李洁.前B细胞克隆增强因子(PBEF)在急性胰腺炎肺损伤大鼠肺组织中的表达与功能及清胰汤干预的实验研究[D].大连:大连医科大学,2010.
[12]李彧.VEGF介导的血管内皮通透性增高的分子机制及其在肾综合征出血热发病中的作用[D].西安:第四军医大学,2011.
[13]Kincer JF,Uittenbogaard A,Dressman J,et al.Retraction:hypercholesterolemia promotes a CD36-dependent and endothelial nitric-oxide synthase-mediated vascular dysfunction[J].J Biol Chem,2013,288(9):6584.
[14]Wang A,Li C,Liao J,et al.Ceramide mediates inhibition of the Akt/eNOS pathway by high levels of glucose in human vascular endothelial cells[J].J Pediatr Endocrinol Metab,2013,26(1/2):31-38.
[15]Hagberg C,Mehlem A,Falkevall A,et al.Endothelial fatty acid transport:role of vascular endothelial growth factor B[J].Physiology(Bethesda),2013,28(2):125-134.



