王晓进,危小良,张 希,刘云奇
(1.中山大学附属第五医院胸心外科,广东珠海 519000;2.中山大学附属第五医院心内科,广东珠海 519000;3.中山大学附属第一医院心脏外科,广东广州 510080)
重组人促红细胞生成素预处理对体外循环手术中心肌的保护作用
王晓进1,危小良2,张 希3△,刘云奇3
(1.中山大学附属第五医院胸心外科,广东珠海 519000;2.中山大学附属第五医院心内科,广东珠海 519000;3.中山大学附属第一医院心脏外科,广东广州 510080)
目的探讨重组人促红细胞生成素(rHuEPO)预处理对体外循环(CPB)手术中心肌的保护作用、机制及安全性。方法选择30例拟行瓣膜置换术的风湿性心脏病患者,将其分为观察组和对照组,观察组术前2d给予皮下注射rHuEPO 300 IU/kg,1次/天,共2d;对照组给予等量生理盐水。检测术前及术后第7天血常规,以及术前、主动脉开放后6、24、72h血清肌酸激酶同工酶(CK-MB)、肌钙蛋白T(cTnT)水平。术毕心肌活检,检测心肌细胞凋亡指数。记录CPB时间、主动脉阻断(ACC)时间、ICU停留时间、输血及术后并发症情况。结果两组患者术后CK-MB、cTnT均于主动脉开放后显着升高,术后6h数值最高,其后呈下降趋势。术后各时点观察组CK-MB、cTnT水平均低于对照组,rHuEPO处理主效应两组间差异有统计学意义(P=0.01)。心肌细胞凋亡指数观察组明显低于对照组,差异有统计学意义(P<0.01)。观察组没有导致术后血红蛋白(Hb)、血细胞比容(Hct)明显升高和增加血栓栓塞的风险,并减少术后输血量。结论rHuEPO预处理对CPB手术中的心肌具有保护作用,可减少心肌细胞凋亡,具有安全可靠性。
红细胞生成素,重组;心肌;细胞保护;再灌注损伤;体外循环
缺血再灌注损伤是一种普遍存在的病理、生理现象,在体外循环(CPB)心脏停搏直视手术中,心肌的缺血再灌注损伤会引起术后并发症,例如:低心排综合征、围术期心律失常、多脏器功能衰竭等,严重者甚至危及生命。虽然目前临床上已有联合采取以高钾心脏停搏、低温、预防心肌水肿、心室充分减压为主的多种心肌保护措施,术后效果仍然不理想,需要改进心肌保护的综合措施。红细胞生成素(erythropoietin,EPO)是机体在缺氧缺血的状态下,主要由肾脏分泌,临床上已经广泛用于治疗肾性贫血,除具有参与调节红细胞的增殖、分化、成熟的功能外,还具有多种生物效应。动物实验提示,EPO对神经细胞及视网膜细胞有保护作用[1-2]。随机性临床实验表明,重组人促红细胞生成素(rHuEPO)可以改善急性心肌梗死和慢性心力衰竭患者的心功能及有利于心室重构[3-4]。为探讨rHuEPO预处理在CPB手术中是否有心肌保护作用,机制怎样,安全性如何,本文于2010年8月至2011年3月选择在中山大学附属第一医院心脏外科择期行人工瓣膜置换术的风湿性心脏病患者,采用rHuEPO预处理,并探讨其对CPB手术中心肌的保护作用、机制及安全性。
1 资料与方法
1.1 一般资料 选择2010年8月至2011年3月在中山大学附属第一医院心脏外科行择期人工瓣膜置换术的风湿性心脏病患者30例。其中男14例,女16例;年龄23~72岁,平均(45.87±11.36)岁。入选标准:具有人工瓣膜置换术手术指征的风湿性心脏病患者,既往无EPO治疗史,无手术禁忌证。告知患者rHuEPO预处理知情权并签字同意。排除标准:(1)除心功能外有其他脏器功能严重障碍者;(2)糖尿病患者;(3)二级以上高血压患者;(4)有血栓栓塞病史者;(5)恶性肿瘤患者;(6)同期行房颤射频消融术或冠状动脉旁路移植术(CABG)患者;(7)感染性心内膜炎患者;(8)术前血红蛋白(Hb)>160g/L,血细胞比容(Hct)>50%者。将30例患者分为观察组和对照组,每组15例。观察组:男8例,女7例,rHuEPO预处理,二尖瓣置换12例,双瓣置换3例;对照组:男6例,女9例,做空白对照,二尖瓣置换11例,双瓣置换4例;两组患者年龄、体质量、性别、心功能、术前左心室射血分数(LVEF)、Hb等临床指标差异均无统计学意义(P>0.05),见表1。
表1 两组患者术前一般资料比较(±s)
表1 两组患者术前一般资料比较(±s)
组别 年龄(岁) 体质量(kg)术前LVEF(%)术前Hb(g/L)观察组 45.13±12.31 52.87±7.86 61.53±8.87 132.20±18.32对照组 46.47±10.84 50.63±8.28 59.67±7.61 128.47±13.61
1.2 方法
1.2.1 预处理方法 观察组:在术前2d给予皮下注射rHuEPO(益比奥,沈阳三生制药)300IU/kg,1次/天,共2d;对照组:给予同等量的生理盐水。两组其他均按瓣膜病常规术前准备相同,调整心功能,葡萄糖-胰岛素-钾极化液(GIK液)心肌营养。
1.2.2 麻醉及手术方法 术前30min肌内注射吗啡0.1 mg/kg,东莨菪碱0.3mg。麻醉诱导用咪达唑仑、依托咪酯、舒芬太尼、顺式阿曲库胺,气管插管后实施舒芬太尼、丙泊酚静脉复合麻醉,吸入七氟醚,顺式阿曲库胺维持肌松。肝素化后依次于主动脉、上下腔静脉插管,主动脉根部插灌注针,右上肺静脉置入左心引流管,阻断上下腔静脉,心表冰屑降温,阻断升主动脉,灌注冷血含钾停跳液,首次20mL/kg,心脏停搏。浅低温(28~32℃)转机,主动脉阻断超过30min,再次半量灌注停搏液,采用Edward Affinity成人型膜式氧合器。术中常规超滤,灌注流量60~80mL·kg-1·min-1,灌注压维持在60~90mm Hg。均采用美国ATS公司机械瓣膜,间断褥式缝合,左心系统操作结束后开放升主动脉,复温至36.5℃,循环稳定后停CPB。
1.2.3 观察指标 (1)手术前及术后第7天采静脉血测定血常规记录 Hb、Hct。(2)手术前及主动脉开放后6、24、72h(各时点分别记为T0、T6、T24、T72)采取静脉血,采用电化学发光法分别测定血清肌酸激酶同工酶(CK-MB)及肌钙蛋白T(cTnT)水平。(3)停机时右心耳心肌活检,免疫组织化学检测,采用末端脱氧核苷酰转移酶介导的三磷酸脱氧尿甘缺口末端生物素标记(TUNEL)细胞凋亡原位检测试剂盒,严格按试剂盒操作步骤进行,最后苏木素染色,光学显微镜观察凋亡细胞,400倍镜下计数10个视野,计算细胞凋亡指数(AI)=凋亡细胞数/视野所有细胞总数×100%。(4)记录各组CPB时间、主动脉阻断(ACC)时间、输血量、ICU停留时间及不良事件的发生情况(血栓栓塞、心律失常、低心排综合征等)。在Hct<25%时,给予输注红细胞。术后1周复查心脏彩色多普勒超声,记录LVEF值。
1.3 统计学处理 所有数据采用SPSS13.0统计软件进行分析,计量数据资料采用±s表示,根据数据特点:重复测量资料采用重复测量的方差分析方法统计分析;满足正态分布和方差齐性时行两组独立样本的t检验,方差不齐时行矫正t检验;非正态分布行两组独立样本的Wilcoxon秩和检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者手术相关指标比较 两组患者CPB时间、ACC时间、术后心律失常(观察组3例,对照组5例)、ICU停留时间、术后1周LVEF比较,差异均无统计学意义(P>0.05),见表2。两组患者均顺利出院,均无死亡、血栓栓塞及继发性高血压发生。
表2 两组患者手术相关指标比较(±s)

表2 两组患者手术相关指标比较(±s)
组别 CPB时间(min) ACC时间(min) ICU(d) 术后LVEF(%)观察组 109.67±27.98 66.20±18.42 1.67±0.72 55.93±10.48对照组 116.00±27.74 70.67±23.20 1.97±0.64 53.07±6.43
2.2 两组患者各个时点的血清cTnT、CK-MB水平比较 两组患者术前cTnT、CK-MB水平差异无统计学意义(P>0.05);术后均于主动脉开放后显着升高,T6时点数值最高,其后呈下降趋势。术后各时点观察组CK-MB、cTnT水平均低于对照组,两组比较差异有统计学意义(rHuEPO处理主效应P=0.01,时间主效应P<0.01)。处理主效应和时间效应的交互作用,两组患者比较差异有统计学意义(P=0.009),见表3。
表3 两组患者血清cTnT、CK-MB水平比较(±s,ng/mL)
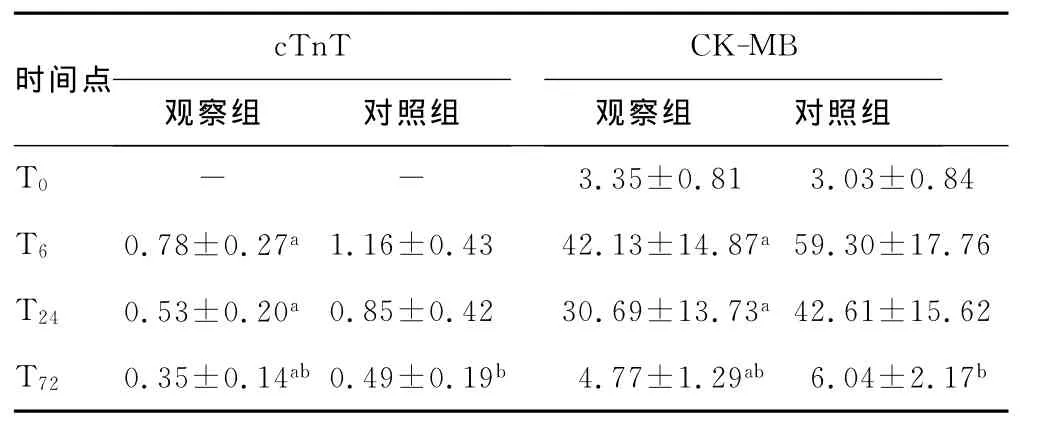
表3 两组患者血清cTnT、CK-MB水平比较(±s,ng/mL)
a:P<0.05,与对照组比较;b:P<0.05,与 T6 比较;-:测量值小于检测标准。
cTnT CK-MB时间点观察组 对照组T0观察组 对照组3.35±0.81 3.03±0.84 T6 0.78±0.27a1.16±0.43 42.13±14.87a59.30±17.76 T24 0.53±0.20a0.85±0.42 30.69±13.73a42.61±15.62 T72 0.35±0.14ab 0.49±0.19b 4.77±1.29ab 6.04±2.17--b
2.3 两组患者心肌AI比较 观察组心肌细胞AI明显低于对照组,二者差异有统计学意义(P<0.01)。两组患者手术用血量[浓缩红细胞(cRBC)]比较,观察组术后输血量少,差异有统计学意义(P<0.05)。术后1周两组患者 Hb、Hct比较,差异无统计学意义(P>0.05),见表4。
表4 两组患者心肌细胞AI及手术输血等比较(±s)

表4 两组患者心肌细胞AI及手术输血等比较(±s)
组别 心肌细胞AI(%) 输cRBC(U) 术后Hb(g/L) 术后Hct(%)3.00±1.07 5.00±1.31 127.00±8.37 39.28±3.05对照组 6.73±1.49 6.93±2.25 123.07±6.51 38.06±2.32 P<0.01 <0.05 >0.05 >0.05观察组
3 讨 论
CPB心脏停跳的状态下完成心脏手术引起心肌的缺血再灌注损伤,增加术后出现低心排综合征、围术期心律失常、心肌梗死等并发症的概率[5]。CPB转流中人工管道对补体的激活,导致血管内皮功能障碍、炎症细胞及炎症因子大量释放均可导致心肌细胞损伤。心肌在缺血缺氧的状态下,三磷酸腺苷(ATP)的产生受到抑制,引起心肌细胞膜蛋白、线粒体等细胞器功能改变。当心肌恢复血流灌注时,因为氧反常、钙反常、pH反常、炎症细胞聚集,进一步加重心肌细胞功能障碍,破坏心肌细胞结构,称为心肌再灌注损伤。CK-MB是肌酸激酶的同工酶,几乎仅存于心肌细胞中,是诊断心肌损害的一个公认的敏感性指标,早期诊断颇有价值[6]。cTnT特异存在于心肌细胞肌原纤维丝中肌钙蛋白复合物T亚单位,在心肌受损后能快速释放入血,在心肌损伤中具有高度的特异性和敏感性。二者作为重要的心肌损伤标志物可以用以诊断、预后判断及疗效评价[7]。本研究比较观察组和对照组手术后的心肌损伤标志物,结果显示,cTnT、CK-MB水平术后均于主动脉开放后显着升高,术后各时点观察组CK-MB、cTnT水平均低于对照组,rHuEPO处理主效应P=0.01,这说明rHuEPO预处理可以减轻心肌细胞的损伤程度,具有心肌保护作用。rHuEPO能有效减轻CPB手术中心肌缺血再灌注损伤。
Renzi等[8]动物研究提示,EPO保护作用是通过抗凋亡途径实现的。抗凋亡是通过以下信号通路实现的:(1)EPO与EPOR结合,引起酪氨酸激酶(JAK2)磷酸化并活化,引起下游信号转导和转录激活因子-3/5(STAT-3/5)等信号通路的磷酸化,促进细胞内的内皮型一氧化氮合酶(eNOS)及环氧合酶-2(COX-2)翻译表达,最终减少细胞的程序性死亡,抑制靶细胞凋亡[9]。(2)激活磷脂酰肌醇3激酶(PI3K),丝氨酸/苏氨酸蛋白激酶(Akt),Akt进一步激活eNOS促进抗凋亡的关键因子一氧化氮(NO)产生,参与调控细胞周期和细胞凋亡等[10]。(3)活化ERK1/2后可以激活eNOS和鸟甘酸环化酶及蛋白激酶C,发挥抗氧化、抗凋亡等保护作用[11]。(4)EPO可以增强细胞抗凋亡基因bel-2表达,抑制促凋亡基因caspase-3表达[12]。以上均从信号转导机制上阐述了EPO抗凋亡途径,为临床研究提供了基础理论依据。本研究通过测定心肌AI,检测结果显示CPB下的心肌缺血再灌注可以引起心肌细胞凋亡,但rHuEPO预处理比对照组明显减少凋亡,二者的差异有统计学意义(P<0.05)。说明rHuEPO可通过抗凋亡作用,减少心肌细胞损伤,发挥心肌保护作用。秦川等[13]报道EPO预处理可以明显提高缺血再灌注大鼠心肌抗氧化酶的活性,包括超氧化物歧化酶、过氧化氢酶,从而减轻缺血再灌注引起的氧化应激,减少膜氧化损伤。本研究对心肌损伤特性标志物CKMB、cTnT的水平进行分析,结果提示rHuEPO预处理能明显降低二者的血清水平,间接说明心肌细胞破坏减少,可能与rHuEPO能维持心肌细胞膜稳定性有关。
rHuEPO可以增加Hct及Hb水平,引起高血压和血栓形成,部分患者出现癫痫发作,发热、呕吐、感觉异常、呼吸急促等相关并发症[14]。本研究结果表明,术前rHuEPO 300IU/kg,1次/天,共2d,没有导致术后Hb、Hct明显升高和增加血栓栓塞的风险,而且减少了术后输血量。与对照组比较,观察组输血量明显减少(P<0.05)。说明在临床治疗中适当剂量的rHuEPO,可以发挥rHuEPO的组织保护作用同时,促红细胞生成,减少异体输血带来的各种风险和并发症,支持rHuEPO当前剂量在CPB手术中的安全性。
[1]Kumral A,Uysal N,Tugyan K,et al.Erythropoietin im-proves long-term spatial memory deficits and brain injury following neonatal hypoxia-ischemia in rats[J].Behav Brain Res,2004,153(1):77-86.
[2]Grimm C,Wenzel A,Groszer M,et al.HIF-1-induced erythropoietin in the hypoxic retina protects against light-induced retinal degeneration[J].Nat Med,2002,8(7):718-724.
[3]Mancini DM,Katz SD,Lang CC,et al.Effect of erythropoietin on exercise capacity in patients with moderate to severe chronic heart failure[J].Circulation,2003,107(2):294-299.
[4]Ponikowski P,Anker SD,Szachniewicz J,et al.Effect of darbepoetin alfa on exercise tolerance in anemic patients with symptomatic chronic heart failure:a randomized,double-blind,placebo-controlled trial[J].J Am Coll Cardiol,2007,49(7):753-762.
[5]Becke LC,Ambrosio G.Myocardial consequences of reperfusion[J].Prog Cardiovasc Dis,1987,30(1):23-44.
[6]De Paulis R,Colagrande L,Seddio F,et al.Levels of troponin I and cardiac enzymes after reinfusion of shed blood in coronary operations[J].Ann Thorac Surg,1998,65(6):1617-1620.
[7]Giannitsis E,Becker M,Kurz K,et al.High-sensitivity cardiac troponin T for early prediction of evolving non-ST-segment elevation myocardial infarction in patients with suspected acute coronary syndrome and negative troponin results on admission[J].Clin Chem,2010,56(4):642-650.
[8]Renzi MJ,Farrell FX,Bittner A,et al.Erythropoietin induces changes in gene expression in PC-12cells[J].Brain Res Mol Brain Res,2002,104(1):86-95.
[9]Kawakami M,Sekiguchi M,Sato K,et al.Erythropoietin receptor-mediated inhibition of exocytotic glutamate release confers neuroprotection during chemical ischemia[J].J Biol Chem,2001,276(42):39469-39475.
[10]Chong ZZ,Kang JQ,Maiese K,et al.Erythropoietin fosters both intrinsic and extrinsic neuronal protection through modulation of microglia,Akt1,Bad,and caspasemediated pathways[J].Br J Pharmacol,2003,138(6):1107-1118.
[11]Baker JE,Kozik D,Hsu AK,et al.Darbepoetin alfa protects the rat heart against infarction:dose-response,phase of action,and mechanisms[J].J Cardiovasc Pharmacol,2007,49(6):337-345.
[12]吴锦波,吴平生,张宏斌,等.促红细胞生成素对大鼠心肌缺血再灌注损伤的影响[J].临床心血管病杂志,2009,25(11):862-865.
[13]秦川,肖颖彬,陈林,等.促红细胞生成素预处理在心肌缺氧复氧损伤中的抗炎作用[J].四川医学,2010,31(2):161-163.
[14]Henry DH,Bowers P,Romano MT,et al.Epoetin alfa.Clinical evolution of a pleiotropic cytokine[J].Arch Intern Med,2004,164(3):262-276.
Myocardial protective effects of recombinant human erythropoietin pretreatment on patients undergoing cardiopulmonary bypass
WangXiaojin1,WeiXiaoliang2,ZhangXi3△,LiuYunqi3
(1.DepartmentofCardiothoracicSurgery,FifthAffiliatedHospital,SunYat-senUniversity,Zhuhai,Guangdong519000,China;2.DepartmentofCardiology,FifthAffiliatedHospital,SunYat-senUniversity,Zhuhai,Guangdong519000,China519000;3.DepartmentofCardiacSurgery,FirstAffiliatedHospital,SunYat-senUniversity,Gangzhou,Guangdong510080,China)
ObjectiveTo investigate the myocardial protective effects,mechanism and safety of recombinant human erythropoietin(rHuEPO)pretreatment in the patients undergoing cardiac surgery with cardiopulmonary bypass(CPB).MethodsThirty patients with rheumatic heart disease undergoing valve replacement surgery were randomly divided into the observation group and the control group,15cases in each group.The observation group was given rHuEPO 300IU/kg by hypodermic injection on preoperative 2d,once daily for twice.The control group was given the same dose of normal saline.The blood routine was performed before surgery and on postoperative 7d.The levels of creatine kinase isoenzyme(CK-MB)and troponin T(cTnT)were detected before operation,at 6,24,72hafter the aorta opening(T0,T6,T24,T72).At the end of CPB,myocardial biopsy was conducted for detecting the myocardial apoptosis index(AI).The CPB time,aortic cross clamp(ACC)time,postoperative ICU stay,blood transfusion and postoperative complications were recorded.ResultsThe level of postoperative CK-MB and cTnT in the two groups were significantly increased after the aorta opening,which at T6was highest,followed by a downward trend.The levels of CK-MB and cTnT at various time points in the observation group were significantly lower than those in the control group.The main effect of rHuEPO pretreatment had statistical difference between the two groups(P=0.01).Myocardial AI in the observation group was significantly lower than that in the control group,the difference showing statistical significance(P<0.01).The observation group had no risk leading to obviously increase postoperative Hb,Hct values and thromboembolism,but the postoperative blood transfusion amount was reduced.ConclusionrHuEPO pretreatment has the protective effect on myocardium in the patients undergoing cardiac surgery under CPB,which can reduce myocardial apoptosis and has safe reliability.
erythropoietin,recombinant;myocardium;cytoprotection;reperfusion injury;cardiopulmonary bypass
10.3969/j.issn.1671-8348.2014.10.011
A
1671-8348(2014)10-1187-03
王晓进(1978-),主治医师,硕士研究生,主要从事心肌缺血再灌注研究。△
,Tel:(020)87755766-8238;E-mail:zhangxisysu@163.com。
2013-09-18
2013-12-29)
论着·临床研究



