吕铁伟,孙慧超,张 蕾,刘玲娟,吴晓云,刘晓燕,朱 静,刘振国,田 杰△
(1.重庆医科大学儿童医院心血管内科,重庆 400014;2.儿童发育疾病研究省部共建教育部重点实验室/儿科学重庆市重点实验室/重庆市儿童发育重大疾病诊治与预防国际科技合作基地,重庆 400014;3.美国俄亥俄州立大学医学中心,哥伦布 43210)
大鼠骨髓间充质干细胞(rat bone marrow mesenchymal stem cells,MSCs)是经过实验室纯化的单一干细胞株,已经被证明能够诱导转化为具有内皮功能的成熟内皮细胞[1],其可以作为以内皮受损或功能失调为基础病理改变的动脉粥样硬化和冠心病等心血管疾病的根治种子细胞。而氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)是导致动脉粥样硬化和冠心病等心血管疾病发生发展的重要因素,Oct-4(octamer binding transcription factor-4)是高表达于干细胞的八聚体转录因子,能够维持干细胞自我更新的能力,而在干细胞定向分化的过程中表达逐渐减弱甚至消失,是当前公认的干细胞表面标记之一。本文以MSCs为研究对象,拟在MSCs体外培养过程中加入ox-LDL进行干预,明确其对MSCs增殖能力和Oct-4表达情况的影响及可能机制。
1 材料与方法
1.1 材料 MSCs为俄亥俄州立大学医学中心刘振国实验室分离和提纯的细胞株,细胞培养体系包括低糖DMEM培养液(Gibco)、MCDB、ITS、LA-BSA、L-ascorbic acid、EGF(均购自Sigma)、PDGF(R&D Systems)、β-Mercaptoethanol(Fisher公司)、LIF(Esgro公司)和青/链霉素(Cellgro公司),ox-LDL及天然低密度脂蛋白(native low density lipoprotein,nLDL)为俄亥俄州立大学医学中心Sam′s实验惠赠,蛋白免疫印迹法(West blot)检测 Oct-4、Bcl-2相关试剂及抗氧化剂乙酰半胱氨酸(N-acetylcycteine,NAC)购自Santa Cruz公司。
1.2 方法
1.2.1 MSCs培养传代 本研究将MSCs以100~200/cm2的密度接种于玻璃培养皿中,置入37℃、5%CO2和5%O2的孵箱中培养,一般2~3h细胞即贴壁生长,细胞培养24~48h后在细胞相互接触之前,采用胰酶消化传代细胞,每个培养皿中加入胰酶1mL消化细胞,收集细胞于10mL试管中,4℃1500r/min离心,培养基混悬细胞,计数,以低密度(100~200/cm2)接种于新的培养皿放入孵箱继续培养备用。
1.2.2 ox-LDL影响细胞增殖能力的检测 MSCs被分为4组:ox-LDL组,在培养基中加入不同浓度(1、5、10、20μg/mL)的ox-LDL;ox-LDL+NAC组,采用抗氧化剂 NAC预处理后再在培养基中加入ox-LDL;阴性对照组,在培养基中加入相对应浓度的nLDL;对照组,MSCs放在正常培养不加其他任何干预因素;ox-LDL组分别在培养基加入终浓度分别为1、5、10、20μg/mL的ox-LDL;nLDL组则加入与ox-LDL相对应浓度的nLDL;在细胞培养的第12、24和48小时收集3组细胞,计数并绘制生长曲线,每实验组要求的样本量分别为3个。
1.2.3 检测细胞凋亡相关蛋白Bcl-2及Oct-4的表达 采用蛋白提取试剂盒提取不同时间点细胞总蛋白,分光光度计测定蛋白浓度,按照蛋白印迹技术检测Bcl-2和Oct-4的表达,首先进行变性十二烷基硫酸钠-聚丙稀酰胺凝胶电泳(SDSPAGE),放入电转系统恒流转膜2h后,5%脱脂奶粉室温封闭1h,封闭结束后加入相对应的一抗于4℃孵育过夜,TBST洗膜后加二抗(辣根过氧化物酶标记的与一抗相对应的种属特异性二抗)室温震荡孵育1h,TBST洗膜后加入化学发光剂室温孵育3min,暗室中进行定影显影,采用凝胶图形分析软件对特异性条带进行灰度扫描和定量分析,蛋白的灰度值用内参GAPDH进行校正。
1.2.4 氧化活性产物(ROS)检测 采用电子顺磁震荡(EPR)技术检测各组培养基中ROS的含量。首先收集细胞计数,使细胞浓度达到107/mL,每个样本中抽取100μL细胞悬液加入EPR微小玻璃吸管中,再置于EPR仪器进行检测,每个样本重复进行3次测定,描绘各组的EPR信号,统计EPR信号强度并进行对比。
1.3 统计学处理 采用SPSS15.0软件进行数据处理,曲线及直方图采用Sigmaplot软件绘制,计量资料以表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 细胞培养阶段的形态 将 MSCs以低密度(100~200/cm2)接种培养在氧含量为5%的CO2孵箱中,大约2~3h后细胞全部贴壁,贴壁细胞在倒置显微镜下呈梭形、圆形或不规则形状,细胞体积大,细胞核明显,细胞间互不接触,培养48h后细胞增殖明显增加,几乎铺满培养皿底部,细胞间形成接触。
2.2 ox-LDL影响MSCs增殖能力的检测结果 细胞培养皿底部面积约为53cm2,每个培养皿总接种细胞数约为(1~2)×104,加6mL基础培养基进行培养,培养48h后细胞数量约扩增为4×105个,大约扩增20倍,传代后细胞仍保持同样的扩增能力。细胞生长曲线结果显示ox-LDL对 MSCs增殖的抑制作用与培养时间和干预浓度呈正相关:与正常培养细胞相比,浓度为1μg/mL的ox-LDL使 MSCs增殖速度稍有降低,但差异无统计学意义(P<0.05),而浓度为5μg/mL和10μg/mL时则导致 MSCs的增殖速度明显减弱(5μg/mL时P<0.05,10 μg/mL 时 P <0.01),其 中,10μg/mL 及20μg/mL在培养的不同时间点细胞数量增加极少,到48h细胞增加的量不到初始接种浓度的1倍,见图1,而nLDL组细胞增殖未受影响(结果未显示),NAC预处理后提高了 MSCs的数量,但在ox-LDL浓度为10、20μg/mL时提升效率不明显,差异无统计学意义(P>0.05),而在5μg/mL时,NAC预处理后大大增加了MSCs的数量(P<0.05),见图2。
2.3 不同浓度ox-LDL引起细胞凋亡及对Bcl-2表达水平的影响 在MSCs体外培养过程中,与原代培养的细胞相比,高浓度的ox-LDL明显抑制MSCs的增殖,显微镜下观察细胞数量明显减少,大部分细胞已破碎且失去了细胞完整的结构,见图3;采用Western blot观察ox-LDL干预后不同实验组Bcl-2表达情况发现,与对照组比较,用10μg/mL及以上浓度的ox-LDL进行干预后的细胞抗细胞凋亡蛋白Bcl-2几乎没有出现表达,NAC预处理后则出现Bcl-2的表达,但表达量与对照组比,差异有统计学意义(P<0.05,具体数据未显示),见图4。
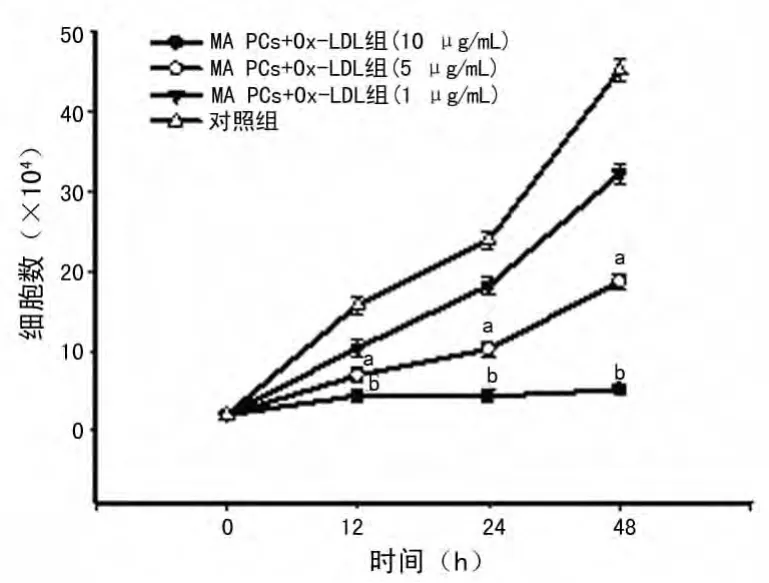
图1 各浓度ox-LDL对MSCs增殖的影响
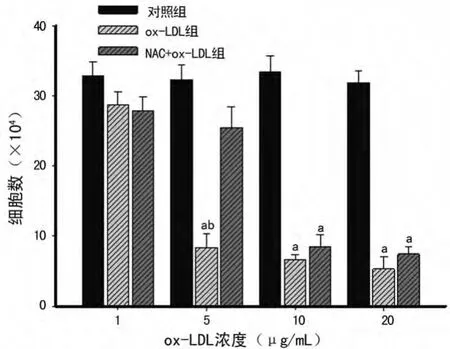
图2 抗氧化剂NAC对ox-LDL处理后MSCs增殖的逆转作用
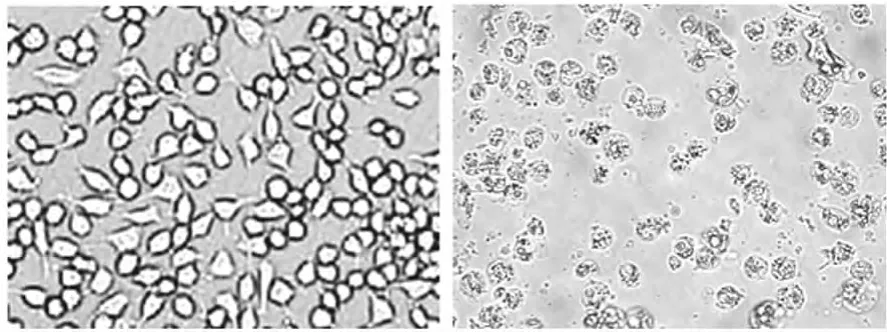
图3 原代培养传代前(左)和ox-LDL干预后(右)细胞形态的改变(×100)
2.4 ox-LDL对干细胞表面标记Oct-4表达水平的影响 本实验采用 Western blot观察ox-LDL对Oct-4表达水平的影响,在细胞体外培养24h,分别提取浓度为5μg/mL的ox-LDL组和对照组细胞蛋白进行检测,结果发现5μg/mL ox-LDL组Oct-4的表达明显减弱,表达相对量仅为对照组的14%左右,差异有统计学意义(P<0.01,具体数据未显示),见图5,10μg/mL及以上浓度的ox-LDL干预后Oct-4的表达更减弱,仅有极微量的表达(结果没有显示),而NAC预处理后Oct-4的表达量恢复接近正常,约为79%。而nLDL组Oct-4的表达却没有受到明显影响。
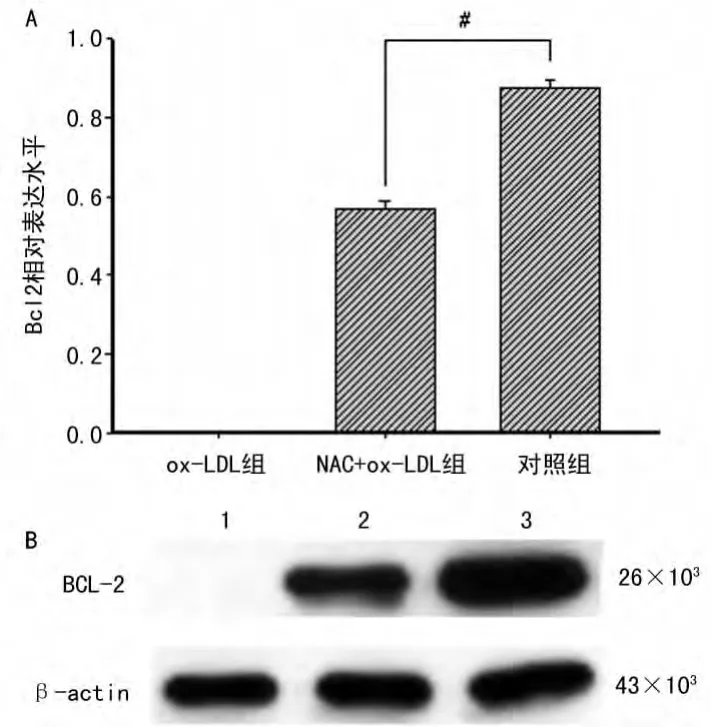
图4 不同实验组Bcl-2的表达
2.5 NAC阻止ox-LDL来源的ROS的产生 EPR技术检测不同实验组培养体系中ROS的形成情况,结果显示对照组没有出现EPR信号,5μg/mL ox-LDL组则出现典型的EPR信号,而ox-LDL+NAC组中则没有检测到EPR信号(图6);ROS的产生具有时间依赖性,当ox-LDL干预MSCs时培养体系中即刻就出现EPR信号,信号表达的强度在ox-LDL干预后60s达到最高峰,以后稳定在高水平状态(图6B);同样ROS的产生是剂量依赖型的,正常培养的细胞体系几乎检测不到EPR信号,而加入ox-LDL干预后的细胞体系EPR信号强度明显增加,且随着ox-LDL干预浓度的增加,EPR信号强度相应增加,但是培养体系经抗氧化剂NAC预处理5min后,即便再加入ox-LDL干预,细胞培养体系中EPR信号强度则明显减弱接近正常细胞水平(图6C),而nLDL组则没有类似现象,说明培养体系中ROS的产生来源于ox-LDL,且ROS产生量与ox-LDL的浓度和作用时间呈正相关,但抗氧化剂NAC预处理后可以完全阻止ox-LDL来源的ROS的产生。
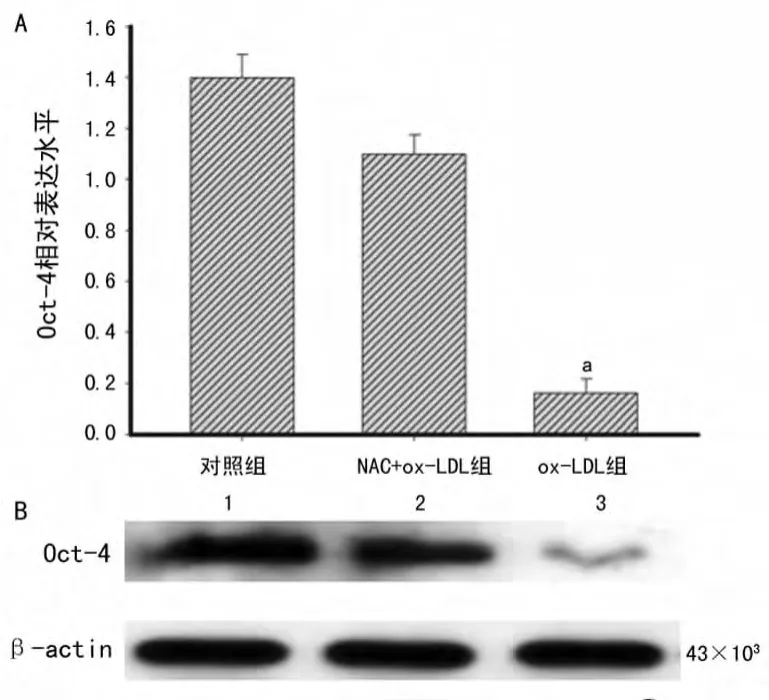
图5 不同组别Oct-4的表达情况
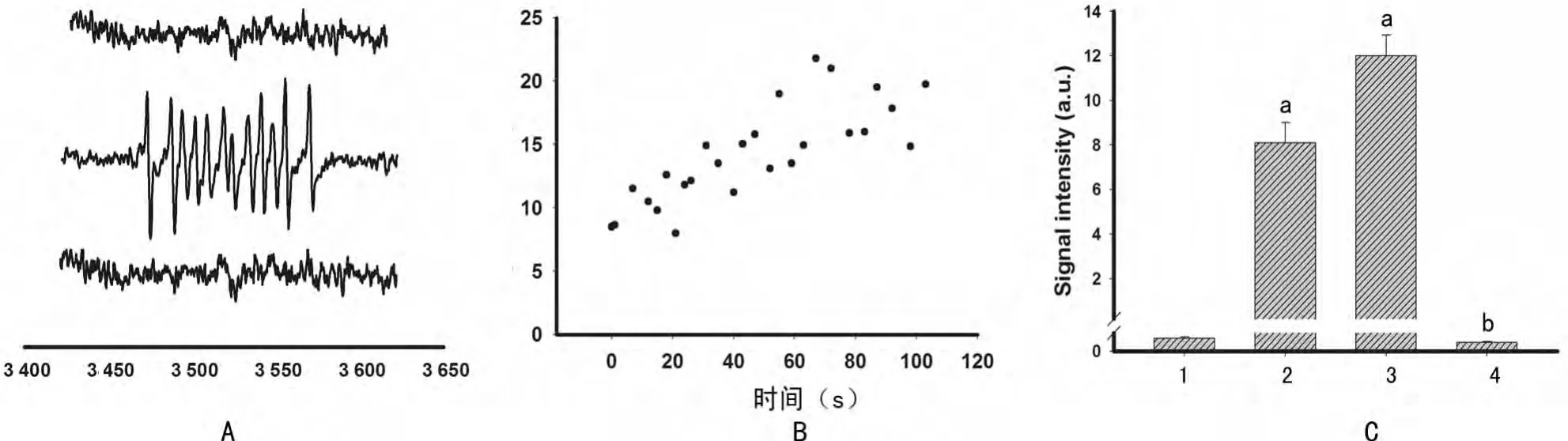
图6 不同组别活性氧产物ROS形成的检测结果
3 讨 论
大鼠骨髓间充质干细胞作为成体干细胞的一种,具有自我更新和多向分化的特点,其存在于骨髓基质中,含量极低(0.1‰),但在体外扩增容易,适宜条件下自身数量能够迅速增加,另外骨髓基质是低氧环境(小于7%),该环境能够维持细胞的无限增殖和自我更新的能力,体外低氧条件下培养能最大限度发挥细胞的生物学特性[2-3]。而体外培养的骨髓间充质干细胞混杂有少量如成纤维细胞等其他细胞群体,这种混杂细胞群体会影响研究的准确性和单一性,因此,本实验所采用的MSCs为俄亥俄州立大学医学中心实验室分离和提纯的细胞株,被认为是单一的干细胞株,经研究发现该细胞群阳性表达Oct-4,Rex-1,c-Kit和 Pdgfr-α,而细胞表面标记 Sca-1,CD34,CD45,Sox-2和 Nanog的表达却为阴性[3];Oct-4属 POU 家族蛋白,是一类在动物早期胚胎发育过程中起重要作用的转录因子,能够维持干细胞的全能性及未分化状态[4]。Oct-4蛋白的主要结构特征为具有POU家族特有的保守结构域(POUs)和POU同源异型结构域(POUHD),这两个结构域可与DNA上特定区域形成双向结合,进而对基因转录进行调控[5]。本实验显示 MSCs高表达Oct-4,当 MSCs受到ox-LDL干预时Oct-4的表达明显降低,细胞的增殖能力显着下降,进一步证实Oct-4是维持干细胞的全能性及未分化状态的关键因素之一。
内皮遍及整个心血管系统,主管血液运输、物质交换和血管活性物质的分泌等功能,内皮的受损或功能失调导致动脉粥样硬化和冠心病等心血管事件的发生和发展[6],故内皮正常功能的重建或内皮再生是严重心血管事件未来治疗的主攻方向。内皮再生来源于循环内皮祖细胞(EPCs),内皮细胞受损或者破坏导致细胞数量减少,可触发循环EPCs的成熟过程,最后EPCs分化为内皮细胞来弥补其数量的不足从而维持心血管内皮系统的正常功能,而EPCs来源于骨髓,其数量和功能与骨髓间充质干细胞状态密切相关;临床上内皮受损或功能失调导致动脉粥样硬化和冠心病等心血管疾病的发生,研究证实这些心血管疾病个体体内EPCs的数量明显减少[6-8],因此,推测可能是某些因素导致骨髓间充质干细胞分化受到抑制,继而内皮细胞的生成数量降低,从而促进严重心血管事件的发生,因此,该过程中相关机制的阐明具有重大的临床和社会意义,也是本研究实施的原始推动力。
多种因素可以引起内皮受损或功能失调,脂代谢紊乱是一大诱因,高脂血症导致内膜受损,脂点脂纹形成,继而出现纤维斑块和粥样斑块。最后导致动脉粥样硬化和冠心病的形成,而ox-LDL和氧化应激是这一过程的物质和病理生理基础,但其作用机制尚不清楚。ox-LDL对靶细胞的作用因细胞类型不同而不同,并且这种作用机制复杂而多变,ox-LDL能够促进巨噬细胞和血管平滑肌细胞的增殖,抑制巨噬细胞及单核细胞的凋亡,但另一方面ox-LDL在抑制内皮细胞和循环EPCs的增殖进而促进巨噬细胞和单核细胞的凋亡[9-10],最近文献又证明ox-LDL同样可以引起内皮的受损[11],但受损的机制尚未阐明;ox-LDL另外一个重要的机制则是ROS的形成和氧化应激。Ox-LDL能够提供ROS的丰富来源,而ROS与组织氧化应激和高血压、动脉粥样硬化等心血管疾病的发生及进展密切相关,ROS和氧化应激在对包括骨髓干细胞在内的干细胞调控发挥重要作用[12-14]。
本研究结果是通过细胞的体外实验获得的,但仍具有紧密的临床相关性,最近的临床研究显示一个健康个体血清中ox-LDL的浓度为7μg/mL,而稳定型冠心病患者血清ox-LDL水平则为17.2μg/mL,急性冠脉综合征患者血清ox-LDL水平更是高达23.6μg/mL,本实验选取的 ox-LDL浓度(1~20μg/mL)在健康和患病个体的平均范围之内进行研究发现,当ox-LDL浓度是1μg/mL时对细胞形态和增殖没有影响,但当其浓度增加,出现了抑制作用,并且这种作用与浓度成剂量依赖性,这就提示ox-LDL在这些心血管事件的发生发展中起促进作用,本实验中采用抗氧化剂NAC预处理来对抗ox-LDL对细胞的抑制作用,根据相关文献[13]选取浓度为1mM的NAC进行实验,结果显示NAC能够逆转但不能够完全恢复ox-LDL对MSCs的抑制作用,提示在该过程中还有其它因素参与其中,下一步作者拟通过体内实验研究ox-LDL对MSCs特性和内皮分化的影响及其机制。
本研究明确ox-LDL能够抑制 MSCs增殖和MSCs细胞表面标记Oct-4的表达,而抗氧化剂NAC却能够逆转ox-LDL对MSCs的抑制作用,进一步证实了ox-LDL可能通过氧化应激方式抑制MSCs的增殖和细胞表面标志的表达,而抗氧化剂使氧化应激水平降低甚至消退时,ox-LDL对MSCs的抑制作用也随之降低甚至消退。而研究显示心血管疾病个体体内EPCs的数量明显减少[6-8],是否与其骨髓间充质干细胞分化受到抑制导致内皮细胞的生成减少相关?而Ox-LDL是动脉粥样硬化和冠心病等心血管事件发生发展的关键环节之一,在本研究明确ox-LDL抑制MSCs生物学特性基础上,拟通过进一步实验验证其是否抑制MSCs的内皮分化及其可能机制。
[1]Urbich C,Dimmeler S.Endothelial progenitor cells:characterization and role in vascular biology[J].Circ Res,2004,95(4):343-353.
[2]Jiang Y,Vaessen B,Lenvik T,et al.Multipotent progenitor cells can be isolated from postnatal murine bone marrow,muscle,and brain[J].Exp Hematol,2002,30(8):896-904.
[3]Breyer A,Estharabadi N,Oki M,et al.Multipotent adult progenitor cell isolation and culture procedures[J].Exp Hematol,2006,34(11):1596-1601.
[4]Chu L,Jiang Y,Hao H,et al.Nitric oxide enhances Oct-4 expression in bone marrow stem cells and promotes endothelial differentiation[J].Eur J Pharmacol,2008,591(1/3):59-65.
[5]Bhartiya D,Kasiviswanathan S,Unni SK,et al.Newer insights into premeiotic development of germ cells in adult human testis using Oct-4as a stem cell marker[J].J Histochem Cytochem,2010,58(12):1093-1106.
[6]Chen JZ,Zhang FR,Tao QM,et al.Number and activity of endothelial progenitor cells from peripheral blood in patients with hypercholesterolaemia[J].Clin Sci(Lond),2004,107(3):273-280.
[7]Davignon J,Ganz P.Role of endothelial dysfunction in atherosclerosis[J].Circulation,2004,109(23suppl 1):III-27-III-32.
[8]Wang X,Chen J,Tao Q,et al.Effects of ox-LDL on number and activity of circulating endothelial progenitor cells[J].Drug Chem Toxicol,2004,27(3):243-255.
[9]Imanishi THT,Nishio I.Oxidized low-density lipoprotein induces endothelial progenitor cell senescence,leading to cellular dysfunction[J].Clin Exp Pharmacol Physiol,2004,31(7):407-413.
[10]Chen J,Mehta JL,Haider N,et al.Role of caspases in Ox-LDL-induced apoptotic cascade in human coronary artery endothelial cells[J].Circ Res,2004,94(3):370-376.
[11]Chu L,Hao H,Luo M,et al.Ox-LDL modifies the behaviour of bone marrow stem cells and impairs their endothelial differentiation via inhibition of Akt phosphorylation[J].J Cell Mol Med,2011,15(2):423-432.
[12]Cominacini L,Garbin U,Pasini AF,et al.Oxidized lowdensity lipoprotein increases the production of intracellular reactive Oxygen species in endothelial cells:inhibitory effect of lacidipine[J].J Hypertens,1998,16(12Pt 2):1913-1919.
[13]Heitzer T,Schlinzig T,Krohn K,et al.Endothelial dysfunction,oxidative stress,and risk of cardiovascular events in patients with coronary artery disease[J].Circulation,2001,104(22):2673-2678.
[14]Itabe H,Ueda M.Measurement of plasma oxidized lowdensity lipoprotein and its clinical implications[J].J Atheroscler Thromb,2007,14(1):1-11.



