陈 佳,但 伶,田泽丹,黄 燕,周 瑜,张昭莉
(1.重庆医科大学附属第二医院麻醉科400000;2.重庆市肿瘤研究所护理部400030)
高强度聚集超声(HIFU)治疗,是近年来得到广泛应用的局部无侵入式治疗技术之一,其主要作用机制除热效应外,还有机械效应、空化效应。空化效应为HIFU治疗中重要的作用机制之一,国内外大量研究表明[1-2],加入微气泡,可增强超声空化作用,导致机体损伤加重,发生溶血、出血、炎性反应、微血管通透性增加等。关于在HIFU治疗患者中使用N 2 O麻醉是否会增强超声透光区域的组织损伤,国内外目前尚无相关报道。本实验旨在通过观察、比对HIFU治疗患者术中腹壁厚度、血清中游离血红蛋白(FHb)、细胞黏附分子1(ICAM-1)含量的影响,探讨N2O的使用是否加重了组织损伤,及其与超声空化作用的关系。
1 资料与方法
1.1 一般资料 选取50例2012年2~6月本院HIFU肿瘤中心治疗的原发性肝癌患者。所有患者ASA分级均为Ⅰ~Ⅱ级。本次试验经重庆医科大学科研伦理学会批准。
1.2 方法
1.2.1 分组与治疗 将患者分为对照组(C组)、试验组(N组),每组25例。C 组男20例,女5例;平均年龄(51±12)岁;体质量(61±4)kg。N组男18例,女7例,平均年龄(53±9)岁;体质量(59±5)kg。两组患者性别、年龄、体质量等一般资料比较,差异无统计学意义(P>0.05)。C组采用全凭静脉麻醉方式,麻醉诱导:咪达唑仑0.1 mg/kg,丙泊酚2 mg/kg,维库溴铵0.1 mg/kg,芬太尼3μg/kg。麻醉维持:丙泊酚5 mg·kg-1·h-1,维库溴铵0.08mg ·kg-1 ·h-1,瑞芬太尼10μg ·kg-1·h-1。N组麻醉诱导同C 组,麻醉维持则在C组基础上加入N2O,以1∶1比值吸入。呼吸参数:新鲜气体总流量3 L/min,潮气量8 m L/kg,呼吸频率12 次/min,吸呼比2∶1。
1.2.2 标本采集 患者入室后,常规监测生命体征,建立静脉通道。分别于麻醉前(T1)、手术前(T2)、术中第1 小时(T3)、第2 小时(T4)、第3小时(T5),及术后24 h(T6)抽取桡动脉血,送实验室离心,转速3000 r/min,15 min,取上层血清0.5 m L,按试剂盒说明书要求保存。
1.2.3 标本测量 (1)HIFU治疗仪超声显像系统:记录术前、术后腹壁皮肤厚度。(2)血清中FHb 含量的测定:试剂盒购自南京建成生物科技研究所。检测采用类过氧化物酶反应法,利用FHb 中亚铁血红素具有类过氧化物酶活性,催化过氧化氢释放新生态氧使酚、4-氨基安替比林显色的原理,将血清样本制备成待测样本溶液。在分光光度仪(Multiskan Go,Thermo Scientific 公司)510 nm,光径1 cm处比 色,使 用空白管(蒸馏水)调零,测定样品管吸光度,按公式计算出血清中FHb 含量。(3)血清中ICAM-1 含量的测定:检测采用双抗体夹心ELISA法,试剂盒购自欣博盛生物科技有限公司,按试剂盒说明书操作步骤,用酶标仪(DU730 型,Beckman Coulter 公司)在450 nm处测出样品孔血清光密度(OD)值,通过与标准孔、空白孔的对照,求出血清中ICAM-1 含量。
1.3 统计学处理 采用SPSS17.0 软件进行统计学分析,所有计量资料用±s表示。两组数据组间比较采用独立样本t检验,组内比较采用配对资料t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 患者手术相关参数 患者的手术时间、超声治疗频率、超声治疗功率比较差异无统计学意义(P<0.05)。见表1。
表1 患者手术相关参数比较(±s)

表1 患者手术相关参数比较(±s)
组别 手术时间(min) 治疗频率(Hz) 治疗功率(W)C 组178±161336±10 N组182±181330±13
2.2 治疗透光区域皮肤厚度 手术后N组腹壁厚度增厚程度较C 组明显,差异有统计学意义(P<0.05)。见表2。
表2 手术开始前与结束时患者腹壁厚度值比较(±s,cm)
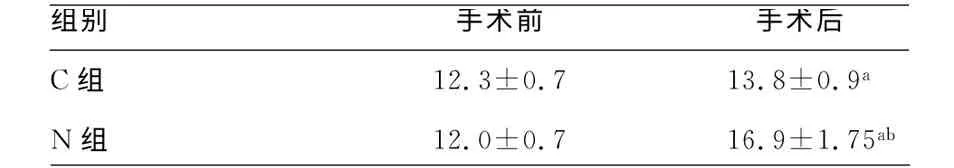
表2 手术开始前与结束时患者腹壁厚度值比较(±s,cm)
a:P<0.05,与术前比较;b:P<0.05,与C 组比较。
组别 手术前 手术后C 组 12.3±0.713.8±0.9 a ab N组 12.0±0.716.9±1.75
2.3 FHb、ICAM-1 含量变化T1、T2时间点FHb、ICAM-1含量比较差异均无统计学意义(P>0.05)。T3、T4、T5时间点,C 组和N组FHb 及ICAM-1 含量与前一时间点比较均升高,差异有统计学意义(P<0.05);同一时间点,N组FHb 及ICAM-1 含量升高程度较C组明显,差异有统计学意义(P<0.05),随N2O麻醉时间延长,N组升高程度较C 组愈加明显。T6时间点,FHb及ICAM-1含量与术前差异无统计学意义(P>0.05)。见表3、4。
表3 两组患者不同时间点FHb 含量变化(±s,mg/L)

表3 两组患者不同时间点FHb 含量变化(±s,mg/L)
a:P<0.05,与前一时间点比较;b:P<0.05,与C 组比较。
组别 T1 T2 T3 T4 T5 T 6 C 组 32.10±10.1232.44±10.4434.81±10.91a 39.09±11.88a 43.15±13.72a 32.22±9.72 N组 33.01±12.3632.78±12.7852.72±22.94ab 70.15±31.67ab 98.97±44.18ab 33.28±12.91
表4 两组患者不同时间点ICAM-1 含量变化(±s,ng/m L)

表4 两组患者不同时间点ICAM-1 含量变化(±s,ng/m L)
a:P<0.05,与前一时间点比较;b:P<0.05,与C 组比较。
组别 T1 T2 T3 T4 T5 T 6 C 组 512.62±53.14523.16±55.21557.15±62.32a 578.27±67.23a 592.16±76.40a 520.42±54.13 N组 520.72±53.20526.21±56.42596.83±76.14ab 760.65±111.33ab 959.62±137.62ab 529.22±57.41
3 讨 论
3.1 N2O对H I FU治疗患者FHb 含量的影响 红细胞在机械性损伤、温度变化等条件下受损,红细胞内的Hb 被释放到血清中,引起血清FHb 含量增加。因此,检测血清FHb 含量,是判断红细胞是否受损的金标准,其含量的变化表明机体内红细胞被破坏的严重程度[3]。大量红细胞被破坏导致机体发生急性溶血反应。由表3 可知,在手术开始1h 后,随HIFU手术时间延长,两组血清FHb 含量呈进行性增加(P<0.05);表明HIFU手术的进行导致红细胞受到破坏;在T3、T4、T5时间点两组比较,N组血清中F H b含量较C组明显增加(P<0.05);提示在HIFU手术过程中加入N2O,使红细胞受破坏程度更为严重,机体发生了愈加明显的溶血反应。分析其原因,可能是N2O作为气体进入机体内,引起微气泡数量增多。有报道指出[4-5],在HIFU的照射下,超声微气泡可降低超声辐照区域的空化阈值,增强超声空化效应,从而加重对组织细胞的损伤性生物学效应。其作用机制如下,(1)机械损伤[6]:大量微气泡内爆产生高速微射流及冲击波,可导致细胞发生变形、破裂。(2)热损伤[7]:增强超声空化效应中的热聚集,使相邻细胞迅速升温,当集聚的温度超过其正常生理范围时,使细胞在高温下变性、坏死。(3)自由基损伤:超声空化效应的增强,能导致血液中的水分子产生氧自由基和羟自由基[8],多项研究表明,自由基可从多个方面对组织及细胞产生毒性作用[9]。
3.2 N2O对H I FU治疗患者ICAM-1 含量的影响ICAM-1是血管内皮细胞上主要黏附分子之一,有研究表明,ICAM-1含量升高与血管内皮细胞损伤程度呈正相关,是血管内皮细胞损伤的特异性标志[10-11]。由表4 可见,在手术开始1h 后,随HIFU手术的进行,两组血清ICAM-1含量增多,提示HIFU手术造成血管内皮细胞受损;在T3、T4、T5时间点两组相比较,血清ICAM-1 含量N组较C组明显增多(P<0.05),提示在HIFU手术中使用N 2 O麻醉,导致血管内皮细胞受损程度更为严重。作者认为,其可能与前述红细胞损伤加重的原因相同,即加入N2O引起微气泡数量增多,空化效应增强,从而通过机械损伤、热损伤、自由基损伤等导致血管内皮细胞损伤加重。
本研究观察到在HIFU治疗过程中,使用N 2 O麻醉的患者在治疗结束后超声透光区域的皮肤,较未使用N2O麻醉者明显肿胀,这可能与微血管内皮细胞损伤相关,微血管壁内皮细胞受损导致血管内皮细胞间隙增宽,从而引起微血管通透性增加。凌智瑜等[12]对组织中超声辐照微气泡进行研究,在电镜下看到,其增强的空化效应使血管内皮细胞受损、间隙增宽,从而导致血管内物质渗入组织中,这可能是机体组织水肿加重的原因之一。
综上所述,在HIFU治疗患者麻醉过程中加入N2O,导致机体损伤加重,引起FHb 及ICAM-1含量增加,可能是由于N2O引起微气泡的增加,增强了超声空化效应所致。当然,其发生机制有待于进一步研究论证,但本试验可为麻醉医师在HIFU手术中选择麻醉方案提供参考,同时也对超声空化效应以及超声微泡造影剂的研究起到提示作用。
[1] Edwin L,Carstensen EL,Gracewski S,et al.The search for cavitation in vivo[J].Ultrasound Med Biol,2000,26(9):1377-1385.
[2] 李莎,张金龙,崔海等.微泡增强的超声空化效应对兔肌肉和肺微血管的损伤作用[J].第三军医大学学报,2013,35(22):2439-2442.
[3] 吴波,方国恩.游离血红蛋白主要测定方法及输入过量对机体影响的研究进展[J].实用医药杂志,2008,25(5):612-614.
[4] Dijkmans PA,Juffermans LJ,Mustets RJ,et al.Microbubbles and ultrasound:from diagnosis to therapy[J].Eur J Echocardiogr,2004,5(3):245-256.
[5] 李佩倞,左松,刘政等.间歇式发射对微泡超声空化损伤小血管的增强作用[J].临床超声医学杂志,2007,9(10):577-580.
[6] Cochran SA,Prausnitz MR.Sonoluminescence as an indicator of cell membrane disruption by acoustic cavitation[J].Ultrasound Med Biol,2001,27(6):841-850.
[7] Umemura S,Kawabata K,Sasaki K.In vivo acceleration of ultrasonic tissue heating by microbubble agent[J].IEEE Trans Ultrason Ferroelectr Freq Control,2005,52(10):1690-1698.
[8] 张洪吉,夏和生.聚焦超声生成羟自由基的检测[J].广州化工,2008,36(6):47-48.
[9] Melodelima D,Chapelon JY,Theillere Y,et al.Combination of thermal and cavitation effects to generate deep lesions with an endocavitary applicator using a plane transducer:ex vivo studies[J].Ultrasound Med Biol,2004,30(1):103-111.
[10] 赵保胜,宓穗卿,张银卿.冰片对大鼠脑微血管内皮细胞ICAM-1 表达量的影响[J].中药新药与临床药理,2001,12(2):88-90.
[11] 段绍斌,李学雄,姚华,等.多器官功能障碍综合征时血管内皮细胞损伤的研究[J].新疆医科大学学报,2010,33(3):271-274.
[12] 凌智瑜,王志刚,冉海涛,等.超声微泡造影剂对心肌组织毛细血管通透性的影响实验研究[J].中国超声医学杂志,2004,20(5):11-14.



