陈伟民,李 峰,黄达德,陈文广
(广东省广州市第一人民医院心胸外科510180)
心脏移植已成为治疗终末期心脏病的惟一有效手段。但是供心短缺严重制约了心脏移植的进一步发展。由于脑死亡供者(DBD)日趋匮乏,人们开始寻找DBD以外的供体。更广意义上的心脏死亡供者(DCD)器官重新得到重视,包括开展DCD心移植的探索[1-5]。近年一种新的药物Rho-激酶(ROCK)的抑制剂“法舒地尔”在保护器官抗缺血-再灌注(ischemia-reperfusion,I-R)损伤方面,效果显着[6-7]。本课题旨在探讨法舒地尔对猪缺血诱导的DCD心的保护机制及保存效果,为今后人类缺血诱导的DCD供心保护、开发和利用,提供实验依据。
1 材料与方法
1.1 实验动物 健康杂种家猪16只,雄性,体质量(28±3)kg,由广州医学院实验动物中心提供,分为实验组和对照组各8 只。
1.2 试剂 盐酸法舒地尔注射液,规格为30 mg/2 m L,购自天津红日药业股份有限公司。其他化学试剂均为分析纯,购自广州化学试剂厂。
1.3 实验方法 参照本研究组既往的方法[8-9]进行。
1.3.1 实验组 (1)动物氯氨酮15~20 mg/kg肌肉注射诱导麻醉;氯氨酮2 mg/kg 间断静脉注射、持续异丙酚4~6 mg·kg-1·h-1 静脉泵入维持麻醉;维库溴铵2 mg/kg静脉注射诱导肌松和0.1 mg ·kg-1 ·h-1 静脉泵入维持肌松。麻醉成功后气管切开并插管、固定,呼吸机辅助呼吸,采用容量控制型通气模式,吸入氧浓度(FiO2)40%~50%,潮气量(VT)8~10 mL/kg(开胸后12 m L/kg),通气频率(F)20~25次/min。进行心电监测、鼻咽温度监测。解剖显露颈静脉,穿刺置管建立静脉通道,测定中心静脉压;解剖显露股动脉,穿刺置管,接压力换能器和心电监测仪,监测动脉血压;抽血监测动脉血气(p H 、PO2、PCO2、SO2%、HCT)。正中切口开胸,撑开胸骨,剪开心包,显露心脏。游离升主动脉、主肺动脉、上腔静脉、下腔静脉,稍抬起心尖,显露冠状静脉窦,细针穿刺采血,测定基础心肌酶;颈静脉注射肝素(3 mg/kg,要求ACT>480 s),经右心房荷包缝合,盲性插入冠状静脉窦逆行插管,引出冠状动脉血液,量筒测定半分钟冠状动脉血流量(×2 为冠状动脉流量),冠状动脉血液立即回注入动物血管内。经左心室心尖部荷包缝合处尖刀戳孔,插入测压管,接换能器、BIOPAC MP150数据放大器及PO-NE-MAH数字化数据采集/左心压力分析系统,测定左心室各项基础血流动力学数据。
1.3.2 动物放血、建立缺血诱导DCD心模型 经主动脉根部插入“Y”灌注针,固定。经“Y”灌注针一侧接头连接右心吸引,开始快速放血,诱导心脏停跳[心脏缺血至完全停跳,历时(14±4)min]。血液引入人工心肺机储血器中,加入其他成分(1000 mL 血加入肝素20000 IU、甲泼尼龙琥酸钠500 mg、青霉素40 万IU、庆大霉素12 IU、葡萄糖1.1 g、普通胰岛素10 IU)进行预充。心脏缺血停跳后(血压为零,心脏停止跳动或室颤)继续室温下静置,观察25 min,完成DCD模型建立。
1.3.3 切心 心脏室温下静置25 min 后,迅速将上腔静脉用丝线两道高位结扎,于结扎线之间切断上腔静脉,下腔静脉上钳阻断,高位主动脉阻断,于主动脉根部灌注含法舒地尔的冷stanford 液(4 ℃,20mL/kg,60mm Hg 灌注),迅速剪断下腔静脉作右心减压;迅速剪开左心耳,行左心减压。靠近心包返折处切断所有右侧肺静脉、左侧肺静脉;心包腔放置冰泥(保持心脏局部深低温)。灌注完毕后,在弓部主动脉(左颈总动脉和左锁骨下动脉之间)处切断主动脉,在肺动脉分叉处切断主肺动脉,切断心脏后面附着的心包组织,取出心脏,立即置于冷stanford 液(4 ℃)中,心脏灌注插头插入主动脉,固定,迅速悬挂在langendorff 装置上(图1)。该装置基于心脏langendorff灌注原理,并整合人工心肺机,自行构建。人工心肺机储血器中血,经鼓泡肺充分氧合、加温,主泵将氧合温血泵至langendorff 灌注装置储血瓶中。通过调整储血瓶液面高度,达到不同离体心脏灌注压。由恒温水浴加温后,使灌注系统保持恒温。心脏灌注过程中,冠状静脉窦回流血,以右心吸引回收至储血器中,再次循环。
1.3.4 供心离体灌注 (1)平衡:供心悬挂在离体灌注装置上后,开启离体心脏灌注系统,充分排气后开放供心灌注通路,开始氧合温血灌注,心脏复跳(自动复跳,或必要时除颤)。平衡初始,以40 mm Hg 汞柱低压灌注;复跳成功后,改为常规60 mm Hg 汞柱压力灌注。右心室前壁放置一对起搏电极,予150 次/min 起搏;整个灌注实验过程中,灌注系统恒温在38.0℃,间断监测血气(p H、PO2、PCO2、SO2%、HCT)。经左心耳置入左心室测压水囊,接换能器、BIOPAC MP150数据放大器及PO-NE-MAH数字化数据采集/左心压力分析系统,监测各项心脏血流动力学指标;量筒收集1 min 冠状动脉回流血,为冠状动脉流量(coronary blood flow,CBF);取冠状动脉回流血,测定心肌酶;平衡20 min。平衡结束后,要求HR维持在每分钟(150±3)次左右、LVEDP 15~25 mm Hg、LVPDP≥90 mm Hg 及CBF保持稳定,未达到要求的猪心剔出实验。(2)冷浸浴原位保存:平衡结束后,钳闭主动脉灌注通路,停止心脏氧合血灌注;关闭心脏起搏器;经供心灌注管的侧孔,予单纯冷stanford 液再次灌注(4 ℃,10mL/kg,60mm Hg 重力),心脏停跳。同时,将含法舒地尔的冷stanford 液(1 L,4 ℃)加入储心瓶,供心保留在原位不动(储心瓶外壁用足量冰屑包埋),作供心原位冷浸浴保存2 h。在此期间,停止恒温水浴、体外循环机,氧合器血保持旁路循环。(3)供心复跳:供心保存结束后,立即摒弃储心瓶中的stanford 液,生理盐水灌洗储心瓶及下游管道1 次。重新开启离体心脏灌注系统,开放供心灌注通路,氧合温血恢复灌注,心脏渐复跳(自动复跳或必要时除颤),模拟临床上心脏植入吻合成功后,主动脉开放心脏复跳过程。主动脉开放后复灌1 h,停止心脏灌注,取下供心,结束实验。

图1 猪心脏langendorff 灌注装置
1.3.5 对照组 对照组整个实验过程中不使用“法舒地尔”(用等量生理盐水代替),其余同实验组。
1.4 监测指标
1.4.1 心脏血流动力学 缺血前、平衡结束后、供心保存后的复灌期,持续监测LVEDP、LVPDP、+dp/dt、-dp/dt、HR。
1.4.2 CBF缺血前、平衡结束后、供心保存复灌后30 min、复灌后60 min 时点,用量筒测定1 min冠状动脉血流量,为CBF。
1.4.3 心肌酶测定 缺血前、平衡结束后、供心保存后的复灌后30 min、复灌后60 min 时点采冠状静脉回流血,测定肌酸激酶(creatine,CK)、肌酸激酶同工酶(creatine kinase-MB,CKMB)、乳酸脱氢酶(lactate dehydrogenase,LDH)。使用本院生化室全自动血液生化仪及Beckman Coulter 公司试剂完成测定。
1.4.4 心肌组织含水量 灌注实验结束后,取下心脏,取右心室心肌组织约2 g,试纸拭干水分,称湿质量,80℃恒温干燥24 h,称干质量,按公式计算:心肌组织含水量(%)=(心肌组织湿质量-干质量)÷心肌组织湿质量×100%。
1.4.5 心肌梗死量(IV)上述心脏切除右心室,保留左心室,垂直左心室纵轴方向切成6 块切片,标本以1% 氯化三苯四氮唑(triphenyl tetrazoliumchloride,TTC)磷酸缓冲液染色20 min,10% 甲醛固定24 h,参照美国哈佛大学医学院BID医学中心方法[10],观察并测定心肌IV:即将梗死面积描记于专用薄膜上,在PC机上采用图像处理软件测量每张切片断面总面积(total area,TA)及断面中各小梗死灶面积,计算累积梗死灶面积(infarction area,IA),切片称质量。按下列公式计算出IV:每一切片梗死质量(mg)={[上断面(IA÷TA)]+[下断面(IA ÷TA)]×切片质量(mg)}/2;IV=∑各切片梗死质量(mg)/∑各切片质量(mg)。
1.4.6 心肌电镜观察 取左心室心尖部心肌组织标本(1 mm3大小),立即置于4 ℃2.5%戊二醛固定,50%~100%乙醇多级脱水,环氧树脂包埋,超薄切片,醋酸铀染色,透射电镜观察。
1.5 统计学处理 采用SPSS10.0统计软件进行统计学处理,计量资料以±s表示,两样本t 检验(两样本方差有显着差别,采用t′检验),P<0.05 为差异有统计学意义。
2 结 果
2.1 血流动力学指标变化 所有动物均完成实验,包括达到平衡、保存结束后成功复苏。缺血前、平衡后两组比较,各项心脏血流动力学指标比较,差异无统计学意义(P>0.05),见表1、2。
表1 缺血前心脏血流动力学(±s)

表1 缺血前心脏血流动力学(±s)
★:P>0.05,与对照组比较。
组别 LVEDP(mm Hg)LVPDP(mm Hg)HR(次/min) +dp/dt -dp/dt 15±0.5124.7±4.7120±41949±38.61428±48.9实验组 16±0.3★ 123.9±5.2★ 121±5★ 1972±43.2★1403±44.7对照组★
表2 平衡后心脏血流动力学(±s)

表2 平衡后心脏血流动力学(±s)
★:P>0.05,与对照组比较。
组别 LVEDP(mm Hg)LVPDP(mm Hg)HR(次/min) +dp/dt -dp/dt 22±2.1109±1.5150±31790±47.31358±40.4实验组 21±0.2★ 118±0.2★ 150±31803±45.7★1362±36.0对照组★
平衡开始时(实验组及对照组各1例)以及心脏保存结束复灌开始时(实验组2例、对照组3例)供心需除颤复跳。复跳后心肌红润,为窦性心律,自主HR为每分钟128~142 次;所有心脏均给予起搏,每分钟150 次起搏,转为起搏心律,心脏收缩有力。两组在复灌后30 min,实验组心功能优于对照组,差异有统计学意义(P<0.01),见表3;在实验结束时(复灌后60 min),两组心功能有下降趋势,但实验组仍优于对照组,差异有统计学意义(P<0.01),见表4。
2.2 CBF变化 缺血前、平衡后,两组差异无统计学意义(P>0.05);复灌后30 min、复灌后60 min,实验组均高于对照组,差异有统计学意义(P<0.01),见表5。
表3 复灌后30 min 心脏血流动力学(±s)

表3 复灌后30 min 心脏血流动力学(±s)
★:P<0.01,与对照组比较。
组别 LVEDP(mm Hg)LVPDP(mm Hg)HR(次/min) +dp/dt -dp/dt 21±3.9128±3.0150±31780±60.41349±45.0实验组 17±0.2★ 142±3.6★ 150±32228±48.9★1870±48.5对照组★
表4 复灌后60 min 心脏血流动力学(±s)

表4 复灌后60 min 心脏血流动力学(±s)
★:P<0.01,与对照组比较。
组别 LVEDP(mm Hg)LVPDP(mm Hg)HR(次/min) +dp/dt -dp/dt 35±3.9112±3.1150±31572±56.21144±41.2实验组 23±0.2★ 138±3.4★ 150±32043±42.5★1782±44.6对照组★
表5 不同时点CBF 测定(±s,m L/min)

表5 不同时点CBF 测定(±s,m L/min)
★:P<0.01,与对照组比较。
组别 缺血前 平衡后 复灌后30 min复灌后60 min对照组212±21.6204±20.3170±18.6146±16.4实验组 214±22.7206±21.3198±12.4★ 176±15.4★
2.3 心肌酶 两组缺血前、平衡后,各项心肌酶指标比较,差异无统计学意义(P>0.05)。复灌后30 min、复灌后60 min,两组均显着升高,实验组升高幅度明显低于对照组,差异有统计学意义(P<0.01),见图2。
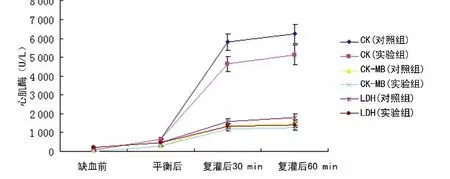
图2 冠状动脉回流血心肌酶测定
2.4 心肌含水量 对照组(80.3%±1.2%)明显高于实验组(77.9%±0.8%),差异有统计学意义(P<0.01)。
2.5 心肌梗死量 两组心肌各切片标本,肉眼可见散在、局灶性分布的梗死病灶。对照组(25.0%±0.4%)心肌梗死量明显高于实验组(16.0%±0.2%),差异有统计学意义(P<0.01)。
2.6 心肌电镜观察 (1)对照组:细胞核椭圆形、不规则形,核膜清晰,肌纤维排列正常,闰盘、Z 带欠清晰,线粒体轻度肿胀,部分嵴溶解,糖原颗粒减少(图3);(2)实验组:心肌细胞核呈梭形、长杆状、椭圆形,核膜清晰,常染色体呈细颗粒状,异染色体分布在核膜内侧,心肌纤维排列有序,闰盘、Z带清晰可见,肌原纤维间有杆状线粒体,有丰富糖原颗粒。线粒体均匀排列,可见清晰的线粒体嵴和膜(图4)。

图3 对照组电镜图像(×10000)

图4 实验组电镜图像(×10000)
3 讨 论
3.1 猪DCD心动物模型的探讨(1)猪DCD心离体心脏灌注模型选择:哺乳动物离体心脏灌注系统的概念,是由Oscar Langendorff[11]在一个多世纪前提出的,在生理学和药理学的研究中得到广泛应用。该技术使研究者在心脏无神经、体液调节等影响因素的条件下,可以研究其心功能、HR以及冠状动脉的特性等。通过升主动脉向冠状动脉灌注,由于灌流液压的作用,动脉瓣关闭,灌流液顺势流入冠状动脉,从而使心脏维持跳动数小时。其缺点为“非工作心”,不能改变心脏的前/后负荷做功。心脏只对开放的循环回路系统泵血。为此,Neely及Morgan[12]在20 世纪60年代提出“工作心”模型,并用于研究氧耗和心肌负荷关系。本研究重点观察心肌缺血-再灌注损伤,故仍采用Langendorff“非工作心”模型,其符合本实验的要求。(2)取心及主动脉插管技巧:尽量留有足够的主动脉长度,为此,需高位切断主动脉,以免插灌注管时,插管末端有堵塞冠状动脉开口可能。因此,本研究均选择在主动脉弓部(左颈总动脉和左锁骨下动脉之间)横断主动脉,取出供心,置于stanford 液(4 ℃)后,快速结扎弓部的头臂分支血管,主动脉断端插入主动脉灌注管,结扎固定,衔接至离体灌注装置上。(3)判断供心死亡的标准:以肉眼观察心脏完全停止跳动(或室颤)为心脏死亡标准,而非心电图的改变。因心脏停跳早期,心电图仍可有心电活动,即“电-机械”分离现象。(4)灌注压力选择及心麻液使用:本研究体外灌注时,供心在切心前及平衡后需再次停跳时,均采用冷stanford 液(4 ℃)灌注。有实验表明,切心时不用冷心麻液,结合在Langendorff 模型上全程采用低压(40 mm Hg)灌注,反而可提高供心保存质量[13]。作者仍认为,切心前使用stanford 液灌注;平衡结束后需再次停跳时,使用冷stanford 液灌注可使心脏迅速停跳。结合复跳前短暂控制性低压(40 mm Hg)灌注,一旦心脏复跳后恢复常规压力(60 mm Hg)灌注,在减轻心肌损伤方面应更有效。
3.2 盐酸法舒地尔对DCD供心的保护效果 (1)法舒地尔是一种蛋白激酶抑制剂,为细胞内钙离子拮抗剂。其抑制的对象ROCK,是一类相对分子质量为160 ×103的丝氨酸/苏氨酸蛋白激酶,可以介导下游一系列蛋白[如:肌球蛋白轻链磷酸酶(MLCP)、肌球蛋白磷酸酶(MYPT-1)等]磷酸化/脱磷酸化反应[14]。法舒地尔通过肌球蛋白轻链磷酸化,阻断血管收缩过程的最终阶段,扩张血管及抑制血管痉挛;抑制其他缩血管物质,阻止Ca2+内流,抑制无Ca2+存在的条件下肾上腺素或前列腺素所引起的血管收缩反应;增加烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的形成,抵抗氧自由基,抑制细胞骨架蛋白的降解,具有抗细胞凋亡作用;对中性粒细胞、单核细胞及巨噬细胞的聚集、变形、移动、浸润和吞噬具有直接的抑制作用,拮抗炎症因子分泌,发挥抗炎作用;增加内源性NO合成酶(e NOS)的表达,促进NO生成[15],产生直接扩血管作用。Shibata 等[6]证实,在缺血前及再灌注早期应用法舒地尔,可减轻局限性心肌顿抑模型冠状动脉阻断复制中的心肌顿抑损伤;Kobayashi等[7]也证实,使用法舒地尔,可改善UW液冷浸浴保存24 h 后的兔心心功能。再灌注前应用法舒地尔,能够有效预防内皮细胞功能障碍及减轻心肌梗死的发展。尤其在再灌注早期,缺血的心肌中Rho 的表达明显上调和ROCK激酶被激活[16]。本研究中,在stanford 灌注液中添加法舒地尔干预,观察到两组在实验结束后切取的心肌标本,存在梗死病灶,都为少量、散在的梗死灶改变,但实验组的梗死量明显小于对照组。因此,推测在切心前及供心冷保存期间应用法舒地尔具有减轻I-R损伤的作用。(2)心肌酶:复灌后30 min、复灌后60 min 检测各项心肌酶指标,发现均明显升高,实验组升高幅度显着小于对照组。由此,推测盐酸法舒地尔可以减少心肌酶的漏出。(3)CBF:法舒地尔具有强大的血管舒张作用。Yada 等[17]在狗的实验模型上也观察到,ROCK抑制剂能扩张血管及增加CBF,且呈剂量依赖性,最大效应剂量为0.1 mg/kg。法舒地尔增加冠状动脉流量的作用,推测与冠状动脉血管内皮功能得到保存及直接扩血管作用有关。血管内皮功能改善,有助于心肌灌注的改善,以及冷保存期后心肌蓄积的毒性代谢废物的排出。内皮细胞功能受损,表现为内皮细胞释放的NO下降。NO是由eNOS,以L-精氨酸为底物所合成,其可调节血管张力。(4)心功能变化:两组在失血前各项血流动力学指标比较,差异均无统计学意义(P>0.05)。实验组取心时,已用了法舒地尔,平衡结束后,与对照组比较,仍未见到血流动力学变化的差异,可能与法舒地尔作用时效性有关,即此时法舒地尔尚未起效。冷浸浴保存结束后复灌30、60 min,实验组各项血流动力学指标明显优于对照组,包括反映心脏舒张功能的指标(LVEDP、-dp/dt)和收缩功能的指标(LVPDP、+dp/dt)。推测在这些时间点,取心时使用的法舒地尔开始起效,并与冷浸浴保存时使用的法舒地尔产生了叠加效应。(5)法舒地尔介入的“时间窗”:本研究在缺血前不使用法舒地尔,是基于DCD器官获取的原则,即在这个时段,不应使用任何与获取器官有关的,可能加速或导致死亡的任何药物(除了吗啡、异丙酚等可降低供者脱离呼吸机时痛苦的药物,尽管其可能在减轻痛苦同时,也可能存在加速死亡的重叠效应)。尽管有人作鼠无心跳供体心的研究表明,供心缺血开始后,降温到32 ℃中度低温,有助于复灌期心功能的恢复[18],本研究仍采用室温下放置的方法,不作任何取心前的提前干预措施。且本实验在供心保存结束后的复灌期也未使用法舒地尔。因已有资料表明,法舒地尔有较强的扩血管作用,临床上,主动脉开放后复灌早期使用,有可能导致机体血流动力学不稳定,血压降低,并不推荐使用。综上所述,本研究只限于在stanford 液切心前心脏灌注,以及stanford液供心保存中使用。
本实验证明,对stanford 液心脏切心前灌注、stanford 液(4 ℃)供心浸浴保存两个时段,应用Rho 激酶抑制剂“法舒地尔”进行干预,可控制心肌梗死量,降心肌细胞酶,抑制心肌细胞凋亡,减轻心肌水肿,改善供心冠状动脉灌注,改善心功能,保存心肌超微结构完整性。提示法舒地尔能够减轻心肌I-R损伤,提高猪缺血诱导心脏死亡供者心保存效果。
(志谢:感谢本院麻醉科和体外循环组的大力协助和支持!)
[1] Noterdaeme T,Detry O,Hans MF.What is the potential increase in the heart graft pool by cardiac donation after circulatory death?[J].Transpl Int,2013,26(1):61-66.
[2] Yoo PS,Olthoff KM,Abt PL.Donation after cardiac death in pediatric organ transplantation[J].Curr Opin Organ Transplant,2011,16(5):483-488.
[3] White CW,Ali A,Hasanally D,et al.A cardioprotective preservation strategy employing ex vivo heart perfusion facilitates successful transplant of donor hearts after cardiocirculatory death[J].J Heart Lung Transplant,2013,32(7):734-743.
[4] Ali AA,White P,Xiang B,et al.Hearts from DCD donors display acceptable biventricular function after heart transplantation in pigs[J].Am J Transplant,2011,11(8):1621-1632.
[5] 陈良万,陈道中,杨国锋,等.61例心脏移植术的供心获取[J].中国胸心血管外科临床杂志,2009,16(3):296-299.
[6] Shibata I,Yoshitomi O,Use T,et al.Administration of the Rho-kinase inhibitor fasudil before ischemia or just after reperfusion,but not 30 min after reperfusion,protects the stunned myocardium in swine[J].Cardiovasc Drugs Ther,2008,22(4):293-298.
[7] Kobayashi M,Tanoue Y,Eto M,et al.A Rho-kinase inhibitor improve cardiac function after 24-hour heart preservation[J].J Thorac Cardiavasc Surg,2008,136(6):1586-1592.
[8] 黄达德,陈伟民,王德才,等.HOE-642联合尼可地尔对无心跳猪供心的保护作用[J].中华器官移植杂志,2008,29(5):432-436.
[9] 黄达德,陈伟民,谢建将,等.依达拉奉联合供心复跳后不停跳保存技术提高缺氧诱导无心跳猪供心移植效果[J].中华器官移植杂志,2011,32(4):741-745.
[10] Toyoda Y,Khan S,Chen W,et al.Effects of NHE-1 inhibition on cardioprotection and impact on protection by K/Mg cardioplegia[J].Ann Thorac Surg,2001,72(3):836-843.
[11] Zimmer HG.The Isolated Perfused Heart and Its Pioneers[J].News Physiol Sci,1998(13):203-210.
[12] Neely JR,Liebermeister H,Battersby E,et al.Effect of pressure development on oxygen consumption by isolated rat heart[J].Am J Physiol,1967,212(4):804-814.
[13] Garbade J,Krautz C,Aupperle H,et al.Functional,Metabolic,and morphological aspects of continous,normothermic heart preservation:effects of different preparation and perfusion techniques[J].Tissue Engineering,2009,15(2):275-283.
[14] Etienne-Manneville S,Hall A.Rho GTPases in cell biology[J].Nature,2002,420(6916):629-635.
[15] Fukata Y,Amano M,Kaibuchi K.Rho-Rho-kinase pathway in smooth muscle contraction and cytoskeletal reorganization of non-muscle cells[J].Trends Pharmacol Sci,2001,22(1):32-39.
[16] Zhang J,Bian HJ,Li XX,et al.ERK-MAPK signaling opposes rho-kinase to reduce cardiomyocyte apoptosis in heart ischemic preconditioning[J].Mol Med,2010,16(7/8):307-315.
[17] Yada T,Shimokawa H,Hiramatsu O,et al.Beneficial effect of hydroxyfasudil,a specific Rho-kinase inhibitor,on ischemia/reperfusion injury in canine coronary microcirculation in vivo[J].J Am Coll Cardiol,2005,45(4):599-607.
[18] Stadelmann M,Dornbierer M,Cl ément D,et al.Mild hypothermia during global cardiac ischemia opens a window of opportunity to develop heart donation after cardiac death[J].Transpl Int,2013,26(3):339-348.



