邱宇安,陈火国,李丽红,靳文剑,黄绍烈
(1.江西省肿瘤医院ICU,南昌 330029;2.江西省肿瘤医院内四科,南昌 330029;3.南昌大学第一附属医院心内科,南昌 330006)
论着·基础研究
黄芪含药血清对血管紧张素Ⅱ致内皮细胞凋亡的保护作用*
邱宇安1,陈火国2,李丽红2,靳文剑2,黄绍烈3
(1.江西省肿瘤医院ICU,南昌 330029;2.江西省肿瘤医院内四科,南昌 330029;3.南昌大学第一附属医院心内科,南昌 330006)
目的 观察血管紧张素Ⅱ(AngⅡ)对人脐静脉内皮细胞(HUVECs)的致凋亡效应及黄芪含药血清的保护作用。方法 将培养的ECV-304分为以下3组:(1)空白对照组;(2)AngⅡ诱导组,使培养基中AngⅡ终浓度为0、1×10-6、1×10-5、1×10-4mol/L,与细胞共孵育18 h。MTT法检测AngⅡ对HUVECs生长增殖的影响;流式细胞仪检测AngⅡ作用后内皮细胞凋亡率的变化;电子显微镜观察AngⅡ诱导后内皮细胞的超微结构特点;(3)黄芪含药血清干预组,培养基中加入不同浓度黄芪含药血清培养24 h后,加入AngⅡ(1×10-4mol/L)孵育18 h,检测内皮细胞凋亡率的变化。结果 不同浓度的AngⅡ均能抑制内皮细胞生长增殖。不同浓度的AngⅡ均可显着诱导内皮细胞凋亡。透射电镜下可见AngⅡ诱导后内皮细胞的凋亡形态。黄芪含药血清抑制AngⅡ所诱导的内皮细胞凋亡。结论 黄芪含药血清具有内皮保护作用。
血管紧张素Ⅱ;内皮细胞;凋亡;黄芪
血管内皮细胞的损伤和功能障碍是动脉粥样硬化(atherosclerosis,As)的启动环节。内皮细胞凋亡在As发生、发展过程中起重要作用[1-2]。血管紧张素Ⅱ(AngiotensinⅡ,AngⅡ)是已知最强的缩血管活性物质之一,它有多种效应参与As 进程[3-5]。中药黄芪具有益气养血之功效,黄芪注射液在临床上可用于冠心病及糖尿病肾病的治疗[6-7]。本课题旨在观察AngⅡ致内皮细胞凋亡效应及黄芪含药血清的内皮保护作用,探讨了AngⅡ与As发生的关系和黄芪含药血清的内皮保护效应。
1 材料与方法
1.1 材料与仪器 黄芪(江西省中医院中药房);Wistar大鼠(南昌大学实验动物科学部);人脐静脉内皮细胞株ECV-304(中国科学院上海细胞生物研究所);AnnexinV-FITC/PI试剂盒(美国BD公司);RPMI-1640培养基、胎牛血清(美国Gibco公司);AngⅡ原粉、MTT(美国Sigma公司);超净工作台(苏州安泰空气技术有限公司);酶标仪(芬兰 Thermo bioanalysis 公司);流式细胞仪(美国BeckmanCoulter公司);Titachi H-600 电子显微镜(日本日立公司)。
1.2 黄芪含药血清的制备 将黄芪水煎煮并浓缩至生药1g/mL。20只Wistar大鼠分入空白组、黄芪小剂量组、黄芪中剂量组和黄芪高剂量组。黄芪以成人临床日用量的大鼠等效剂量之1、2、4倍分别定义小、中、大剂量。每次灌药液4 mL,空白组灌等量生理盐水。在1周内连续每天给药2次,于末次给药2 h后心脏取血。于4 ℃静置2 h,低温离心机3 500 r/min离心15 min,分离血清。56 ℃恒温灭活补体30 min后,0.22 μm微孔滤膜过滤,-20 ℃低温保存,备用。
1.3 实验分组 在CO2培养箱内,用RPMI-1640培养基(含10%胎牛血清)培养ECV-304,0.25%胰酶及0.02%EDTA用于消化传代细胞。接种ECV-304于细胞培养板,待细胞生长至亚融合状态,进行实验分组:空白对照组和AngⅡ组,各组培养基中AngⅡ终浓度分别为1×10-6、1×10-5、1×10-4mol/L,培养18 h后,检测各组细胞活力及凋亡率。黄芪含药血清实验:将细胞分为阴性对照组(不作任何处理),空白对照组(加生理盐水),黄芪含药血清小、中、大剂量组,培养基中加入不同浓度黄芪含药血清培养24 h后,再加入AngⅡ(1×10-4mol/L)孵育18 h,检测该组内皮细胞凋亡率的变化。
1.4 MTT法检测细胞活力 取出细胞培养板,小心弃去上清液,PBS洗涤2~3次,每孔加入20 μL MTT(5 mg/mL),在培养箱37 ℃,5% CO2条件下培养4 h。小心吸去孔内培养液。每孔加入150 μL二甲基亚砜。低速振荡10 min,使结晶物充分溶解,在酶联免疫检测仪490 nm波长处测量各孔的吸光度值。
1.5 细胞凋亡检测 细胞消化收集后,制成单个细胞悬液,调整待测细胞密度为5×105~1×106/mL,取1 mL细胞用PBS离心洗涤,1 000 r/min,4 ℃离心10 min,共离心3次,弃上清液。将细胞重悬浮于200 μL结合缓冲液。加入10 μL AnnexinV-FITC和5 μL PI,轻轻混匀,避光室温反应15 min。加入300 μL结合缓冲液,流式细胞仪检测细胞凋亡。
1.6 电镜观察 收集细胞,离心沉淀后弃上清,2.5%戊二醛固定3 h,磷酸缓冲液清洗,丙酮梯度脱水,1%四氧化锇固定1.5 h,树脂包埋后进行超薄切片,经铀和铅双重染色后,置于透射电镜下观察。
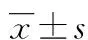
2 结果
2.1 AngⅡ对内皮细胞增殖的影响 用MTT法检测细胞活力:与空白对照组比较,不同浓度的AngⅡ对内皮细胞增殖均有抑制作用,差异均有统计学意义(P<0.01)。且随着AngⅡ浓度增加,抑制作用越明显。见表1。
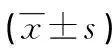
表1 AngⅡ对内皮细胞增殖的影响
a:P<0.01,与空白对照组比较;b:P<0.05,与1×10-6mol/L比较;c:P<0.05,与1×10-5mol/L比较。
2.2 AngⅡ致内皮细胞凋亡效应 流式细胞仪检测不同AngⅡ浓度组内皮细胞凋亡率,结果提示,在AngⅡ作用下,内皮细胞的凋亡率明显增加。与空白对照组比较,差异有统计学意义,且AngⅡ浓度越高,内皮细胞凋亡率越高,见表2。
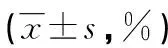
表2 AngⅡ诱导内皮细胞凋亡
a:P<0.01,与空白对照组比较;b:P<0.05,与1×10-5mol/L比较。

图1 电镜下凋亡内皮细胞超微结构(透射电镜×8 000)
2.3 电镜下凋亡内皮细胞超微结构的观察 内皮细胞经AngⅡ诱导后,见细胞膜完整,细胞质浓缩,细胞核染色质浓缩、边聚,呈团块状,表现为凋亡改变,见图1。
2.4 黄芪含药血清对AngⅡ诱导内皮细胞凋亡的影响 不同浓度黄芪含药血清培养24 h后,加入AngⅡ(1×10-4mol/L)孵育18 h,流式细胞检测。结果表明,不同浓度的黄芪含药血清均可使AngⅡ所致的内皮细胞凋亡率明显下降。提示黄芪含药血清有内皮细胞保护作用,见表3。
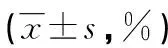
表3 黄芪含药血清对AngⅡ诱导内皮细胞凋亡的影响
a:P<0.01,与阴性对照组比较;b:P<0.01,与空白对照组比较;c:P<0.05,d:P<0.01,与黄芪含药血清小剂量组比较。
3 讨论
血管内皮细胞位于血液与血管组织之间。它能合成和分泌多种活性物质,实现复杂的生理功能。主要包括调节血管张力及血压水平、维持凝血和纤溶系统的动态平衡、调节炎症细胞的趋化、黏附和聚集等[8-9]。血管内皮细胞的损伤将有利于单核细胞的趋化迁移和脂质的沉积,导致As的发生。本研究证实AngⅡ可以通过诱导凋亡来产生抑制内皮细胞生长增殖的效应,此结果与国外学者Marampon等[10]研究结果相一致。说明AngⅡ能通过诱导内皮细胞凋亡造成内皮细胞损伤参与As的发生、发展。
东汉《金匮要略》上即记载有方剂“黄芪桂枝五物汤”,以黄芪为君药,主治血痹之证。祖国医学认为,黄芪具有益气固表、敛汗固脱、托疮生肌、利水消肿等功效[11]。杨庆有等[12]证实黄芪可以减轻心肌钙超载损伤,改善心肌的收缩和舒张功能。动物实验证实,黄芪具有抗动脉粥样硬化的作用[13]。黄芪注射液可能通过加强对氧自由基的清除,维持血管内皮正常的功能[14]。本研究从细胞凋亡的角度探讨了黄芪含药血清的内皮保护作用,此前未见报道。过程中,采用中药血清药理学研究方法,将中药给大鼠灌服后,用含有药物成分的血清进行体外实验,更接近药物在体内作用的真实过程[15]。相比直接使用中药粗制剂,可信度更高。
本研究观察到AngⅡ所诱导的血管内皮细胞凋亡能被黄芪含药血清所抑制,说明黄芪含药血清具有明确内皮保护作用。但黄芪成分复杂,作用广泛。具体是哪种有效成分,通过何种具体机制,产生抗内皮细胞凋亡的效应,有待于进一步深入研究与探讨。
[1]Choy JC,Granville DJ,Hunt DW,et al.Endothelial cell apoptosis:biochemical characteristics and potential implications for atherosclerosis[J].J Mol Cell Cardiol,2001,33(9):1673-1690.
[2]CuiGM,ZhaoYX,ZhangNN,etal.Amilorideattenuateslipopolysaccharide-acceleratedatherosclerosisviainhibitionofNHE1-dependentendothelialcellapoptosis[J].Acta Pharmacol Sin,2013,34(2):231-238.
[3]Schmidt-Ott KM,Kagiyama S,Phillips MI.The multiple actions of angiotensin Ⅱ in atherosclerosis[J].Regul Pept,2000,93(1/3):65-77.
[4]Takayanagi T,Eguchi A,Takaguri A,et al.A repressor protein,Mnt,is a novel negative regulator of vascular smooth muscle cell hypertrophy by angiotensin Ⅱ and neointimal hyperplasia by arterial injury[J].Atherosclerosis,2013,228(1):90-93.
[5]Wang Y,Tikellis C,Thomas MC,et al.Angiotensin converting enzyme 2 and atherosclerosis[J].Atherosclerosis,2013,226(1):3-8.
[6]王光浩,张敬芳,张学福,等.黄芪注射液对冠心病患者胰岛素、血糖和血脂水平的影响[J].中国动脉硬化杂志,2011,19(3):263.
[7]郑坤.氯沙坦钾联合黄芪注射液治疗早期糖尿病肾病的临床分析[J].重庆医学,2013,42(11):1231-1232.
[8]Kluge MA,Fetterman JL,Vita JA.Mitochondria and endothelial function[J].Circ Res,2013,112(8):1171-1188.
[9]Ntaios G,Gatselis NK,Makaritsis K,et al.Adipokines as mediators of endothelial function and atherosclerosis[J].Atherosclerosis,2013,227(2):216-221.
[10]Marampon F,Gravina GL,Scarsella L,et al.Angiotensin-converting-enzyme inhibition counteracts angiotensin Ⅱ-mediated endothelial cell dysfunction by modulating the p38/SirT1 axis[J].J Hypertens,2013,31(10):1972-1983.
[11]闫凌云.黄芪多糖对糖尿病肾病防治机制的研究进展[J].医学综述,2012,18(11):1727-1729.
[12]杨庆有,陆曙,孙慧茹.黄芪对慢性心力衰竭患者心功能与血清肿瘤坏死因子水平的影响[J].中国中西医结合杂志,2010,30(7):699-701.
[13]张俊峰,高振华,张桂英,等.黄芪三七有效成分配伍抗动脉粥样硬化作用的实验研究[J].山西中医,2008,24(10):44-45.
[14]李绚,阎蓉华,罗照田,等.黄芪注射液对人脐静脉血管内皮细胞的增殖作用[J].华西药学杂志,2005,20(1):48-49.
[15]王洪武,倪青,林兰.中药含药血清的研究进展及其在中医学中的应用[J].北京中医药,2008,27(9):698-701.
Protective effects of serum contained huangqi on endothelial cell apoptosis induced by angiotensinⅡ*
QiuYu′an1,ChenHuoguo2,LiLihong2,JinWenjian2,HuangShaolie3
(1.DepartmentofICU,JiangxiCancerHospital,Nanchang,Jiangxi330029,China;2.DepartmentofInternal4Ward,JiangxiCancerHospital,Nanchang,Jiangxi330029,China;3.DepartmentofCardiology,theFirstAffiliatedHospitalofNanchangUniversity,Nanchang,Jiangxi330006,China)
Objective To study AngⅡinduced apoptosis of HUVECs and to observe the protective effect of serum contained huangqi on endothelial cell.Methods ECV-304 cells were randomly divided into control group,AngⅡgroup and huangqi group.In the control group,cells were cultured for 18 h,and the concentration of AngⅡ were 0 mol/L,1×10-6mol/L,1×10-5mol/L and 1×10-4mol/L.The cell proliferation was measured by MTT assay.Electron microscope was used to observe the change of HUVECs.Ultrastructure of HUVECs induced by AngⅡ was observed by electron microscope.In the huangqi group,serum contained huangqi of different concentration were added into the medium and cultured for 24 h,then AngⅡ of 1×10-4mol/L was included and cultured for 18 h,and the apoptosis ratio induced by AngⅡwas measured by flow cytometry.Results AngⅡof different concentration could all significantly inhibit HUVECs proliferation.AngⅡof different concentration could all induce endothelial cell apoptosis.HUVECs apoptosis was observed by electron microscope.HUVECs apoptosis induced by AngⅡcould be inhibited by serum contained huangqi.Conclusion Serum contained huangqi could protect endothelial cells.
angiotensin Ⅱ;endothelial cell;apoptosis;huangqi
10.3969/j.issn.1671-8348.2015.06.008
江西省卫生厅中医药基金项目(2011A061)。 作者简介:邱宇安(1977-),副主任医师,硕士,主要从事中医研究。
R285.5
A
1671-8348(2015)06-0741-02
2014-10-15
2014-12-10)



